溶胶凝胶法制备Cu-Mn双金属复合氧化物及其催化降解甲苯
2019-12-21豆宝娟赵慧琦赵晨晨闫宁娜郝庆兰
豆宝娟,赵慧琦,赵晨晨,闫宁娜,郝庆兰
(天津科技大学化工与材料学院,天津 300457)
大气中的挥发性有机污染物(volatile organic compounds,VOCs)不仅严重危害人体健康[1],而且还是空气中光化学烟雾和细颗粒物(PM2.5)的前驱物质,严重污染生态环境.随着我国工业的快速发展,VOCs 的排放量逐年增加.近年来,我国在《中华人民共和国环境保护法》和《中华人民共和国大气污染防治法》等法规中新增了对VOCs 排放的限制[2]. 甲苯作为VOCs 工业排放的典型物质,排放企业众多,排放量居高不下,造成严重污染.催化氧化法作为末端处理VOCs 的有效方法之一[3],具有起燃温度低、净化效率高、无二次污染等优点[4].
过渡金属成本低,毒性小,可替代贵金属作为催化氧化VOCs 的催化剂[5-6].利用过渡金属Cu-Mn 间的相互作用,制备Cu-Mn 双金属复合氧化物催化剂,有利于提高催化剂降解VOCs 的活性[7-9].添加储氧释氧能力高的和热稳定性强的可改善过渡金属复合氧化物的活性和稳定性.Tang 等[11]和Lu 等[7]制备的MnCeOx和Cu-Mn-Ce 复合氧化物催化剂完全降解甲苯的温度分别为245 ℃和220 ℃.对比发现:多金属复合有利于减少副产物的产生;Cu 比Mn 更易进入CeO2晶格中形成固溶体.
采用生物基材料替代化学造孔剂(草酸(OA)或乙二醇(EG))也可制备复合氧化物催化剂[11-12].细菌纤维素(BC)作为一种新型的生物质原料,具有多孔性、亲水性和较大的比表面积[13].Yang 等[14]用细菌纤维素作模板剂合成的La2CuO4纳米晶体催化剂在甲烷重整实验中呈现出优异的催化活性.但采用BC作为溶胶凝胶法的造孔剂制备复合氧化物催化剂还鲜有文献报道.本文采用溶胶凝胶法以水凝胶的形式制备了Cu-Mn 双主金属Ce-Zr 双助剂催化剂,在固定床反应器上评价了催化剂活性,探究生物造孔剂(BC)和化学造孔剂(OA、EG)对Cu-Mn 双金属催化剂降解甲苯活性的影响.
1 实 验
1.1 催化剂制备
按照n(Cu)∶n(Mn)=1∶1、n(Ce)∶n(Zr)=3∶1、n(Cu+Mn)∶n(Ce+Zr)=1∶1 的比例将硝酸铜、硝酸铈、硝酸锆和醋酸锰溶解于100 mL 去离子水中.在搅拌状态下将15 g 造孔剂(BC、OA 或EG)在50 ℃下加入到上述溶液中,维持搅拌并且加热到80 ℃至形成凝胶.将上述凝胶在室温下老化48 h,在105 ℃下干燥12 h,在550 ℃马弗炉中于空气气氛下焙烧2 h,即得催化剂Cu0.25Mn0.25Ce0.375Zr0.125Ox,其催化剂中CuO 的质量分数为20%,MnO2的质量分数为17%.以BC、OA 或EG 为造孔剂制备的3 种组成相同的Cu-Mn 双主金属催化剂在下文中分别用CM-BC、CM-OA 和CM-EG 进行表示.
1.2 催化剂表征
1.2.1 低温N2物理吸脱附
催化剂织构性质采用Autosorb-iQ-MP 型全自动比表面积与孔径分析仪测定.先将样品在300 ℃下真空脱气4 h,再将样品在液氮中冷却至-196 ℃,然后进行低温N2吸脱附实验.通过BET 方法计算催化剂比表面积,采用BJH 方法计算孔径分布曲线.
1.2.2 X 射线衍射(XRD)分析
X 射线衍射由DX-2700 型X 射线衍射仪测定,Cu 靶作为衍射源(λ=0.154 1 nm),X 射线管电压为40 kV、电流为30 mA,扫描步长0.06°,角度范围为5°~85°,扫描速率为2°/min.
1.2.3 拉曼光谱(Raman)分析
采用激光共聚焦显微拉曼光谱仪对催化剂进行分析.该设备配备488 nm 激光器,高速光栅尺反馈平台(HSES)为100 nm 步长,行程范围为112 mm×76 mm,光谱范围为10~9 000 cm-1,光谱分辨率为1 cm-1,通光效率大于30%.
1.2.4 程序升温还原(H2-TPR)
催化剂的程序升温还原(H2-TPR)使用PCA-140型化学吸附仪进行测定,TCD 检测.将100 mg 催化剂填充在U 形石英管中,先用载气(Ar 气)对催化剂进行预处理,然后在程序升温下用流量为50 mL/min的5%H2/Ar 混合气对催化剂进行还原,升温速率为10 ℃/min.
1.3 催化剂评价
以甲苯为VOCs 目标污染物,在固定床反应器内对催化剂进行评价,催化剂评价装置示意图[13,15]如图1 所示.该反应装置主要由VOCs 饱和蒸气发生器系统、混气系统、固定床反应器和尾气在线检测系统 组成.
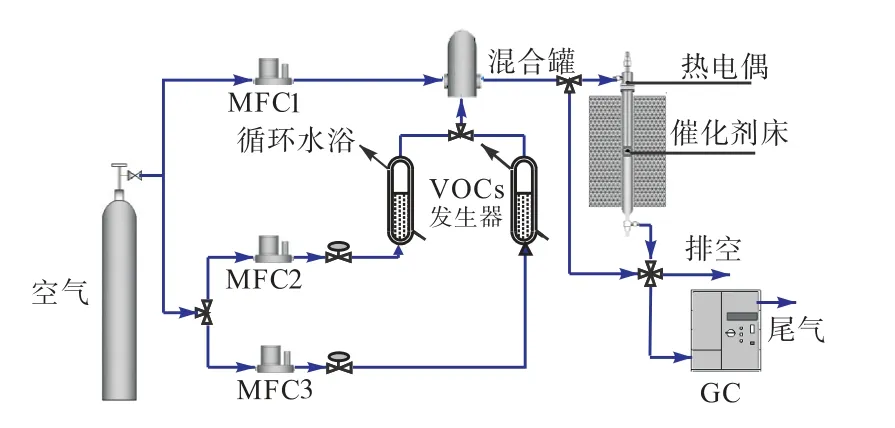
图1 催化剂评价实验装置示意图 Fig. 1 Schema of apparatus for catalyst evaluation
将甲苯液体加入饱和蒸气发生器中,通过控制水浴温度保证甲苯气体的稳定产生.调节空气流量和夹带气路流量控制甲苯进气浓度维持在225 mg/m3,空速为24 000 h-1.将0.8 g(20~30 目)催化剂装填于固定床反应器的中部,然后将混合后的气体通入反应器中进行反应.反应后的尾气用GC 2014 型气相色谱仪(日本岛津)在线检测,TCD 检测器检测CO2浓度,FID 检测器检测甲苯的浓度.
1.4 催化剂的活性与选择性计算
催化剂的活性用甲苯的转化率表示,计算公式见式(1).

式中:x 为甲苯的转化率;ρin、ρout分别为反应器中甲苯的进口、出口质量浓度,mg/m3.
催化剂的CO2选择性根据式(2)计算.

式中:Sc为CO2的选择性;ρ1为尾气中CO2的质量浓度,mg/m3;n 为甲苯中的碳原子数.
2 结果与讨论
2.1 催化剂表征
2.1.1 催化剂的织构性质
3 种催化剂的N2物理吸脱附等温曲线和孔径分布如图2 所示,表1 列出了催化剂的比表面积、平均孔容和平均孔径.
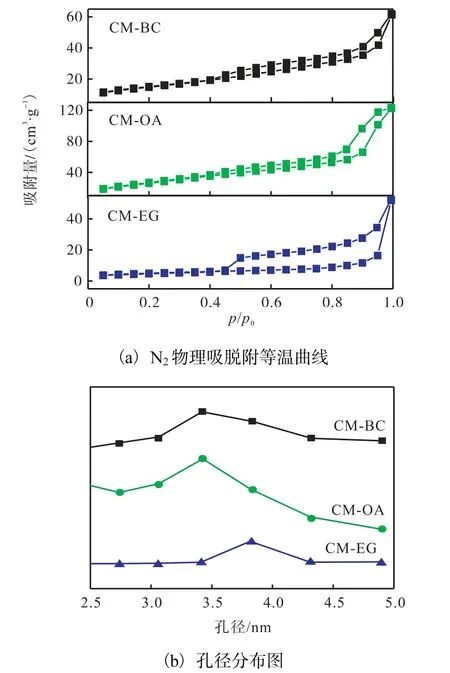
图2 不同催化剂的N2物理吸脱附等温曲线和孔径分布图Fig. 2 N2 physical adsorption/desorption isotherm curves and pore size distribution of different catalysts
由图2(a)可知:3 种催化剂均为典型的Ⅳ型等温吸脱附曲线,在相对压力p/p0=0.45 处出现拐点,呈现出介孔毛细凝聚,对应的孔道直径在介孔[16]范围内;当相对压力p/p0>0.45 时,吸附和脱附曲线分离,表现出了H4 型回滞环,表明均匀粒子间堆积孔的存在[17].由图2(b)可知:3 种催化剂的孔径呈单峰分布,孔径主要集中在2.5~5 nm.由表1 给出的催化剂的比表面积可知,用OA 为造孔剂制备得到的催化剂的比表面积最大,达到了128.0 m2/g.
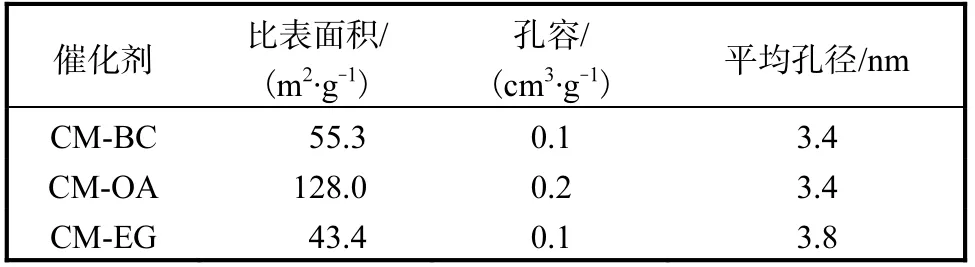
表1 不同催化剂的织构性质 Tab. 1 Texture properties of different catalysts
2.1.2 催化剂的晶体结构
3 种催化剂以及CuO 和CeO2的XRD 谱图如图3 所示.
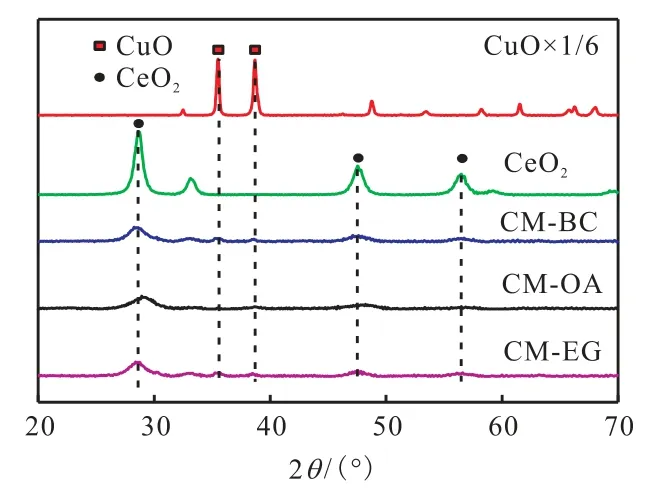
图3 不同催化剂的XRD谱图 Fig. 3 XRD patterns of different catalysts
由图3 可知:所有催化剂在35.5°和38.7°处均出现了极微弱的CuO 特征衍射峰,表明CuO 在催化剂表面有很轻微的团聚现象发生.未检测到MnO2的特征衍射峰,说明Mn 高度分散在了催化剂的表面.在28.5°、47.5°、56.3°处出现的衍射峰归属于CeO2的衍射峰[6],说明催化剂均保持了CeO2萤石结构;但与纯CeO2衍射峰相比,3 种催化剂的CeO2衍射峰均变宽变弱,并同时向高角度偏移;这是由CeO2晶格参数减小所致[15],CeO2晶格中的Ce4+(0.097 nm)被半径小的 Cu2+(0.072 nm)、Mn4+(0.056 nm)以及 Zr4+(0.084 nm)所取代[7],从而导致CeO2晶格扭曲现象发生,这有利于Cu-Mn-O-Ce-Zr 固溶体的形成,进而使催化剂产生更多的氧空位[18].氧空位可以提高催化剂吸附氧分子的能力,进而促进催化剂催化氧化甲苯活性的提高[13].
2.1.3 催化剂表面的氧物种和氧空位浓度
不同催化剂的拉曼光谱图和氧空位浓度图如图4 所示.
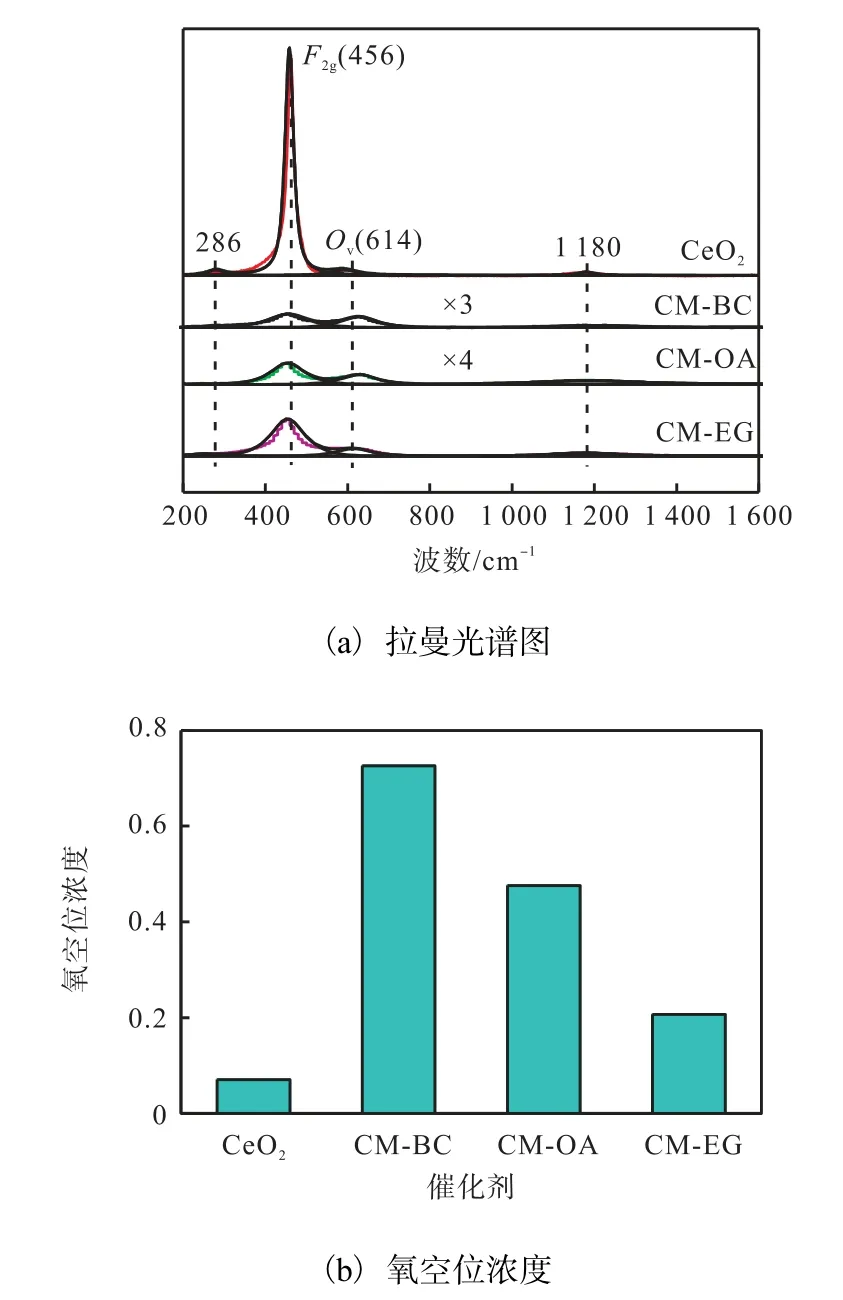
图4 不同催化剂的拉曼光谱图和氧空位浓度 Fig. 4 Raman spectra and oxygen vacancy concentration of different catalysts
由图4(a)可看出:CeO2在456 cm-1处有一个强的Raman 峰,这是由Ce-O 振动单元的对称拉伸所引起的[13].而3 个催化剂在456 cm-1处的Raman 峰明显变弱且向低波数偏移,可能是由催化剂中CeO2晶胞参数减小造成的,这与催化剂的XRD 表征结果相一致.此外,催化剂中氧空位的存在也可以引起456 cm-1处Raman 峰的变化[13].
催化剂的氧空位浓度可通过氧空位Ov振动峰的峰面积和F2g振动峰的峰面积之比(Ov/F2g)得到[15]. 由图4(b)的氧空位浓度图可知:3 个催化剂的氧空位浓度明显高于CeO2的氧空位浓度,CM-BC 催化剂的氧空位浓度最高,达到了0.726.这表明CuO、MnO2和ZrO2进入CeO2晶格中可以产生更多的氧空位;造孔剂对催化剂的氧空位浓度有影响,与化学造孔剂相比,以BC 为造孔剂制备的催化剂有利于氧空位的产生,具体原因还在进一步研究中.氧空位有利于晶格氧的迁移,从而有利于提高催化剂的活性.
2.1.4 催化剂的还原性
不同催化剂的H2-TPR 谱图如图5 所示.从图5中可看出,催化剂的耗氢峰均可以拟合为α、β、γ 和δ 4 个峰,其对应的耗氢量见表2.
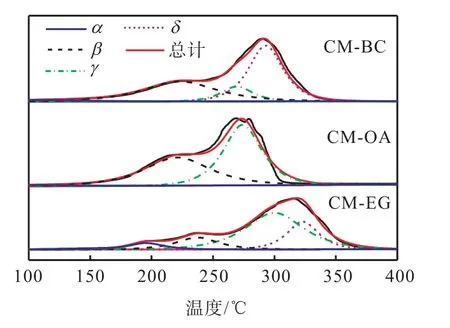
图5 不同催化剂H2-TPR谱图 Fig. 5 H2-TPR spectra of different catalysts
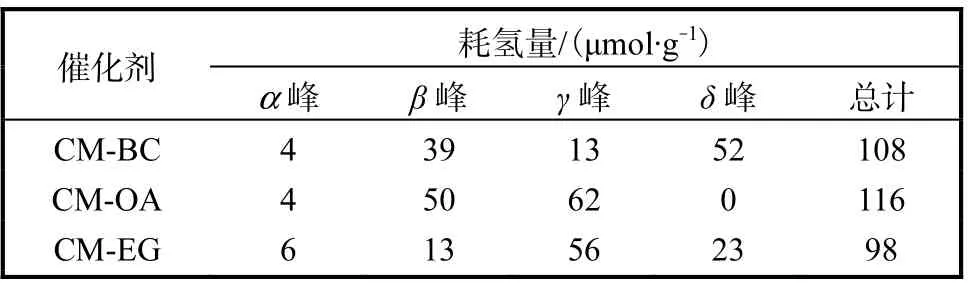
表2 不同催化剂的H2消耗量 Tab. 2 H2 consumption of different catalysts
150~200 ℃的α 峰对应于与CeO2有强烈的相互作用的表面CuO 的还原峰[13];200~250 ℃的β 峰应归属于高度分散的CuO 的还原峰[16];250~300 ℃的γ 峰对应于体相CuO 的还原峰[3];高于300 ℃的δ 峰对应于Mn 氧化物的还原峰,可归因于Cu-Mn 固溶体的形成[19].催化剂H2-TPR 谱图中出现的β 峰和γ峰与前述XRD 的表征结果相一致.当催化剂降解VOCs 的温度低于250 ℃时,α 峰和β 峰的还原温度和相应的耗氢量对催化剂活性影响较大.
由图5 还可知:造孔剂对催化剂的还原性能有影响,CM-BC 和CM-OA 的α 峰和β 峰的还原温度明显低于CM-EG 催化剂的还原峰,且其对应的耗氢量也较高.3 种催化剂的还原温度均比纯CuO[16]和MnOx要低[17],这是由于CuO 和CeO2之间存在强的协同作用,提高了催化剂表面的活性氧物种的流动性,有利于Cu2+/Cu+和Ce3+/Ce4+之间的氧化还原循环,从而提高了催化剂的还原性[13].
2.2 催化剂活性评价
3种催化剂降解甲苯的活性评价和CO2选择性如图6 所示.由图6(a)可知:催化剂的甲苯转化率随温度的升高而增加,CO2选择性随甲苯转化率同步升高,说明本研究制备的催化剂在降解甲苯时无副产物产生.但造孔剂的种类对催化剂的活性有显著的影响,采用BC 制备的CM-BC 催化剂具有最好的催化活性,T90(甲苯转化率达到90%时对应的温度)为227 ℃,其完全降解甲苯的T100为240 ℃;而采用化学造孔剂OA 和EG 制备的CM-OA 和CM-EG 催化剂的T100分别为250 ℃和270 ℃.
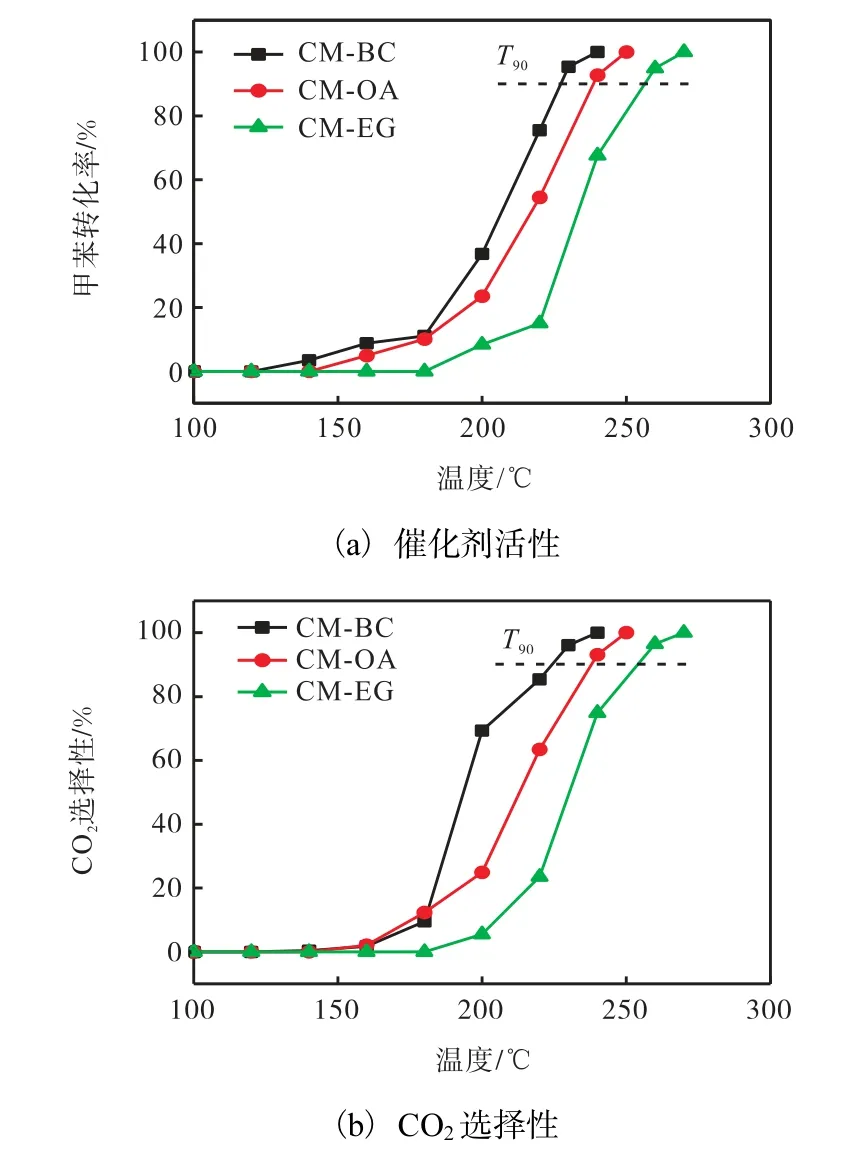
图6 不同催化剂活性及CO2选择性 Fig. 6 Catalytic activity and CO2 selectivity of different catalysts
结合前述的表征结果可知:较高的氧空位浓度和较强的还原性是影响催化剂活性的主要因素.CMBC 和CM-OA 催化剂的α 峰和β 峰还原温度较低、耗氢量较高,所以其催化活性比CM-EG 要高;但当催化剂的还原性差别不明显时,氧空位浓度对催化剂活性的影响更为重要,CM-BC 的氧空位浓度为0.726,明显高于CM-OA 的0.476,所以CM-BC 完全降解甲苯的T100比CM-OA 低10 ℃.
3 结 语
采用溶胶凝胶法制备的Cu-Mn 双主金属Ce-Zr双助剂Cu0.25Mn0.25Ce0.375Zr0.125Ox催化剂均具有介孔结构,Cu-Mn 双金属与CeO2的协同作用,使得催化剂能在较低的温度下还原,催化剂中CeO2晶格扭曲现象的发生,有利于Cu-Mn-O-Ce-Zr 固溶体的形成,使催化剂在降解甲苯过程中均表现出较好的催化活性和CO2选择性.采用生物造孔剂BC 制备的CMBC 催化剂在240 ℃就可完全降解甲苯,其活性明显高于化学造孔剂(OA 和EG)制备的CM-OA 和CMEG 催化剂.CM-BC 催化剂较高的氧空位浓度(0.726)有利于氧物种的迁移,从而促进甲苯催化氧化反应的进行.在溶胶凝胶法制备催化剂的过程中采用绿色BC 作为造孔剂,可以促进催化剂制备的绿色化发展,但其在催化剂制备过程中的作用机制,有待进一步研究.
