基于荧光共振能量转移构建关-开型复合荧光探针快速检测沙门氏菌
2019-12-20崔雯雯徐琳琳史艳宇董娜陈萍
崔雯雯 徐琳琳 史艳宇 董娜 陈萍
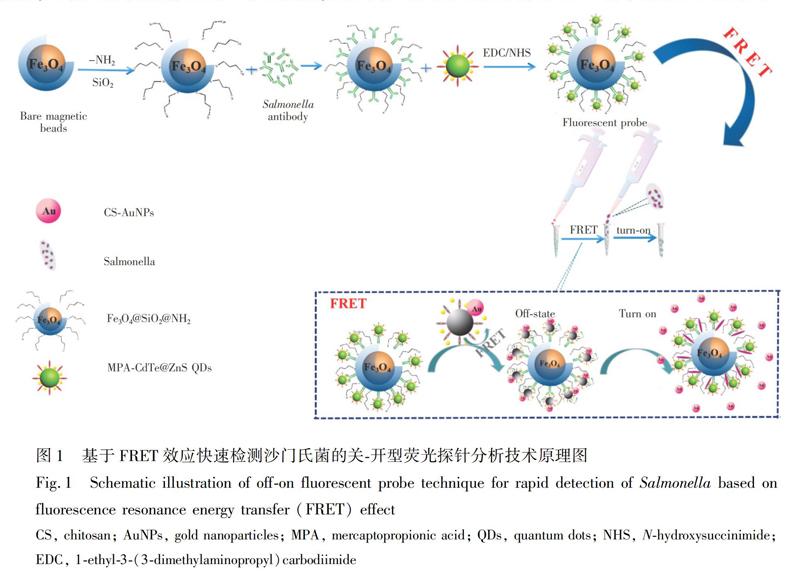
摘 要 将经硅烷化以及氨基化修饰的功能化磁珠与沙门氏菌特异性抗体进行偶联,制备功能化免疫磁珠,通过近红外光谱、荧光光谱、紫外光谱等技术对其进行结构和活性表征。将功能化磁珠、抗体和量子点(QDs)进行有序组装,构建了集磁性富集分离和检测于一体的磁珠-抗体-QDs复合荧光纳米探针。基于此复合荧光纳米探针中的QDs与金纳米粒子(AuNPs)间的荧光共振能量转移 (FRET) 效应,建立了快速检测沙门氏菌的“关-开”型荧光分析方法。结果表明,复合荧光纳米探针的荧光恢复度与菌浓度的对数值呈良好的线性关系,线性回归方程为y=103.5x+121.4(R2=0.9956),检出限为102 CFU/mL(S/N=3),检测时间少于2 h。本方法特异性好,检出限低,灵敏度高,可满足食品中沙门氏菌快速检测的需求。
关键词 复合荧光纳米探针;荧光共振能量转移;快速检测;沙门氏菌
1 引 言
沙门氏菌(Salmonella)为肠杆菌科的革兰氏阴性短小杆菌[1],是引起食源性疾病的主要人畜共患病原菌之一[2],常通过受污染的食物传播,是主要的公共卫生威胁[3],可引起肠胃炎、伤寒、败血症等多种疾病[4,5],严重时可导致休克及意识障碍[6~8]。沙门氏菌的快速检测一直是世界各国关注的问题。我国国家标准GB4789.4-2016 《食品微生物学检验沙门氏菌检验》[9]中的方法需要对病原菌进行分离培养、生理生化鉴定,操作步骤繁琐,检测周期长,一般需要4~7 d才能确定检测结果[10],不能满足预防与监控中快速检测的需求。因此,建立简单、安全、快速的沙门氏菌检测方法备受关注[11,12]。
目前,沙门氏菌的快速检测方法主要包括聚合酶链式反应(PCR)[13,14]、核酸探针技术[15]、酶联免疫吸附测定(ELISA)[16]、表面等离子体共振(SPR)[17]等。虽然这些方法在检测速度、灵敏度以及特异性等方面较传统方法有了明显提高,但大部分检测方法需要大型的精密仪器以及繁琐的样品前处理过程,在现场快速检测方面受到了很大限制。随着纳米技术的发展,纳米材料因其优异的性能获得了广泛关注。研究者将纳米材料与荧光技术相结合,用于微生物的快速检测。1998年,Bruchez等[18]以及Warren等[19]将量子点(Quantum dots,QDs)作为荧光标记物,用于生物诊断与检测领域。Wang 等[20]利用沙门氏菌特异性抗体和金黄色葡萄球菌特异性抗体修饰 Fe3O4磁性纳米材料,分别用于分离食品体系中的沙门氏菌和金黄色葡萄球菌,结合表面拉曼散射分析,方法检出限达到103 CFU/ mL。荧光共振能量转移(Fluorescence resonance energy transfer,FRET)是一种非辐射能量转移形式,供体基团在激发状态下,通过电偶极子的相互作用,将能量从供体转移到受体。金纳米粒子(AuNPs)具有良好的生物相容性和穩定性,消光系数高,在FRET体系中可作为能量受体[21]。FRET基于其检测速度快和灵敏度高的优势,近年来广泛应用于免疫传感、核酸检测和微生物检测等多个领域。Jin等[22]开发了一种基于上转换荧光纳米粒子的新型FRET适配体传感器检测细菌,对大肠杆菌ATCC 8739的检测范围为5~106 CFU/mL,检出限为3 CFU/mL,并用于食品及水样中大肠杆菌的检测。免疫磁珠 (Immunomagnetic beads,IMBs) 是一种较好的免疫测定固相载体,操作简便快速。Xiong等[23]将大肠杆菌单克隆抗体与磁珠偶联用于捕获碎牛肉和牛奶中的大肠杆菌O157:H7,捕获效率分别为94.4%和99.8%,灵敏度高,特异性好。
本研究基于QDs与AuNPs之间的FRET效应,建立了“关-开”型荧光探针免疫分析方法。原理如图1所示,将功能化磁珠、抗体和量子点进行组装,构建“磁珠-抗体-量子点”复合荧光纳米探针。此荧光探针中经巯基丙酸修饰后的量子点含有羧基(COOH),带负电荷;经巯基乙胺修饰后的金纳米粒子溶液(CS-AuNPs)含有氨基(NH2),带正电荷,两种纳米材料由于静电作用拉近了彼此间的距离,且AuNPs的吸收光谱与QDs的发射光谱有很好的重叠,可发生有效的FRET[24],荧光探针的荧光被显著淬灭。加入目标菌后,目标菌通过抗原抗体反应与荧光探针结合,荧光探针与CS-AuNPs之间的距离增大,FRET效应被削弱,因FRET而淬灭的荧光信号恢复。本研究基于QDs和AuNPs间的FRET效应构建荧光关-开体系,建立了快速检测沙门氏菌的关-开型荧光探针免疫分析技术。此方法受背景基质干扰低,具有选择性高、快速、灵敏的优点,为沙门氏菌的快速检测提供了一种准确有效的方法。
2 实验部分
2.1 仪器与试剂
COIC荧光显微镜(重庆光电仪器有限公司);傅立叶近红外光谱仪、Zeta电位分析仪、UV1800紫外可见分光光度计(日本岛津公司);F-4500 型荧光分光光度计(日本日立公司)。
巯基乙酸(TGA,上海国药集团试剂有限公司);3-氨丙基三乙氧基硅烷(APTES)、N-羟基琥珀酰亚胺(NHS)、正硅酸乙酯(TEOS)、氯金酸(HAuCl4·4H2O)、1-乙基(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC·HCl),均购于阿拉丁公司;沙门氏菌抗体(博士德生物工程有限公司);巯基丙酸(MPA)修饰的CdTe量子点溶液(0.05 μmol/L,天津倍思乐色谱技术开发中心);实验菌种沙门氏菌 (ASII859)、福氏志贺菌(CMCC51252)、金黄色葡萄球菌(ASII861)、大肠杆菌(LE392)等均由吉林农业大学食品安全教研室保藏。所用试剂均为分析纯;实验用水为超纯水(>18.0 MΩ cm)。
2.2 Fe3O4@SiO2@NH2的制备
采用共沉淀法[25,26]制备裸磁珠(Fe3O4)和经SiO2包被的氨基化磁珠(Fe3O4@SiO2@NH2)。对Fe3O4和Fe3O4@SiO2@NH2进行近红外光谱表征分析,将Fe3O4@SiO2@NH2与抗体进行偶联制得免疫磁珠。取50 mL裸Fe3O4磁珠,加入50 mL无水乙醇和2 mL TEOS,通氮气,于60℃下搅拌反应10 h,磁分离,用无水乙醇和超纯水分别洗涤3~5次,定容至100 mL。取50 mg上述磁珠,用4 mL PBS缓冲液分散,超声30 min,加入2.5 mL 25%戊二醛,室温振荡反应3 h,用PBS缓冲液清洗3遍,最终将活化后的磁珠分散于缓冲液中,得到10 mg/mL Fe3O4@SiO2@NH2溶液。取1 mL(约10 mg)上述活化后的磁珠,加入6 mL沙门氏菌特异性抗体(1∶500稀释),室温振荡反应2 h,用PBS缓冲液洗涤3次,制得沙门氏菌特异性免疫磁珠,于4℃保存。
2.3 复合荧光纳米探针的构建
取等量0.024 mol/L Na2S溶液和0.032 mol/L ZnCl2溶液,在快速搅拌并通氮气条件下逐滴交替滴加到MPA修饰的CdTe QDs溶液中,在60℃条件下密闭搅拌反应1 h,得到MPA-CdTe@ZnS QDs溶液。将溶液转移到干净干燥的玻璃瓶中,密封后,在室温下静置。将制备好的QDs溶液与等体积的丙酮混匀,振荡5 min,10000 r/min离心5 min,用超纯水离心洗涤沉淀,再用超纯水悬浮,备用。
用EDC/NHS活化QDs表面的羧基。取100 μL MPA-CdTe@ZnS QDs溶液,向其中加入28.75 μL EDC(33.4 mmol/L,使用前现配)和27 μL NHS(70.9 mmol/L)溶液。充分混匀,在室温振荡反应15 min。取45 μL合成的免疫磁珠,加入到活化后的MPA-CdTe@ZnS QDs溶液中,25℃恒温避光轻微振荡反应2 h,然后进行磁分离,用PBS缓冲液重复洗涤3次,制得复合荧光纳米探针,于4℃下储存,备用。
2.4 金纳米粒子的合成
根据文献[27]的方法制备34 nm的巯基乙胺修饰的金纳米粒子(CS-AuNPs):将0.213 mol/L半胱胺盐酸盐和50 mL 1.4 mmol/L HAuCl4混合,在室温避光搅拌20 min后,迅速加入12.5 μL 10 mmol/L新制备的NaBH4溶液,继续剧烈搅拌30 min,制得的酒红色溶液用0.45 μm的微孔滤膜过滤后,于4℃保存。34 nm 的金纳米粒子的摩尔消光系数为6.06×109 L/(mol·cm) [28],由朗伯比尔定律可知,CS-Au NPs的浓度约为 0.83 nmol/L。
2.5 特异性抗体与AuNPs结合pH的优化
取数个1.5 mL离心管,分别加入1 mL CS-AuNPs,用0.1 mol/L K2CO3溶液分别调节至pH 4、5、6、7、8、9、10,分别加入到96孔板的孔中,并做3个平行,在每个CS-AuNPs的孔中各加入6 μL稀释后的特异性抗体,混勻后静置5 min,再加入100 μL 10% NaCl溶液,室温静置10 min,观察溶液颜色的变化,并测定上清液在520 nm处的吸收值(OD)。
2.6 复合荧光纳米探针与金纳米粒子结合体积比的优化
取10个1.5 mL 离心管,分别对其进行1~10标号,分别加入CS-AuNPs溶液100 μL,然后依次加入1、2、4、8、16、32、64、128、256、512倍比稀释后的CS-AuNPs各10 μL,混匀后在室温下放置15 min,再加入100 μL 10% NaCl,混匀后静置5 min,测定其在520 nm处的吸收值。
2.7 荧光关-开型检测方法的建立
2.7.1 复合荧光纳米探针对沙门氏菌的检测 取100 μL CS-AuNPs溶液于EP管中,加入10 μL复合荧光纳米探针,混合均匀后,于室温静置15 min,进行磁分离。取9个1.5 mL 离心管,1号管为空白管,2~9号管分别加入1 mL菌液浓度为1×101、1×102、1×103、1×104、1×105、1×106、1×107、1×108 CFU/mL的沙门氏菌菌液,再分别取100 μL 被CS-AuNPs淬灭后的复合荧光纳米探针加入各管中,将上述溶液恒温振荡反应20 min,磁分离,洗涤3次后,测定各溶液的荧光强度。
2.7.2 选择性实验 以沙门氏菌为目标菌,大肠杆菌、志贺氏菌、金黄色葡萄球菌为非目标菌,用建立的沙门氏菌的荧光关-开检测方法对其进行检测,考察此检测方法的特异性。
2.7.3 人工模拟污染沙门氏菌牛奶样品的检测 按照国标GB4789.4-2016《食品微生物学检验检验沙门氏菌》[9]的检测步骤对市售新鲜牛奶进行检测,证实牛奶中不含沙门氏菌。分别随机取不同浓度的沙门氏菌菌悬液加入到新鲜的牛奶样品中,37℃恒温培养箱中培养18 h。用建立的荧光关-开方法进行检测,同时进行平板菌落计数。
3 结果与讨论
3.1 Fe3O4和Fe3O4@SiO2@NH2的的表征
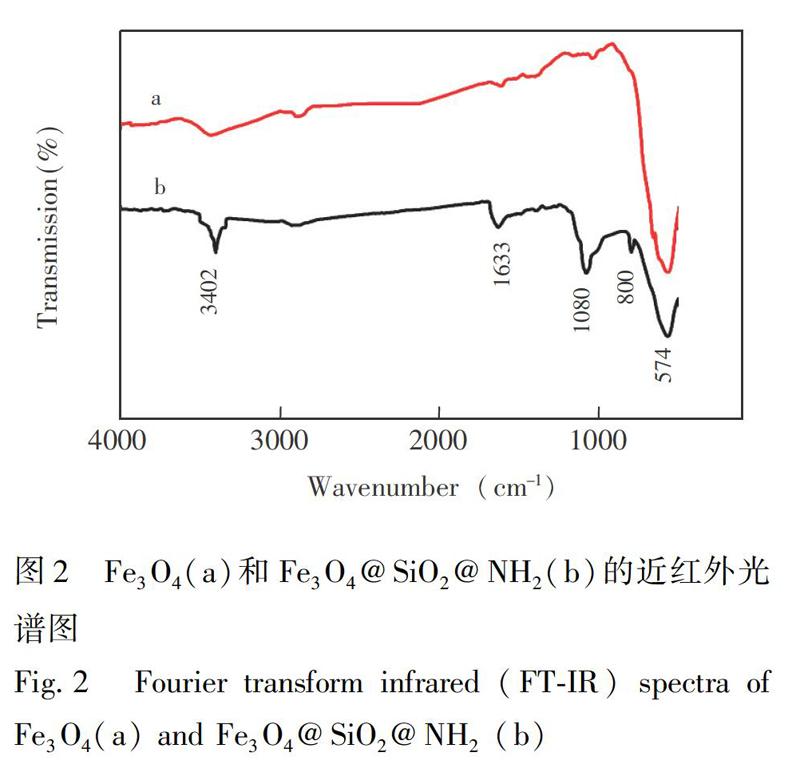
利用近红外光谱(FT-IR)对裸磁珠(Fe3O4)和硅烷化氨基化修饰的磁珠(Fe3O4@SiO2@NH2)进行表征(图2),由图2a可知,在574 cm1出现了一个较强的吸收峰,为处于氧四面体位和氧八面体位的FeO伸缩振动峰。通常Fe3O4的吸收峰在580 cm 1处,其微小差距可能由于纳米颗粒的尺寸效应,基团频率发生位移,由此证明样品的物相是Fe3O4。在图2b中,在3402 cm1处的强吸收峰归属于羧基中的OH键的伸缩振动,表明修饰后的磁珠表面引入了OH。1080 cm1处较强的吸收峰是SiOSi键的伸缩振动峰,800 cm1处为SiO的伸缩振动峰,表明SiO2成功包裹在Fe3O4磁珠表面。在3402 cm1处出现NH2的特征吸收峰,在1633 cm1处出现NH键的弯曲振动峰,表明氨基已成功修饰在Fe3O4磁珠表面。近红外光谱结果表明,Fe3O4磁珠已成功包被SiO2,并在表面修饰上氨基。
3.2 MPA-CdTe QDs和MPA-CdTe/ZnS QDs的光譜表征
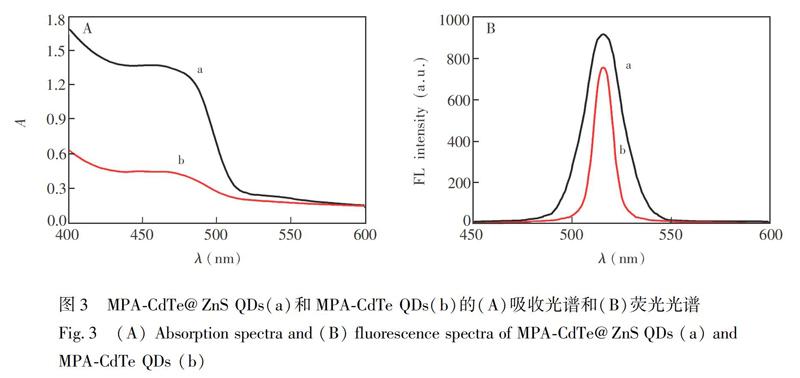
图3为MPA-CdTe QDs和MPA-CdTe@ZnS QDs的吸收光谱(A)和荧光光谱(B)。由图3A可知,MPA-CdTe QDs吸收峰位于446 nm处,MPA-CdTe@ZnS QDs的吸收峰位于456 nm处,与未修饰ZnS的MPA-CdTe QDs相比,MPA-CdTe@ZnS QDs吸收峰红移10 nm。由图3B可知,MPA-CdTe QDs和MPA-CdTe@ZnS QDs的荧光发射峰位于516 nm,修饰ZnS壳后,MPA-CdTe@ZnS QDs的荧光强度增加。
3.3 金纳米粒子对复合荧光探针淬灭条件的优化
优化了特异性抗体与 CS-AuNPs结合pH值以及淬灭剂CS-AuNPs用量。随着pH值增大,溶液在520 nm处的吸光度先增大后减小,颜色由蓝紫色变为红色,再变为蓝色,pH=8时吸光度最大,此时CS-AuNPs无明显变化,pH=9、10时,吸光度开始减小。当0.1 mol/L K2CO3加入量为40 μL时,溶液的吸光值最大,因此确定荧光探针与CS-AuNPs结合的最佳pH=8。考察了不同浓度的金纳米与抗体结合的最佳稀释梯度,确定CS-AuNPs标记最适抗体稀释度为15倍,此时荧光探针的荧光处于淬灭状态。
3.4 金纳米粒子对量子点的荧光淬灭机制
如图4A所示,CS-AuNPs最大吸收峰位于524 nm,光谱呈现出不对称分布状态,与文献[29,30]报道相一致。FRET的发生需要两个条件[31]: 一是存在合适的能量供体和受体; 二是供受体间的距离足够近(< 10 nm)。本研究制备的CS-AuNPs的吸收光谱与量子点的荧光发射光谱存在较大重叠,这为FRET提供了基础,且发现随着受体CS-AuNPs浓度的增加,其吸收强度逐渐增加,而供体的荧光发射强度逐渐降低,FRET效应具有浓度依赖的现象。由荧光探针淬灭前后荧光光谱(图4B)可知,加入CS-AuNPs后,探针的荧光强度明显降低,荧光发生淬灭。由图4C和4D可知,在最佳pH条件下,体系中CS-AuNPs与QDs的Zeta电位分别为35.7和15.4 mV,进一步证明由于静电引力,两者可发生有效的FRET。
3.5 基于复合荧光纳米探针关-开效应检测沙门氏菌
在检测体系中加入沙门氏菌,振荡反应20 min后,测定其荧光强度。
如图5所示,随着沙门氏菌浓度增加,复合荧光纳米探针的荧光逐渐恢复。体系的荧光恢复程度(F-F0)与菌液浓度的对数呈线性关系,线性方程为y=103.5x+121.4(R2=0.9956),检出限为1.7×102 CFU/mL(S/N=3)。
为了验证此体系的选择性,考察了非目标菌(Shigella flexneri,Escherichia coli,Staphylococcus aureus)对体系的影响情况。如图6A所示,随着沙门氏菌浓度增加,复合荧光纳米探针溶液的荧光强度逐渐增大,而非目标菌的加入,未引起体系荧光强度明显改变。图6B分别是加入目标菌和非目标混合菌后的荧光显微镜下图片。通过明视场与暗视场间的对比,图6B-b中菌体发出荧光,说明被淬灭的荧光得到恢复;图6B-d几乎观察不到荧光,说明非目标菌没有使淬灭的荧光恢复。上述结果表明,本方法对沙门氏菌的检测具有良好的特异性。
3.6 牛奶样品中沙门氏菌的检测
用复合荧光探针对人工模拟污染沙门氏菌的牛奶样品进行检测,并与国家标准沙门氏菌平板计数法[9]的检测结果进行比较,结果见表2。两种方法得出的数值基本一致,由图7可知,两种方法测定结果的线性相关方程为y=1.0029x-0.0184(R2=0.9998),表明本研究构建的检测体系可用于沙门氏菌的定量检测。
4 结 论
利用量子点和AuNPs间的FRET效应,建立了快速检测沙门氏菌的关-开型复合荧光纳米探针分析方法。构建了集磁性富分离和检测结果快速呈现功能于一体的“磁珠-抗体-量子点”复合荧光纳米探针,通过供体-受体自组装完成荧光淬灭,沙门氏菌通过抗原抗体反应与探针结合,使金纳米粒子与探针之间的距离增大,FRET效应减弱,实现荧光的turn-on响应。结果表明,荧光探针的荧光恢复度与菌液浓度的对数呈现良好的线性关系,检出限为102 CFU/mL,检测时间在2 h以内。本方法操作简单,特异性好,灵敏度高,满足快速检测食品中沙门氏菌的需求,具有良好的实际应用前景。
References
1 Xu L J,Liu Z J,Yang L,Chao Y,Hu Y C,Xie X L,Li Q C,Jiao X N. Avian Pathol.,2018,47(3): 238-244
2 Machado I,Garrido V,Hernandez L I,Botero J,Bastida N,San-Roman B,Grillo M J,Hernandez F J. Anal. Chim. Acta,2019,1054: 157-166
3 Saikia L,Sharma A,Nath R,Choudhury G,Borah A K. Indian J. Med. Microbiol.,2015,33(4): 503-506
4 Iwabuchi E,Maruyama N,Hara A,Nishimura M,Muramatsu M,Ochiai T,Hirai K. J. Food Prot.,2010,73(11): 1993-2000
5 Müller L,Kjels C,Frank C,Jensen T,Torpdahl M,Sborg B,Dorleans F,Rabsch W,Prager R,Gossner C M,Ethelberg S. Epidemiol. Infect.,2016,144(13): 2802-2811
6 WANG Xue-Shuo,CUI Sheng-Hui,XING Shu-Xia,DING Hong. Chinese Pharmaceutical Affairs,2013,27(9): 974-979
王学硕,崔生辉,邢书霞,丁 宏. 中国药事,2013,27(9): 974-979
7 Bacci C,Boni E,Alpigiani I,Lanzoni E,Bonardi S,Brindani F. Int. J. Food Microbiol., 2012,160(1): 16-23
8 Yan H,Li L,Alam M J,Shinoda S,Miyoshi S I. Int. J. Food Microbiol.,2010,143(3): 230-234
9 GB/T 4789.4-2016,Food Microbiological Examination Salmonella Examination. National Standards of the People's Republic of China
食品微生物学检验 沙门氏菌检验. 中华人民共和国国家标准. GB/T 4789.4-2016
10 KOU Xiao-Jing,GAO Feng,XIE Chun. China Anil Health Inspection, 2019,36(1): 85-91
寇晓晶,高 峰,谢 春. 中国动物检疫,2019,36(1): 85-91
11 WANG Wen-Juan,ZHAO Hong-Kun. Journal of Chinese Institute of Food and Technology,2011,11(3): 144-151
王文娟,赵宏坤. 中国食品学报,2011,11(3): 144-151
12 Fang H,Xu J,Ding D,Jackson SA,Patel I R,Frye J G,Zou W,Nayak R,Foley S,Chen J,Su Z Q,Ye Y B,Turner S,Harris S,Zhou G X,Cerniglia C,Tong W D. BMC Bioinformatics, 2010,11(S6): S4
13 Bai J F,Trinetta V,Shi X R,Noll L W,Magossi G,Zheng W L,Poter E P,Cernicchiaro N,Renter D G,Nagaraja T G. J. Microbiol. Methods,2018,148: 110-116
14 Zhou B,Liang T,Zhan Z,Liu R,Li F,Xu H. J. Dairy Sci.,2017,100: 8804-8813
15 CHEN Qing-Sen,FENG Yong-Qiang,HUANG Bao-Hua,WEI Guo-Xiang,PANG Guang-Chang,HU Zhi-He. Food Science,2003,11: 148~152
陈庆森,冯永强,黄宝华,魏国祥,庞广昌,胡志和. 食品科学,2003,11: 148-152
16 Jain S,Chattopadhyay S,Jackeray R,Abid C K,Kohli G S,Singh H. Biosens. Bioelectron.,2012,31(1 ): 37-43
17 Mazumda S D. Biosens. Bioelectron.,2010,25: 967-971
18 Bruchez M J,Moronne M,Alivisatos A P,Peter G,Weiss S. Science,1998,281(5385): 2013-2016
19 Warren C W,Nie S M. Science,1998,281(5385): 2016-2018
20 Wang Y,Ravindranath S,Irudayaraj J. Anal. Bioanal. Chem.,2011,399(3): 1271-1278
21 ZOU Xiao-Bo,SHI Yong-Qiang,ZHENG Yue,SHI Ji-Yong,HU Xue-Tao,JIANG Cai-Ping,HUANG Xiao-Wei,XU Yi-Wei. Chinese J. Anal. Chem.,2018,46(6): 960-968
邹小波,史永强,郑 悦,石吉勇,胡雪桃,蒋彩萍,黄晓瑋,徐艺伟. 分析化学,2018,46(6): 960-968
22 Jin B R,Wang S R,Lin M,Jin Y,Zhang S J,Cui X Y,Gong Y,Li A,Xu F,Lu T J. Biosens. Bioelectron.,2017,90: 525-533
23 Xiong Q R,Cui X,Saini J K,Liu D F,Shan S,Jin Y,Lai W H. Food Control,2014,37: 41-45
24 Bagdeli S,Rezayan A H,Taheri R A,Kamali M,Hosseini M. J. Lumin.,2017,192: 932-939
25 ZHOU Yan-Fen,MENG Zhe,WANG Ze-Lan,LI Ji-Guang,MEN Xiu-Qin,LIU Wan-Yi. Chem. J. Chinese Univ., 2018,39(10): 2253-2264
周艳芬,孟 哲,王泽岚,李吉光,门秀琴,刘万毅. 高等学校化学学报,2018,39(10): 2253-2264
26 ZHANG Dong-Fang,YUAN Fei,WANG Pin,HU Yue,CHEN Ying,GE Yi-Qiang. Food and Fermentation Industries,2011,37(8): 142-147
张东方,袁 飞,王 娉,胡 玥,陈 颖,葛毅强. 食品与发酵工业,2011,37(8): 142-147
27 Zheng J M,Zhang H J,Qu J C,Zhu Q X,Chen X G. Anal. Methods,2013,5: 917-924
28 Liu X,Atwater M,Wang J H,Qun H. Colloid Surface B,2007,58(1): 3-7
29 Wang M H,Yin H S,Zhou Y L,Meng X J,Waterhouse G I N,Ai S Y. Chem. Eng. J.,2019,365: 351-357
30 KE Qing-Qing,PEI Ji-Ying,YANG Fan,ZHANG Han-Chang,YANG Xiu-Rong. Chinese J. Anal. Chem.,2014,42(7): 955-961
柯慶青,裴继影,杨 帆,张汉昌,杨秀荣. 分析化学,2014,42(7): 955-961
31 Rodzik-CzaLka L,Lewandowskaańcucka J,Gatta V,Venditti I,Fratoddi I,Szuwarzyński M,Romek M,Nowakowska M. J. Colloid Interface Sci.,2018,514: 479-490
