在真空度为10-5>Pa下的液体电化学-飞行时间二次离子质谱联用技术研究
2019-12-20夏海伦华鑫龙亿涛
夏海伦 华鑫 龙亿涛
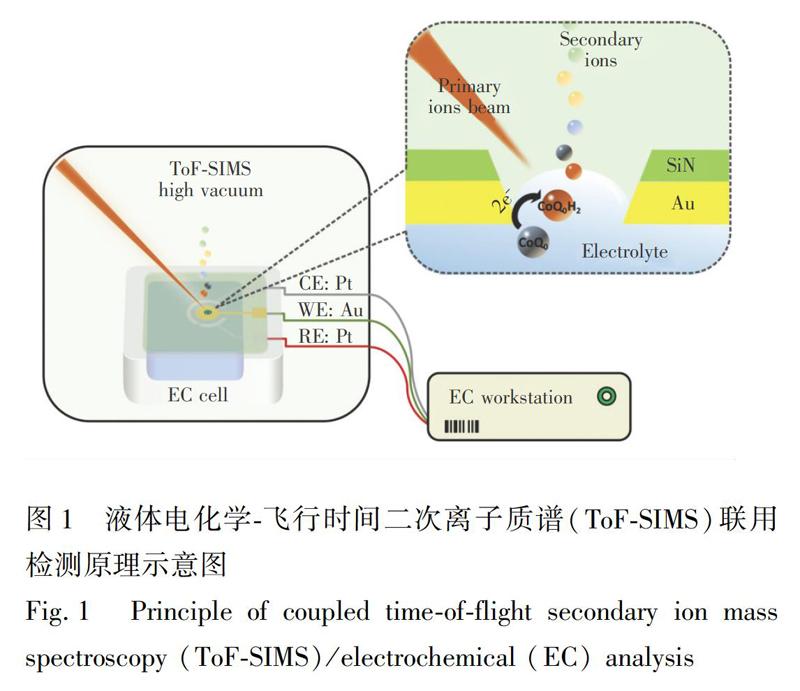
摘 要 传统电化学检测手段致力于研究电活性物质在电极表面的电子转移过程,却很难获得关于电极-电解质界面分子水平的信息。在分子水平实现电化学氧化还原反应中间体的原位检测,对研究电化学反应机理具有重要意义。本研究以辅酶Q0(CoQ0)在金电极表面的氧化还原过程为研究模型,通过构建可用于高真空环境下使用的微流控电化学反应池,在真空度低于105 Pa环境中实现液体电化学-飞行时间二次离子质谱(ToF-SIMS)联用。CoQ0及池体材料氮化硅在电极击穿前后的ToF-SIMS成像结果表明,此联用技术可用于高真空条件下液体样品的直接检测。由电化学工作站对微流控电化学池中的工作电极施加不同电压后,可检测到CoQ0、CoQ0H2及中间体的存在,其随电压相互转化关系与CoQ0在水溶液中的氧化还原行为一致。CoQ0及其还原产物的质谱信号强度的相对变化情况提供了电极表面CoQ0氧化还原过程的直接分子证据,进一步表明此联用技术在电极-电解质界面原位检测方面具有应用潜力,为电极表面电化学反应机理研究提供了更多信息。
关键词 辅酶Q0; 电极-电解质界面; 原位电化学检测; 飞行时间-二次离子质谱
1 引 言
電极表面是发生电化学氧化还原反应的场所,伴随着电子的转移以及电活性物质的转化。电极-电解质界面通常仅有几个分子层厚度,但其对于催化材料[1]、仿生界面[2]、锂离子电池[3,4]等领域的研究都具有指导意义。传统电化学检测手段致力于研究电活性物质在电极表面的电子传递过程,但无法直接提供电活性物质在电极表面的转化信息。实现对电活性物质界面行为的原位实时监测,对电化学反应机理的理解有重要意义。
电极-电解质界面检测的一大难点在于其厚度非常小,通常为亚微米级或纳米级[5];同时,有机电化学反应中间体通常稳定性差、寿命短,很难实现直接检测。传统的电化学检测手段提供的信息有限,需与其它高分辨率、高灵敏度的表面分析技术,如光谱[6]、X射线技术[7,8]、质谱[9,10]等联用以获取更多关于电极界面的结构及化学信息。其中质谱-电化学联用技术具有高灵敏度与高化学特异性,可提供关于界面物种的直接分子信息。飞行时间-二次离子质谱(Time-of-flight secondary ion mass spectrometry,ToF-SIMS)是一种高灵敏的表面分析技术,兼具对样品表面化学组成分布成像及纵向化学成分变化的分析能力,广泛应用于材料表征[11,12]、细胞成像[13,14]和微区分析[15,16]等方面。最近,其在液态样品(如水团簇研究领域[17])检测亦备受关注。如能实现ToF-SIMS与液体电化学池检测的联用,将其用于电极-电解质界面的原位动态分析,可为电化学反应过程中电活性物质的界面行为变化提供分子水平的信息。
辅酶Q是生物体内广泛存在的一类化合物,在生物体呼吸链质子转移与电子传递过程中起重要作用[18]。本研究以辅酶Q0(CoQ0)在金电极表面的氧化还原过程为模型,构建适用于高真空环境下的微流控电化学反应池,结合ToF-SIMS检测技术,实现了液体电化学-ToF-SIMS联用。拟通过聚焦离子束轰击电极背面,直接对电化学池中电解质溶液进行分析,获得不同电压下电解质溶液的质谱碎片,观察CoQ0及相关产物在金电极表面的强度变化情况,以期为电化学反应机理研究提供直接的分子依据。
2 实验部分
2.1 仪器与试剂
ToF-SIMS V飞行时间-二次离子质谱(德国ION-ToF公司); CHI660E电化学工作站(上海辰华仪器有限公司)。
CoQ0(98%,萨恩化学技术(上海)有限公司); KNO3(分析纯,国药集团化学试剂(上海)有限公司); 聚二甲基硅氧烷(PDMS,美国Dow Corning公司); 聚四氟乙烯管(PTFE,美国Sigma-Aldrich公司)。实验用水为超纯水(电导率 18 MΩ·cm),由Milli-Q(美国Millipore公司)净化。氮化硅电极芯片由上海纳腾仪器有限公司加工制得。
2.2 实验方法
2.2.1 微流控电化学池制备 微流控电化学反应池由三部分组成:氮化硅电极芯片、PDMS池体、外接电极导线。氮化硅电极芯片以金为工作电极,对电极及参比电极均为铂。电化学池池体通过PDMS浇筑而成,氮化硅电极芯片与PDMS池体表面经空气等离子体预处理60 s后,使氮化硅芯片与PDMS进行不可逆键合,确保ToF-SIMS高真空腔中电化学池的密封性。用银胶固定氮化硅电极芯片上的外接导线,接通PTFE导管,进行PDMS密封,即可获得高真空相容的电化学池。确认微流控电化学池整体密封性良好,可于105 Pa真空环境下使用后,即可向反应池内注入CoQ0溶液,池中电解质溶液体积约15 μL,密封并固定于ToF-SIMS样品托上备用。
2.2.2 液体电化学ToF-SIMS联用 液体电化学ToF-SIMS联用分析于高真空条件下进行,实验过程中,ToF-SIMS内部真空腔压力低于1×105 Pa。微流控电化学池整体结构及ToF-SIMS检测原理如图1所示。ToF-SIMS分析源采用30 ×104 eV Bi3+离子束,离子束束流约0.15 pA,横向分辨率为150 nm。在负离子模式下进行检测,以CH、CH2、O、OH 和Au对质谱峰进行校正。为实现液体电化学的原位实时检测,需于氮化硅表面构建微孔。通过模拟高真空环境下,不同孔径微孔中电解质溶液的形貌[19],并兼顾实际检测过程中离子信号的提取及孔内液体稳定性,选择2 μm的圆孔作为ToF-SIMS实际分析区域。通过聚焦离子束在样品表面进行逐点扫描,循环往复,直至微孔被击穿,同时获得微孔表面各处各物种化学分布情况。借助孔内液体的表面张力以避免池内液体溢出,维持ToF-SIMS腔内真空度。再经ToF-SIMS外接电路对真空腔内的电化学反应池施加电位,获得不同电位情况下,孔内金电极表面的电解质溶液的二次离子信息,分析金电极表面CoQ0氧化还原反应情况。
3 结果与讨论
3.1 CoQ0在电化学池中的循环伏安特性
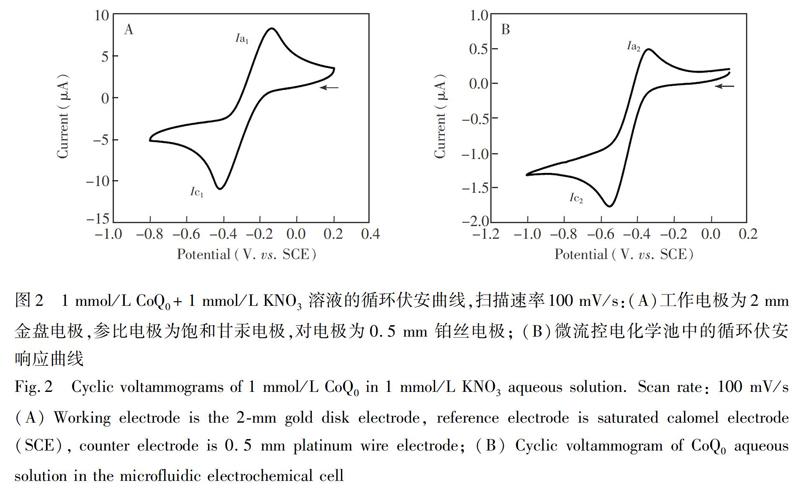
考察了CoQ0在微流控电化学池中的电化学响应行为,在100 mV/s掃描速率下,检测了1 mmol/L CoQ0在所构建微流控电化学池中的循环伏安响应曲线。以KNO3为支持电解质,当其浓度较高时,会存在基质效应,对ToF-SIMS检测产生影响。此外,由于微流控电化学池整体将于1×105 Pa的高真空环境下使用,ToF-SIMS分析区域内的盐溶液可能结晶析出,覆盖分析区域,干扰ToF-SIMS检测,故需综合考虑电活性物质在微流控电化学池中的电化学行为及实际检测过程中辅酶Q0的信号强度。本研究拟降低支持电解质浓度,以减弱这些因素对液体电化学-ToF-SIMS检测的影响。
采用1 mmol/L KNO3溶液作为支持电解质进行研究,在100 mV/s的扫描速率条件下,比较了2 mm金盘电极及在微流控电化学池中1 mmol/L CoQ0的循环伏安响应曲线(图2)。由图2A可知,使用金盘电极为工作电极,以饱和甘汞电极为参比电极时,在低电解质浓度情况下,CoQ0有一对对称的氧化还原峰,对应CoQ0在金电极表面的一步两电子转移过程。由于支持电解质浓度较低,其峰电位为0.14 V (Ia1)和0.42 V (Ic1),峰电位差值为280 mV。其氧化峰和还原峰电流比值为1.0,表明一步两电子转移为可逆反应。而在所用微流控电化学池中,由于其金电极面积相对较小,所得循环伏安曲线电流响应较低(图2B),其氧化还原峰电位为0.34 V (Ia2)和0.55 V (Ic2),峰电位差值为0.21 V。与图2A相比,其峰电位存在位移,这是由于所使用参比电极为铂。此外,由于所构建微流控电化学池为一薄层池结构,电解质的扩散受到限制,使其峰电位差值相对降低。氧化峰和还原峰电流比值为0.8,接近1。此结果与CoQ0在大电极体系下的循环伏安特性相近,说明在所构建微流控电化学池中,使用1 mmol/L KNO3作为支持电解质即可获得较好的循环伏安曲线,故无需进一步提高支持电解质浓度,说明所构建微流控电化学池可用于电化学检测。
3.2 液体ToF-SIMS原位检测性能
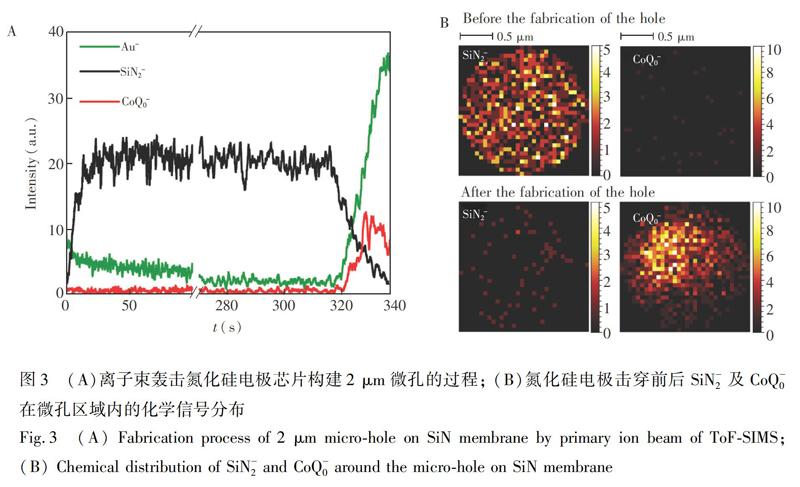
鉴于ToF-SIMS可获得检测过程中二次离子碎片强度随时间的变化情况,并可提供二次离子碎片在分析区域内的化学分布情况。本研究观察了在高真空(压力小于105 Pa)环境下,离子束轰击氮化硅电极芯片构建2 μm微孔的过程及微孔形成前后CoQ0和SiN2在微孔附近的化学成像分布图,以确定此电化学池用于ToF-SIMS检测的可行性。如图3A所示,随着离子束的持续轰击,于320 s左右可明显观察到SiN2信号强度的下降,而Au和CoQ0的信号则同时开始上升。SiN2信号来源于氮化硅膜,而Au和CoQ0则分别来自氮化硅膜上的金电极及金电极下的电解质溶液。故此变化表明氮化硅电极芯片被击穿形成微孔,以及孔中存在电解质溶液。在微孔击穿前后,ToF-SIMS真空腔内压力变化小于106 Pa,说明微流控电化学池表面微孔的构建对ToF-SIMS真空度未产生明显影响,即表明孔中液体相对稳定,不存在快速漏液情况。
氮化硅芯片表面微孔构建过程中,CoQ0和SiN2在微孔内的化学成像分布如图3B所示,在微孔构建前,SiN2的信号分布于整个分析区域内,且几乎没有CoQ0的信号。待微孔形成后,分析区域内SiN2的整体信号强度明显降低,呈零星分布;而CoQ0的信号此时开始出现,且分布较为集中,整体呈圆形分布,其面积略小于ToF-SIMS分析区域。此结果表明,通过ToF-SIMS离子束轰击可于氮化硅电极芯片表面构建微孔用于液体样品在高真空环境下的分析。
3.3 液体电化学ToF-SIMS联用
为考察此微流控电化学池用于液体电化学-ToF-SIMS联用性能,检测了对微流控电化学池施加不同电压后,CoQ0及相关还原产物的二次离子信号强度随电压的改变情况。在不同电压条件下,微流控电化学池中电解质溶液的质谱图见图4。
由图4A可知,在开路电压下在,CoQ0相对分子质量(182.1733 g/mol)处可观察到CoQ0的分子离子峰CoQ0。与之相邻的较为明显的质谱信号为Au,来源于氮化硅电极芯片表面的金电极。对此电化学池施加0.7 V(vs. Pt)电压(图4B),电化学池中的CoQ0将发生还原反应,生成其还原产物。在对应的质谱图中可观察到,施加电位后,m/z 183和m/z 184处的二次离子信号明显上升。鉴于该电势条件下微流控电化学池中CoQ0的循环伏安特性,m/z 184处的二次离子信号应为CoQ0H2-,即对应为还原产物CoQ0H2的分子离子峰,而m/z 183处的信号则可能对应于CoQ0电化学反应过程中产生的中间体CoQ0H。
由图4B可知,在0.1 V(vs. Pt)电压下还原反应产生的CoQ0H2将被重新氧化成CoQ0。为进一步证明验证CoQ0H2及CoQ0H的存在是由CoQ0的还原形成的,而非质谱检测过程中CoQ0相关的加氢峰,在微流控电化学池上施加0.7 V(vs. Pt)电压后,继续施加0.1 V(vs. Pt)电压,观察相关物种的信号强度变化情况。如图4C所示,施加0.1 V(vs. Pt)电压后,其对应质谱图中,CoQ0信号强度明显上升,而m/z=183和m/z 184处的信号则明显下降。此结果与CoQ0的氧化还原反应相一致,表明m/z 183和m/z 184处的信号的确对应于微流控电化学池中CoQ0的氧化还原过程中产生的CoQ0H2及CoQ0H。上述结果表明,通过微流控电化学池与ToF-SIMS检测联用,可成功检测液体电化学反应进程中电极界面的物质转过过程,实现电化学氧化还原过程中电极-电解质界面的原位实时监测。
4 结 论
基于氮化硅电极制作了具有高真空相容性的微流控电化学反应池,构建了液体电化学-ToF-SIMS联用系统。 以CoQ0在金电极表面的氧化还原过程为模型,观测不同电压下,金电极表面CoQ0及其还原产物随电压的变化情况。本方法实现了高真空环境下液体电化学检测与ToF-SIMS技术的联用,针对电极-电解质界面进行原位实时监测,可提供电极界面氧化还原过程的直接分子证据,为电化学反应机理的研究提供了分子水平的信息。
References
1 Fang Y H,Wei G F,Liu Z P. Catal. Today,2013,202: 98-104
2 Wallace G G,Higgins M J,Moulton S E,Wang C. Nanoscale,2012,4(15): 4327-4347
3 Gauthier M,Carney T J,Grimaud A,Giordano L,Pour N,Chang H H,Fenning D P,Lux S F,Paschos O,Bauer C,Magia F,Lupart S,Lamp P,Shao-Horn Y. J. Phys. Chem. Lett.,2015,6(22): 4653-4672
4 Edstrm K,Gustafsson T,Thomas J O. Electrochim. Acta,2004,50(2-3): 397-403
5 Zeng Z,Liang W I,Liao H G,Xin H L,Chu Y H,Zheng H. Nano Lett.,2014,14(4): 1745-1750
6 Ostrovskii D,Ronci F,Scrosati B,Jacobsson P. J. Power Sources,2001,94(2): 183-188
7 Malmgren S,Ciosek K,Hahlin M,Gustafsson T,Gorgoi M,Rensmo H,Edstrom K. Electrochim. Acta,2013,97: 23-32
8 Takamatsu D,Koyama Y,Orikasa Y,Mori S,Nakatsutsumi T,Hirano T,Tanida H,Arai H,Uchimoto Y,Ogumi Z. Angew. Chem. Int. Ed.,2012,51(46): 11597-11601
9 Stepniak I,Ciszewski A. Electrochim. Acta,2011,56(5): 2477-2482
10 Lu J,Hua X,Long Y T. Analyst,2017,142(5): 691-699
11 Xu D,Hua X,Liu S C,Qiao H W,Yang H G,Long Y T,Tian H. Chem. Commun.,2018,54(43): 5434-5437
12 Xu D,Hua X,Xu L,Wu W J,Long Y T,Tian H. ACS Appl. Energy Mater.,2019,2(4): 2387-2391
13 Li H W,Hua X,Long Y T. Anal. Bioanal. Chem.,2019,411(18),5025-4030
14 LI Hao-Wen,HUA Xin,LONG Yi-Tao. Chinese J. Anal. Chem.,2018,46(1): 61-66
李好問,华 鑫,龙亿涛. 分析化学,2018,46(1): 61-66
15 Szynkowska M I,Czerski K,Rogowski J,Paryjczak T,Parczewski A. Surf. Interface Anal.,2010,42(5): 393-397
16 Senoner M,Unger W E S. J. Anal. At. Spectrom.,2012,27(7): 1050-1068
17 LIU Ying-Ya,YING Yi-Lun,HUA Xin,LONG Yi-Tao. Sci. China Chem.,2018,61(2): 159-163
刘迎亚,应佚伦,华 鑫,龙亿涛. 中国科学: 化学,2018,61(2): 159-163
18 Beyer R E. J. Bioenerg. Biomembr.,1994,26(4): 349-358
19 Wang J G,Hua X,Xia H L,Long Y T. Anal. Chem.,2019,91(5): 3195-3198
