温室条件下AM真菌和禾草内生真菌对根腐离蠕孢侵染黑麦草的影响
2019-12-20邓杰李芳段廷玉
邓杰,李芳,段廷玉
(兰州大学草地农业生态系统国家重点实验室,兰州大学农业农村部草牧业创新重点实验室,兰州大学草地农业教育部工程研究中心,兰州大学草地农业科技学院,甘肃 兰州 730020)
多年生黑麦草(Loliumperenne)原产于西欧、北非和西南亚等地,广泛分布于世界各地的温带地区[1]。它是黑麦草属中培育最早且应用最广泛的品种之一,也是新西兰、欧洲、澳大利亚等地的优良草种[2],更是我国草地畜牧业生产和草坪绿地建植的主要草种之一。具有种子活力高,易建植;生长周期长,养分利用率高;适口性和质量好,产量高,再生能力强,耐践踏[1,3]的特点。
真菌病害是限制黑麦草生产与利用的主要限制因素之一。有的真菌病害会造成毁灭性的危害,如腐霉病(Pythiumspp.)能在一夜之间毁灭一片剪股颖(Agrostisstolonifera)草坪[4]。此外,病原菌能降低植物产量,改变植被组成[5],一些病原菌侵染植物后产生有毒物质导致家畜中毒,给畜牧业的发展造成重大经济损失。仅中国国内就发现了14属24种真菌能引起黑麦草病害。如锈病[6]、褐斑病和腐霉枯萎病[7]、黑斑病和叶斑病[8]等。作为重要的牧草和草坪草,黑麦草在生产和利用过程中对腐霉枯萎病、立枯病、锈病、褐斑病、红线病以及叶斑病[9-10]等诸多病害较为敏感。其中,由根腐离蠕孢(Bipolarissorokinianum)引起的叶斑病是危害较大的一种真菌病害之一。离蠕孢叶斑病在牧草叶片上形成灰色至褐色的梭形病斑,该病害可导致黑麦草的胚芽和根基部腐烂、幼苗枯萎和猝倒等[8,11]。
微生物与植物经过长期的协同进化,形成了共生、共栖和寄生等多种复杂关系。丛枝菌根(arbuscular mycorrhizal,AM)真菌和禾草内生真菌是农业生态系统中的重要微生物成员,积极利用微生物手段防治病害是经济且有效的措施[12]。禾草内生真菌是指在禾草中度过全部或大部分生命周期,而禾草不显示外部症状的一大类真菌,如Epichlo⊇属[13],禾草-内生真菌共生体是自然界中较为常见的一种共生体类型。全世界已发现43种、我国已报道7种Epichlo⊇内生真菌[14-15]。在长期演化过程中,内生真菌与寄主植物之间形成互惠共生的关系:寄主植物能为内生真菌的生存提供“住所”和营养物质[16-17],反过来内生真菌产生的代谢物又可以影响宿主植物的生长和发育[18],并促进养分、水分的吸收[19-20],从而提高寄主植物对干旱等非生物逆境和病虫等生物胁迫的抵抗能力[21-24]。
丛枝菌根真菌属于球囊菌门(Glomeromycota)、球囊菌纲(Glomeromycetes),可与约80%植物根系形成菌根共生体[25]。迄今为止,我国发现并报道的AM真菌有147个种,约占全世界已报道的AM真菌种数的1/2[26]。AM真菌能通过根外菌丝在土壤与宿主植物之间进行离子交换,从而减少土壤侵蚀,维持生态系统的稳定[27]。此外,AM真菌与土壤根际微生物之间能形成菌根根圈效应,能拓展根系的吸收面积,从而增加宿主植物对矿质养分和水分的吸收[28],并增加植物体内激素的合成,使植物体内光合产物重新分布,提高植物在逆境条件下的耐受性[29]。
本研究在根部和叶片对黑麦草接种根腐离蠕孢,探究禾草内生真菌和AM真菌与病原菌互作中,黑麦草的生长、光合速率、P吸收以及丙二醛(malondialdehyde,MDA)浓度和酶活性的变化,以期为利用AM真菌和禾草内生真菌防治植物病害,提高和维持农业生态系统生产力和可持续发展提供理论依据。
1 材料与方法
1.1 材料
供试植物为多年生黑麦草“球道”品种。带有禾草内生真菌(E+)和不带禾草内生真菌(E-)的黑麦草种子分别收集于以前研究的E+和E-植物。挑选大小一致且籽粒饱满的黑麦草种子,先用75%的酒精消毒3 min,再用3%的次氯酸钠对种子进行表面消毒10 min,用蒸馏水先冲洗3次后,摆放在有湿润滤纸的培养皿中于25 ℃恒温培养箱黑暗催芽24 h。
供试AM真菌菌剂:根内球囊霉(Rhizophagusintraradices)购买于北京市农林科学院植物营养与资源研究所,以三叶草(Trifoliumrepens)为宿主进行扩繁,扩繁所得的孢子、培养基质以及植物根段混合物作为本试验的接种物。
本试验所用病原菌为根腐离蠕孢,由田间黑麦草病株分离所得。将发病叶片分别用75%酒精和1%次氯酸钠表面消毒,并用无菌水冲洗3~4次后,用灭菌滤纸吸干叶片表面的水分。将叶片切成约0.2 cm的小块后,放在马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基上,25 ℃条件下生长4 d后纯化目标病原菌,并通过形态学、分子生物学和科赫法则鉴定和验证。病原菌纯化培养4周后,在培养病原菌的培养皿中注入10 mL灭菌水,用载玻片刮下培养基表面上的孢子和菌丝,并用纱布过滤后,将所有病原菌孢子收集到灭菌容器中,充分分散后配成孢子悬浮液,用血球计数板计数,孢子浓度大约106个·mL-1。
供试土壤购于兰州花市,黑壤土,土壤过2 mm筛后,与河沙按1∶1充分混合,于121 ℃高压灭菌两次,每次灭菌1 h,间隔24 h。混合基质pH=5.85,速效P含量为19.17 mg·kg-1。
1.2 试验设计
试验于2015年5-8月在兰州大学榆中校区智能温室进行。试验处理包括2个禾草内生真菌处理、2个AM真菌处理和3个病原菌处理组合,分别为侵染禾草内生真菌(E+)和未侵染禾草内生真菌(E-),接种根内球囊霉(AM)和不接根内球囊霉(NM),并在上述处理下植物根部(B+根)、叶片(B+叶)分别接种根腐离蠕孢及不接种病原菌(B-),以NME-B-为试验对照,共12个处理,每个处理4个重复,共48盆。
生长条件:试验期间,温室温度保持在23~28 ℃ (白天)和 20~25 ℃(夜晚),湿度保持在65%~90%,自然光照,每天光照时长约为15 h。48盆黑麦草在温室随机摆放,隔天随机调换花盆位置,以尽量减少外界因素干扰。
接种方法:首先建立AM真菌处理,包括:1)接种AM真菌处理(AM);2)不接种AM真菌的对照(NM)。接种物含有真菌孢子、菌丝、侵染根段等繁殖体及混合基质。接种处理每盆加入30 g根内球囊霉菌剂,不接种处理每盆加30 g灭菌AM真菌菌剂。将经过催芽的E+,E-种子分别移栽至上述AM真菌处理土壤中,生长2周后,用Florea等[30]的方法检测黑麦草叶鞘中内生真菌菌丝,并保留生长较为一致的3棵植株继续生长,建立NME+、NME-、AME+和AME-处理。植株在温室生长6周后,在上述各处理中接种根腐离蠕孢。根腐离蠕孢按不同方式接种,包括:1)叶部喷雾法接种(B+叶);2)根部灌根法接种(B+根),每盆接种10 mL 孢子悬浮液;3)不接种病原菌(B-)处理以叶部喷雾法接种10 mL蒸馏水作为对照。将各处理的黑麦草用黑色塑料袋保湿24 h。2周后测定发病率、光合速率并收获,收获后测定菌根侵染率、P吸收,生物量及生理生化指标。
1.3 测定指标及方法
1.3.1黑麦草发病率 叶部和根部接病的植株发病率都是以植株叶片是否出现病斑的标准来进行统计的,发病植株的叶片早期出现退绿斑,斑点周围有一定程度的黄化,斑点逐步扩大,后期病部黄化枯死,发病严重的植株几乎遍布整个叶片。统计时以叶片出现斑点,无论斑点大小、多少均记为发病。
发病率:每盆随机取25个叶片,统计发病的叶片数,每盆发病率=发病叶片数/25×100%。每个处理的发病率为4个重复的平均值。
1.3.2AM真菌侵染率 染色镜检法测定菌根侵染率。取0.2 g左右冲洗干净的黑麦草根系,装入15 mL离心管,倒入10 mL 10%的KOH溶液浸泡植物根系。在60 ℃水浴锅中水浴60 min左右,观察根系表皮颜色是否已消除。如颜色已去除,则将去色的根系在1 mol·L-1的HCl中浸泡10 s左右,然后用蒸馏水冲洗3次,再装入原离心管。在各处理好的离心管中加入10 mL 0.05% Trypan-Blue染色[31],在60 ℃水浴锅中保持5~10 min,倒出染色剂后加入固定液(乳酸∶甘油:水=1∶1∶1)保存,用“十字交叉法”测定各处理盆的菌根侵染率[32]。
1.3.3净光合速率的测定 收获前,选择天气晴朗的上午9:00-11:00,于普通空气条件下用Li-6400便携式光合仪测定叶片的净光合速率(net photosynthetic rate,Pn,μmol·m-2·s-1)和气孔导度(stomatal conductance,Gs,μmol·m-2·s-1),从每盆植株中随机选一株植物,并选取该株植物新分蘖叶附近的叶片来测定,每隔15 s计1个值,每盆共计录5个值,每个处理测4盆,然后计算平均值。
1.3.4总生物量测定 齐地面剪下地上部分,每个处理剪4盆,每盆剪3株植物,每盆中的植物总量作为一个重复,每个处理计4个重复,每个处理将植株地上部分和根部均先称取鲜重后,在105 ℃杀青20 min,然后于80 ℃烘箱烘至恒重。总生物量=地上部分干重+根部干重。
1.3.5总P含量测定 将烘干的植物地上部分和根部样品研磨后,分别称取0.2 g于100 mL消化管中,每管加 3 g K2SO4和0.3 g CuSO4催化剂,并加10 mL H2SO4,于420 ℃消煮2 h。消化好的溶液定容至100 mL。采用钼锑抗吸光光度法,建立标准曲线,用分光光度计(Pectrum, Shanghai 721,中国),于390 nm处测定吸光度值[33]。每盆植株总P含量=地上P含量+根P含量。
1.3.6生理生化指标的测定 采集接种病原菌植株的发病叶片(若接病后没发病,则采集与发病植株所采集的相同部位的叶片)和未接种病原菌植株的相同部位的健康叶片测定生理生化指标。植株的叶绿素含量、超氧化物歧化酶(superoxide dismutase, SOD)活性和MDA浓度分别参照王学奎[34]的丙酮浸提法、氮蓝四唑法和硫代巴比妥酸法测定。H2O2含量参照Velikova等[35]的分光光度计比色法测定。
1.4 数据统计与分析
采用Microsoft Excel 2007进行数据的整理、计算和作图。用SPSS 19.0统计软件对微生物间的互作关系进行三因素方差分析。分析过程中首先对数据进行Levenes方差齐性检验,若方差齐性(P>0.05),则可进一步分析。用Tukey’s HSD法(Tukey’s honestly significant difference)检测各处理间的显著性差异。
2 结果与分析
2.1 AM真菌、禾草内生真菌及病原菌互作对黑麦草的影响
病原菌、AM真菌和禾草内生真菌,以及病原菌和禾草内生真菌互作均可显著影响黑麦草的菌根侵染率、叶绿素含量、净光合速率、气孔导度、总P含量、总生物量、MDA浓度、H2O2浓度和SOD活性;病原菌和AM真菌互作对黑麦草叶绿素含量无显著影响,但显著影响其余所有指标;AM真菌和禾草内生真菌互作显著影响黑麦草发病率、菌根侵染率、总P含量、MDA浓度、H2O2浓度和SOD活性;病原菌、AM真菌和禾草内生真菌互作显著影响黑麦草发病率、菌根侵染率、净光合速率、总P含量、MDA浓度、H2O2浓度和SOD活性(表1)。AM真菌、禾草内生真菌和病原菌之间互作对黑麦草发病率和菌根侵染率有显著交互作用(表1)。
2.2 黑麦草发病率和菌根侵染率
未接种病原菌的黑麦草叶片未出现病斑,叶部接种病原菌处理下,NME-、NME+、AME-和AME+处理下的黑麦草叶片发病率分别为31.25%、21.25%、3.37%和2.50%,与NME-对照相比,侵染禾草内生真菌和接种AM真菌的处理均一定程度地降低了黑麦草发病率,降幅为32.00%~92.00%。根部接种病原菌条件下,NME-和NME+处理下的黑麦草发病率分别为22.50%和18.75%,AME-和AME+处理下的黑麦草未发病(图1a)。
未接种AM真菌的处理,黑麦草根系未检测到菌根结构。接种AM真菌的处理,黑麦草根系均不同程度地受到侵染,侵染率为16.18%~31.24%。未接种和根部接种病原菌处理下,与E-植株相比,E+植株的菌根侵染率分别降低24.37%和48.21%(P<0.05)。叶部接种病原菌处理下,与E-植株相比,E+植株虽降低黑麦草根系菌根侵染率,但差异不显著(P>0.05)。与B-处理相比,不管是否侵染禾草内生真菌,叶部接种病原菌均显著降低了黑麦草根系菌根侵染率,降幅分别为30.42%和33.83%(P<0.05),而根部接种病原菌的黑麦草,仅E+植株根系的菌根侵染率显著降低31.49%(P<0.05,图1b)。

表1 3种微生物及其相互作用的方差分析
注:B×M:病原菌与AM真菌的交互作用;B×E:病原菌与禾草内生真菌的交互作用;M×E:AM真菌与禾草内生真菌的交互作用;B×M×E:病原菌、AM真菌和禾草内生真菌三者间的交互作用;NS表示经Tukey’s HSD法检验在P<0.05水平差异不显著。
Note: B×M means interaction betweenB.sorokinianaand arbuscular mycorrhizal;B×E means interaction betweenB.sorokinianaand grass endophyte;M×E means interaction between arbuscular mycorrhizal and grass endophyte;B×M×E means interaction amongB.sorokiniana, arbuscular mycorrhizal and grass endophyte;NS indicate there is not significant difference atP<0.05 level by Tukey’s HSD test.
2.3 不同接病处理下黑麦草叶绿素含量和光合指标
与未接种病原菌的处理相比,叶部接种病原菌显著降低了NME-、NME+、AME-和AME+各处理下黑麦草的气孔导度和叶绿素含量,降幅为10.63%~14.55%和28.95%~59.16%(P<0.05,图2b,c)。同时,叶部接种病原菌显著降低了NME-、AME-和AME+各处理下黑麦草的净光合速率,降幅为33.02%~57.86%(P<0.05,图2a);根部接种病原菌显著降低了NME-处理下黑麦草的净光合速率和AME-处理下黑麦草的气孔导度。叶片和根部接病处理下,与NME-对照相比,AM真菌和禾草内生真菌均能提高黑麦草净光合速率和叶绿素含量(图2a,c),二者共同作用时(AME+),显著提高黑麦草叶片净光合速率、气孔导度和叶绿素含量,增幅为132.25%和132.17%、56.00%和134.48%、37.69%和40.77%(P<0.05,图2a~c)。

图1 不同接病处理下黑麦草发病率和菌根侵染率
2.4 不同接病处理下黑麦草总P含量

图2 不同接病处理下黑麦草净光合速率、气孔导度和叶绿素含量
与未接种病原菌的处理相比,叶部接种病原菌显著降低了NME-、AME-和AME+各处理下黑麦草总P含量,降幅为12.61%~35.06%(P<0.05);根部接种病原菌仅显著降低了AME+处理下黑麦草的总P含量(P<0.05)。叶片接病处理下,与NME-对照相比,AM真菌和禾草内生真菌单独或同时存在均能显著提高黑麦草总P含量,增幅分别为38.27%、37.75%和41.51%(P<0.05)。根部接病处理下,与NME-对照相比,仅AM真菌和禾草内生真菌同时存在时显著提高黑麦草总P含量38.17%(P<0.05,图3)。
2.5 不同接病处理下黑麦草总生物量
与未接种病原菌的处理相比,叶部接种病原菌显著降低了NME+和AME+处理下黑麦草总生物量,降幅分别为13.48%和20.63%(P<0.05);根部接种病原菌显著降低NME+处理下黑麦草的总生物量12.13%(P<0.05)。叶片接病处理下,与NME-对照相比,AM真菌和禾草内生真菌单独或同时存在均未显著提高黑麦草总生物量(P>0.05)。根部接病处理下,与NME-相比,接种AM真菌显著提高了黑麦草总生物量,增幅为14.88%和32.72%(P<0.05,图4)。
2.6 不同接病处理下黑麦草黑麦草MDA和H2O2浓度
与未接种病原菌的处理相比,叶部接种病原菌显著提高了NME-、NME+、AME-和AME+各处理下黑麦草的丙二醛浓度以及NME-和AME-处理下黑麦草的H2O2浓度;根部接种病原菌显著提高了NME-、NME+、AME-和AME+各处理下黑麦草的丙二醛和H2O2浓度。叶片接病处理下,与NME-对照相比,AM真菌和禾草内生真菌单独或同时存在均显著降低了黑麦草的丙二醛和H2O2浓度,降幅为21.60%~31.36%和24.14%~58.62%(P<0.05,图5a, b)。根部接病处理下,AM真菌和禾草内生真菌单独或同时存在均显著降低了黑麦草的H2O2浓度,降幅为14.82%~22.22%(P<0.05,图5b),同时,AM真菌和禾草内生真菌共同作用时显著降低了根部接种病原菌处理下黑麦草的丙二醛浓度24.45%(P<0.05,图5a, b)。

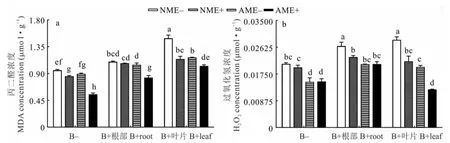
图5 不同接病处理下黑麦草MDA和H2O2浓度
2.7 不同接病处理下黑麦草SOD活性
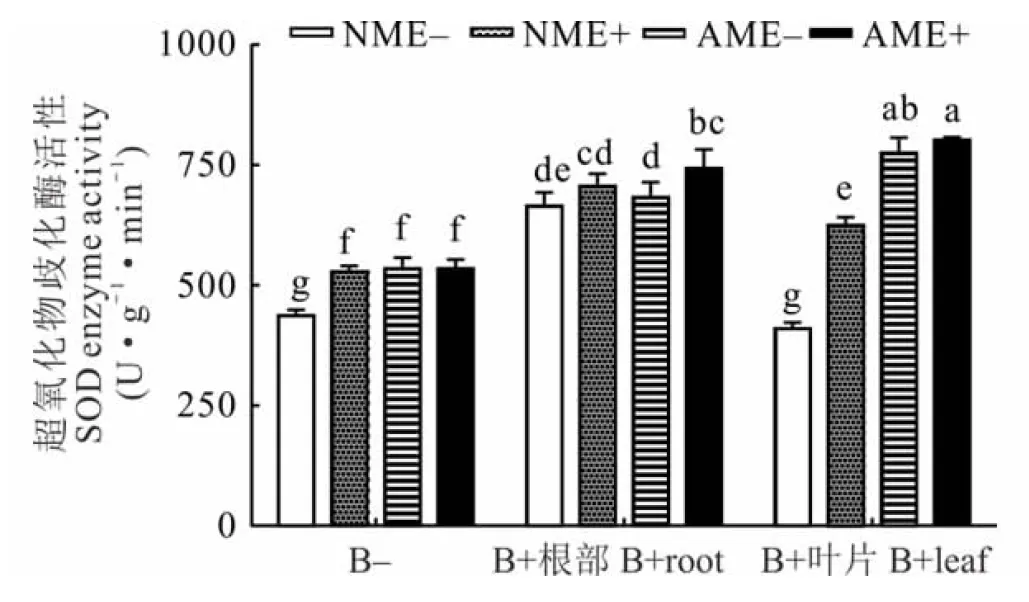
图6 不同接病处理下黑麦草SOD活性
与未接种病原菌的处理相比,叶部和根部接种病原菌显著提高了NME+、AME-和AME+各处理下黑麦草的SOD活性。叶片接病处理下,与NME-对照相比,AM真菌和禾草内生真菌单独或同时存在均显著提高了黑麦草的SOD活性,增幅为52.40%~95.65%(P<0.05)。根部接病处理下,AM真菌和禾草内生真菌共同作用时显著提高了黑麦草的SOD活性11.72%(P<0.05,图6)。
2.8 AM真菌、禾草内生真菌和病原菌互作的相关性分析
相关分析结果显示,黑麦草的发病率与菌根侵染率、叶绿素含量、光合指标以及P吸收和生物量有显著负相关关系,但与MDA和H2O2浓度呈显著正相关关系。黑麦草根系菌根侵染率与叶绿素含量、光合指标、P吸收和生物量有显著正相关关系,与黑麦草发病率、MDA和H2O2浓度呈显著负相关关系。黑麦草生物量的积累与叶绿素含量、光合指标、P吸收以及根系菌根侵染率等有显著正相关关系,并且与黑麦草发病率、MDA和H2O2浓度呈显著负相关关系(表2)。

表2 AM真菌、禾草内生真菌和病原菌互作的相关性分析
*:P<0.05;**:P<0.01.
3 讨论与结论
病原菌侵染会显著降低净光合速率、叶绿素含量以及P吸收,最终导致植物生长减弱,生物量的积累减少[36-38]。本研究结果表明,根部和叶片接种病原菌均能在一定程度上降低黑麦草的光合速率和P吸收,最终导致生物量减少。这与叶绿素含量、光合速率与P吸收和黑麦草发病率有显著负相关关系,而与黑麦草生物量有显著正相关关系有关。低的光合速率通常意味着植物生长缓慢[39],最终导致产量减少[40]。
本试验探究了AM真菌和禾草内生真菌互作对根部和叶片接种病原菌的黑麦草生长、P吸收、光合速率及丙二醛浓度和SOD活性的影响。结果表明:接种病原菌,尤其是叶片接种病原菌,显著降低了黑麦草生长、P吸收、光合速率,增加了MDA浓度。接种AM真菌和侵染禾草内生真菌均能在一定程度上促进黑麦草生长,促进P吸收和光合作用的进行,从而降低黑麦草的发病率和MDA浓度,缓解病害对黑麦草植株造成的伤害。
禾草内生真菌能显著提高白粉病侵染病株的叶绿素含量、净光合速率和胞间二氧化碳浓度,促进植物生长[37];此外,番茄(Lycopersiconesculentum)根系接种摩西球囊霉(Glomusmosseae)能显著提高感染番茄灰霉病植株的总叶绿素含量和净光合速率[41]。本研究也发现AM真菌和禾草内生真菌均可在一定程度上促进光合作用的进行和P吸收,从而提高生物量的积累。且二者共存时,促进效应最好。这说明AM真菌和禾草内生真菌均能促进光合作用的进行和P的吸收,促进植物生长,提高植物对病害的抗性,这可能是因为禾草内生真菌和AM真菌均可在逆境条件下降低植物体内活性氧的积累和膜质过氧化产物的积累[6,42],本研究结果显示禾草内生真菌和AM真菌的存在均可降低MDA和H2O2浓度,增加SOD活性,且二者同时存在时,MDA和H2O2浓度最低,SOD活性最高。这跟发病率与MDA和H2O2浓度呈显著正相关,而菌根侵染率与MDA和H2O2浓度呈显著负相关关系以及与SOD活性呈显著正相关关系有关。说明病原真菌入侵时,AM真菌和禾草内生真菌能在一定程度上提高抗氧化保护酶活性,降低膜质过氧化作用,从而缓解病害对植物造成的伤害。且在植物遭遇逆境时,两种微生物间存在协同作用。
另外,在本试验中发现,AM真菌的侵染率会因禾草内生真菌以及病原菌的存在而降低,Zambolim 等[43]发现侵染壳球孢菌,立枯丝核菌和腐皮镰刀菌后,大豆根系摩西球囊霉的侵染率降低38%,Liu等[44]发现,内生真菌的侵染降低了黑麦草根系菌根侵染率,并且在高磷水平下,禾草内生真菌的存在可显著抑制丛枝菌根真菌的侵染[45-46]。这可能是因为AM真菌的侵染是一个动态过程,伴随着植物的生长而不断发生,当接种病原菌之后,病原菌与AM真菌在寄主体内存在位点竞争或对抗作用[47-48],从而相互抑制,此外,病原菌侵染降低了植物的光合速率和叶绿素含量,禾草内生真菌的存在减少了光合产物向根部的运输,减少了AM真菌自身所需要的养分分配,从而降低了AM真菌的侵染率。AM真菌在与病原菌争夺资源与位点的过程中侵染率虽然有一定程度的降低,但也很大程度上减少了病原菌可利用的资源与空间,从而抑制了病原菌的侵染与繁殖,体现出AM真菌对提高植物抗病性的作用。另外,禾草内生真菌的存在只是降低了AM真菌的侵染率,植物根部依然存在AM真菌的侵染,因此不影响AM真菌提高植物抗病性的作用,也同样不影响二者的协同作用。
黑麦草的需求和利用逐年增加,因此,防控病害,提高产量是各国亟待解决的问题。虽然化学杀菌剂可有效防治植物真菌引起的病害,但化学杀菌剂易污染环境,且长期使用化学杀菌剂,易使病原物产生抗药性,因此,积极采用微生物防治手段是最经济有效的措施。大量研究证实,AM真菌和禾草内生真菌能显著促进植物光合速率、P吸收,增加叶绿素含量和生物量,降低MDA和H2O2浓度,能在一定程度上提高植物的养分吸收和碳水化合物的积累,增强植物对病害的抗性。表明AM真菌和禾草内生真菌在多年生黑麦草生产系统中具有广泛的应用前景。
