碳源对杜氏盐藻株生长的影响及其培养基的优化
2019-12-20王玲玲李兆河马贵范王吝安
王玲玲,李兆河,马贵范,王吝安
(1.威海海洋职业学院,威海市微藻种质资源开发工程技术研究中心,山东 荣成 264300;2.山东大学(威海)海洋学院,山东 威海 266071)
杜氏盐藻Dunaliella salina 富含蛋白质、β-胡萝卜素和特殊生物活性物质,在食品、医疗保健、化工和养殖业中具有公认的独特经济价值[1]。笔者由山东荣成桑沟湾分离得到一株具有优良性状的盐藻,用混合营养培养方法研究了碳酸氢钠、葡萄糖、蔗糖和乙酸钠等碳源和浓度对其生长的影响;采用正交设计试验方法优化了其培养基中C、N、P 的浓度水平,为盐藻大规模生产应用提供理论依据。
1 材料与方法
1.1 材料
实验用盐藻分离于山东省荣成桑沟湾自然水域,经分子鉴定为杜氏盐藻。
葡萄糖、蔗糖、乙酸钠、碳酸氢钠、硝酸钠、磷酸二氢钠和硅酸钠等为分析纯试剂。
培养用水为取自山东荣成桑沟湾海区盐度31.5 的自然海水,0.45μm 微孔滤膜抽滤,用氯化钠调整海水盐度至60;培养基采用f/2 培养基[2]。培养基经高压灭菌后冷却曝气,调pH 至8.0;盐藻置于光照培养箱中培养,温度26℃,光暗比12h∶12h,光照强度3 000~4 000Lux,每8h 振荡1 次。
1.2 方法
1.2.1 碳源的筛选
将无机碳源(碳酸氢钠)、有机碳源(葡萄糖、蔗糖和乙酸钠)分别加入f/2 培养基中,每种碳源设4个碳素浓度梯度,分别为0.00 mol·L-1(对照组)、0.05 mol·L-1、0.10 mol·L-1和0.15mol·L-1。实验采用一次性培养方式,在250mL 三角瓶中装入150mL培养液,取对数生长期藻种接种,接种密度为0.61×106ind.·mL-1,培养12d,每24h 定时采样记录盐藻的细胞密度。
1.2.2 盐藻培养基的优化
根据碳源筛选结果和f/2 培养基配方,以葡萄糖、硝酸钠和磷酸二氢钠为碳、氮和磷源,设计三因素三水平L9(34)正交试验[3],优化盐藻培养基中C、N、P 营养盐浓度,各因素水平如表1 所示。培养12d,每24h 定时采样记录盐藻的细胞密度。

表1 三种营养盐因素水平表Tab.1 Levels of three nutrients(g·L-1)
1.3 盐藻细胞密度的测定
用血球计数板计数盐藻的细胞密度,用V-2000 分光光度计测定相应细胞密度下藻液的OD630,每隔24h 测定一次,绘制吸光度与藻细胞浓度的标准曲线,根据标准曲线计算出盐藻细胞密度[4]。
1.4 数据分析
实验重复三次,运用SPSS 软件进行数据分析。选择单因变量多因素方差法分析碳源形式和浓度的主效应和二者的交互效应;对方差分析结果显著的因素,利用最小显著差数法(LSD)进行多重比较[5]。正交试验采用直观分析和单因变量多因素方差法分析C、N、P 的主效应。差异显著性水平为P<0.050。
2 结果和分析
2.1 不同碳源对盐藻生长的影响
如图1~4 所示,培养1~3d 为延缓期,第4d 进入指数生长期,第10~12d 细胞密度最高。如图1 所示,第12d 空白对照组盐藻细胞密度为(5.40±0.42)×106ind.·mL-1,葡萄糖组0.05mol·L-1、0.10mol·L-1和0.15mol·L-1浓度下盐藻细胞的密度高于空白对照组,且0.10mol·L-1浓度下细胞密度为(12.56±0.44)×106mL-1,较0.05mol·L-1和0.15 mol·L-1浓度下细胞密度高;如图2 所示,第12d 蔗糖组0.05mol·L-1、0.10mol·L-1和0.15mol·L-1浓度下盐藻细胞密度高于空白对照组,且0.05mol·L-1浓度下细胞密度为(9.29±0.21)×106ind.·mL-1,较0.10mol·L-1和0.15mol·L-1浓度下细胞密度高;如图3 所示,第12d乙酸钠组0.05mol·L-1、0.10mol·L-1和0.15mol·L-1浓度下盐藻细胞密度低于空白对照组,0.05mol·L-1浓度下细胞密度为(4.89±0.22)×106ind.·mL-1,较0.10mol·L-1和0.15mol·L-1浓度下细胞密度高;如图4 所示,第12d 碳酸氢钠组0.05mol·L-1、0.10mol·L-1和0.15mol·L-1浓度下的盐藻细胞密度高于空白对照组,且0.15 mol·L-1浓度下细胞密度为(8.04±0.22)×106ind.·mL-1,较0.05mol·L-1和0.10mol·L-1浓度下细胞密度高。结果显示,各试验浓度葡萄糖、蔗糖和碳酸钠均可促进盐藻的生长,乙酸钠抑制盐藻的生长。

图1 不同的葡萄糖浓度下盐藻的生长曲线(n=3)Fig.1 The growth curves of green alga Dunaliella salina at different concentrations of glucose C6H12O6
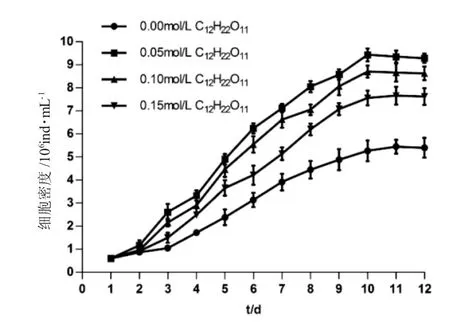
图2 不同的蔗糖浓度下盐藻的生长曲线(n=3)Fig.2 The growth curves of green alga Dunaliella salina at different concentrations of sucrose C12H22O11

图3 不同的乙酸钠浓度下盐藻的生长曲线(n=3)Fig.3 The growth curves of green alga Dunaliella salina with Different concentrations of CH3COONa
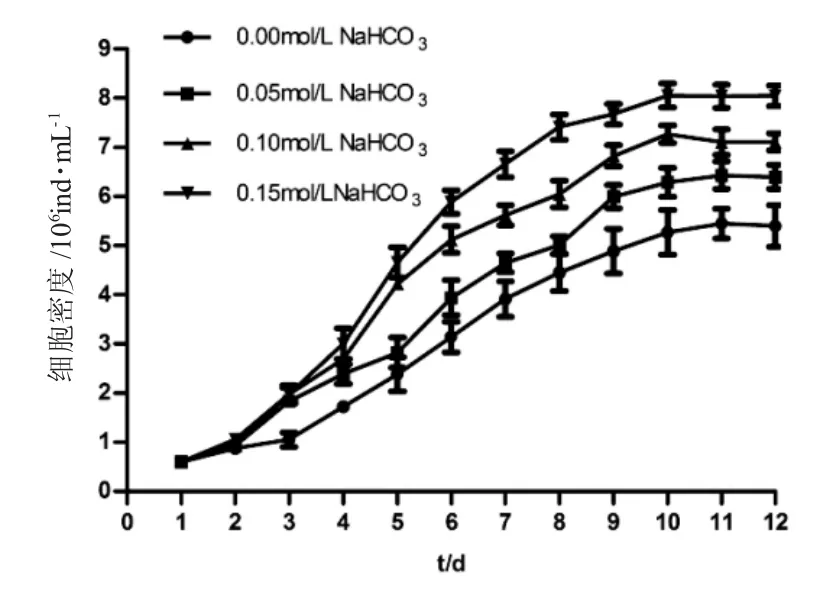
图4 不同的碳酸氢钠浓度下盐藻的生长曲线(n=3)Fig.4 The growth curves of green alga Dunaliella salina at different concentrations of NaHCO3
由图5 可知,第12d,0.05mol·L-1浓度下葡萄糖组与蔗糖组的细胞密度相差不大,且明显高于碳酸钠和乙酸钠组;0.10mol·L-1与0.15mol·L-1浓度下,盐藻的细胞密度由高至低为:葡萄糖组>蔗糖组>碳酸钠组>乙酸钠组。

图5 不同碳源条件下盐藻生长的细胞密度Fig.5 The cell density of green alga Dunaliella salina with different carbon sources
SPSS 的一般线性模型方差分析结果显示:碳源和浓度都对盐藻生长的细胞密度有极显著影响(P=0.000)(表2)。多重比较结果显示,有利于盐藻细胞密度增加的碳源形式表现为:葡萄糖>蔗糖>碳酸钠>乙酸钠,四者之间差异极显著;有利于盐藻细胞密度增加的碳浓度表现为:0.10mol·L-1>0.05 mol·L-1≥0.15mol·L-1>0.00mol·L-1,其中0.05mol·L-1和0.15mol·L-1组别差异不显著(P=0.502)。有利于盐藻细胞密度增加,优选葡萄糖做碳源,适宜浓度为0.10mol·L-1。

表2 碳源形式和浓度对盐藻的细胞密度的主效应和交互效应检验Tab.2 Analysis of main and interaction effects of carbon sources and concentration on final cell density
2.2 盐藻培养基的优化
2.2.1 极差分析
如表3 正交试验分析所示,经12d 培养,各营养盐极差分析结果为:N 源>C 源>P 源,各营养盐对盐藻细胞密度增加的影响由大到小依次为:N源、C 源、P 源;C 源各水平的影响由大到小依次为:K2>K3>K1;N 源各水平的影响由大到小依次为:K3>K2>K1;P 源各水平的影响由大到小依次为:K3>K2>K1。直观分析盐藻优化后的培养基成分为:葡萄糖(C 源)18.00g·L-1、硝酸钠(N 源)0.1000g·L-1和磷酸二氢钠(P 源)0.0075g·L-1。

表3 营养盐对盐藻细胞密度增加的影响正交试验结果分析Tab.3 Result analysis of the orthogonal tests on effects of nutrients on cell density of green alga Dunaliella salina
2.2.2 方差分析
由表4 可知,氮源、碳源对盐藻细胞密度增加的影响显著(P<0.050),磷源的影响不显著(P>0.050)。各营养盐对盐藻细胞密度增加的影响显著性由大到小依次为:氮源、碳源、磷源。方差分析的结果与直观分析的结果一致。
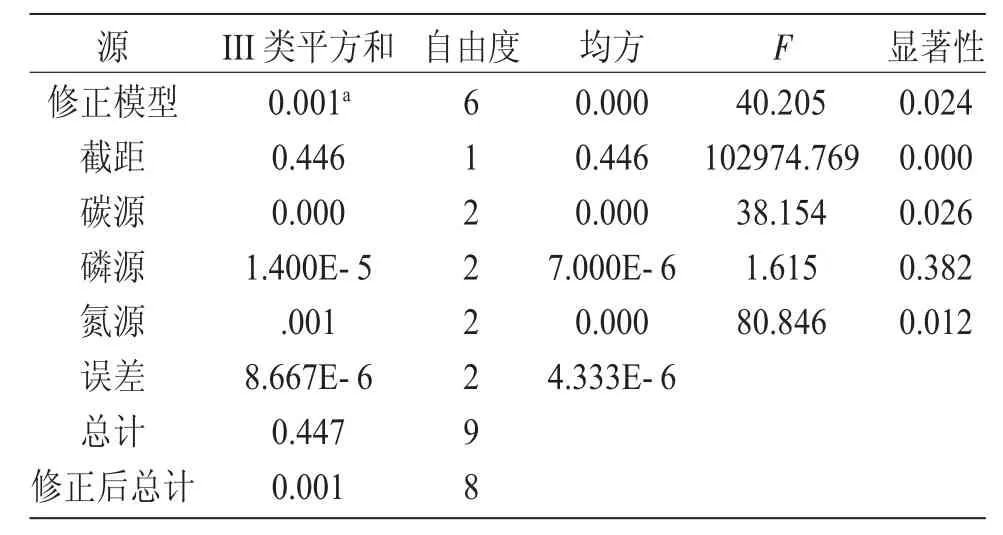
表4 方差分析结果Tab.4 Results of variance analysis
3 讨论
微藻富含脂类、蛋白质和多糖,光合作用效率高、生长周期短、可再生,在食品、医药、保健品及生物能源领域广泛应用[6,7]。人工大规模高效培养是微藻资源开发利用的关键。近年来,随着许多藻类利用碳源的研究不断深化,围绕微藻异养或混养的研究逐渐展开[8]。研究表明:混合营养(Mixo-trophism)(同时进行无机营养光合作用与有机营养的培养方式)可以大规模高密度生产微藻[9]。微藻可以吸收利用水体中的HCO3-[10]。White 等[11]发现,添加1g/L 碳酸氢钠可以提高四爿藻Tetraselmis suecica 和微绿球Nannochloropsis salina 的细胞密度;戴玉蓉和卢敬让[12]在培养液中添加1g/L NaHCO3,明显促进了绿色巴夫藻3012 Pavlova viridis、亚心扁藻Platymonas subcordiformis、海水小球藻Chlorella pacifica、等鞭金藻8701 和等鞭金藻3011 的生长;王星宇等[13]研究发现,培养液中添加碳酸氢钠显著影响球等鞭金藻的生长。
微藻细胞对有机碳化合物及其利用程度也具有偏爱性[14]。Pruvost 等[15]报道,某些微藻具有特殊的运送系统,可主动吸收培养基中的有机化合物,这为微藻异养或混合培养提供了依据。目前蓝藻门、隐藻门、甲藻门、金藻门、黄藻门、硅藻门、裸藻门和绿藻门等8 门60 多属的近百种微藻可以进行异养或混合营养生长[16],其中某些微藻经过优化培养后,生物量或有用生化产物大幅提高。吴庆余等[17]用批式流加葡萄糖培养原始小球藻Eprotothecoides,生物量超过了100g·L-1。降低盐藻培养液中可溶性无机碳源含量,增加葡萄糖混合培养基显著影响杜氏盐藻的生长[18];葡萄糖浓度为30 mmol·L-1时,微绿球藻Nannochloropsis sp 的生长明显增长[19]。田华等[20]研究葡萄糖碳源对螺旋藻Spirulinaplatensis 的混合营养,发现葡萄糖浓度为3.0g·L-1时,干重是对照的1.29 倍。这些异养微藻已用于产业化生产,其应用价值主要表现在作为水产饵料和提取生化产物[21]。
本试验明确了培养液中适合盐藻混合培养的最优碳源为葡萄糖,与孙俊楠等[18]的研究结果相似;优化后的培养基中C、N、P 营养盐浓度为:葡萄糖18.00g·L-1,硝酸钠0.1000g·L-1,磷酸二氢钠0.0075 g·L-1,优化的培养基明显提高了盐藻的生长量,可为盐藻的工业化生产提供理论依据。为扩大应用范围,在本研究的基础上,未来将进一步探讨不同碳源、浓度与盐藻的细胞化学组成的关系及其影响机制等。
