和厚朴酚通过抑制cyclin D1 影响Hep3B 细胞增殖和周期
2019-12-19黄赟李智文黄晅昱刘晨
黄赟 李智文 黄晅昱 刘晨
肝细胞癌(hepatocellular carcinoma, HCC)是具有高侵袭性的恶性肿瘤之一,术后生存率低,复发率高,5年生存率小于20%[1-2]。目前,手术切除、放疗和化疗仍是治疗肝癌的主要方法。然而在过去的十余年中, HCC患者的生存率仍未见有效提高。因此,开发新的治疗肝HCC的有效药物具有十分重要的意义。和厚朴酚(honokiol,HNK)是厚朴的主要活性成分之一,具有多种药理作用,如抗病毒、抗菌、抗炎、抗衰老、抗氧化、免疫调节和神经保护等作用[3-5]。越来越多研究表明,HNK具有广泛的抗肿瘤活性作用[6-8]。然而,关于HNK对HCC的抗肿瘤作用,尤其是涉及体内实验方面的研究还很少。在本研究中,我们通过研究HNK对正常肝细胞和肝癌细胞间毒性的差异,以及探讨HNK对人肝癌细胞株Hep3B在体外和体内的增殖影响,从而明确HNK是否有抗肝细胞癌的作用。进一步的机制研究中,我们试图寻找合适的分子机制来解释上述功能变化。本研究探索了HNK在HCC治疗中可能的作用机制,为HNK进一步应用于肝癌的临床治疗提供了参考。
1 材料与方法
1.1 实验材料和试剂
抗细胞周期蛋白D1(cyclin D1)、p53、p27、p21抗体均购自美国CellSignaling Technology公司。抗甘油醛-3-磷酸脱氢酶(GAPDH)抗体购自美国Proteintech公司。细胞周期检测试剂盒(流式)购自北京碧云天生物技术公司。3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)试剂盒和二甲基亚砜购自美国Sigma公司。草酸铵结晶紫染色液购自北京索莱宝公司。
1.2 细胞培养
永生化人肝细胞LO2和人肝癌Hep3B细胞购自中国科学院上海细胞库。细胞常规培养在37 ℃、5% CO2的恒温培养箱中。当细胞生长至70%左右密度时先更换为无血清培养基,再给予药物处理。
1.3 实验动物及动物模型建立
4 ~ 5周龄的雌性裸鼠(BALB/C-nu/nu;18 ~ 20 g)由上海实验动物中心提供,均饲养在福建医科大学动物实验中心SPF级动物房,实验方案经福建医科大学动物实验伦理委员会批准。Hep3B细胞裸鼠皮下移植瘤模型建立方法如下:将Hep3B细胞调整密度为2.0×106重悬于100 mL无血清DMEM中并接种在裸鼠的左下腹来构建皮下肿瘤模型。注射10天后可观察到肿瘤时,将裸鼠随机分为2组,每组5只,治疗组每日腹腔注射50 mg/kg 和厚朴酚,对照组为相同体积的溶剂腹腔注射,持续3周。3周后处死并收集肿瘤,并在固定前测量肿瘤重量和体积。肿瘤体积计算方法:测量长径a(cm)和短径b(cm),肿瘤体积V (cm3)=a×b2/2。
1.4 细胞存活率及增殖能力检测
采用MTT法测试Hep3B细胞的存活率和增殖情况。将细胞以特定密度(1 500个细胞/孔用于测定增殖活力;5 000个细胞/孔用于测定存活率)植入96孔板中并培养1 ~ 2天。在HNK刺激后,在每个孔中加入20 μL MTT(5 mg / mL)。孵育4小时后,除去含有MTT的培养基,并向每个孔中加入150 μL 二甲基亚砜。在490 nm波长下测量每个孔的光密度值(OD)。每个实验使用10个复孔。
1.5 平板克隆形成实验
细胞以200个/孔的密度种植于6孔培养板上。培养14天后,用PBS洗涤细胞两次,并用2.0%结晶紫(购自中国北京Solarbio公司)染色。使用显微镜对细胞克隆团进行计数,并确保每个细胞团均含有50个以上细胞。
1.6 流式细胞术分析细胞周期
使用细胞周期检测试剂盒进行细胞周期分析。收集培养的细胞,消化后固定于70%冰冷乙醇中,并在4℃下储存过夜。之后通过离心(1 000×g,5分钟)除去乙醇,然后用荧光染料碘化丙啶(PI)和RNase A在37℃、避光条件下染色30分钟。最后使用流式细胞术分析细胞周期。
1.7 Western blot法检测蛋白水平
4℃条件下在细胞中加入蛋白裂解液,30分钟后收集细胞裂解液,超声碎裂细胞,离心(12 000×g,4℃,15分钟)后测定蛋白浓度,剩余样品混合上样缓冲液并置于100℃中变性5分钟。配置10% 的十二烷基硫酸钠-聚丙烯酰胺凝胶进行电泳,分离蛋白后转移PVDF膜上,用相应一抗进行孵育(GAPDH稀释浓度为1:2 000,其余抗体均为1:1 000),TBST洗涤后用相应二抗孵育,化学发光法进行显影并进行灰度测定及统计。
1.8 统计学处理
采用SPSS 22.0统计软件进行统计学分析,所有数据均采用(表示。计量资料比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 HNK对Hep3B及LO2细胞活力的影响
我们将两种细胞置于不同浓度HNK或不同刺激时间下进行培养,并使用MTT测定法观察两种细胞存活率。结果显示,HNK对Hep3B细胞具有显着的细胞毒性,且有明显的时间-浓度依赖性,50%抑制浓度(IC50)为(22.9±3.4)μM(见图1)。然而,在相同浓度或者时间的HNK刺激下,永生化人肝细胞LO2的存活率没有受到显着影响(IC50>40 μM)。该结果表明HNK对HCC细胞具有一定的细胞毒作用。
2.2 HNK在体外实验中对Hep3B细胞增殖能力的影响
MTT实验(见图2A)显示随着HNK刺激浓度的增加,Hep3B细胞增殖曲线逐渐趋于平缓,表明HNK降低了Hep3B细胞的增殖速度具有浓度依赖性。平板克隆形成实验(见图2B)结果显示随着HNK刺激浓度的增加,细胞聚落形成数量成显著下降(0 μM:(54.0±6.8)个;20 μM:(18.0±2.4)个;30 μM :(5.0±1.7)个;0 μM:20 μM,P=0.016;0 μM:30 μM, P=0.009;20 μM:30 μM,P=0.034)。
2.3 HNK对Hep3B细胞周期的影响
与对照组相比,HNK治疗组(30 μM,24 h)中处于G1期细胞数目升高[(51.4±2.21)% vs.(62.2±3.74)%,P=0.023],处于S期细胞数目下降[(32.4±1.81)% vs.(24.2±1.54)%,P=0.026],Hep3B细胞从G1期向S期的细胞周期转化受到抑制(见图3 )。
2.3 HNK在体内实验中对 Hep3B细胞增殖能力的影响
使用H e p 3 B 细胞系和裸鼠构建了皮下成瘤模型。与对照组相比,H N K 治疗组的肿瘤体积[(0.8 6±0.3 2)vs.(0.41±0.14)cm3,P=0.012]和肿瘤重量[(0.85±0.24)vs.(0.43±0.16)g,P=0.007]均低于对照组(见图4)。
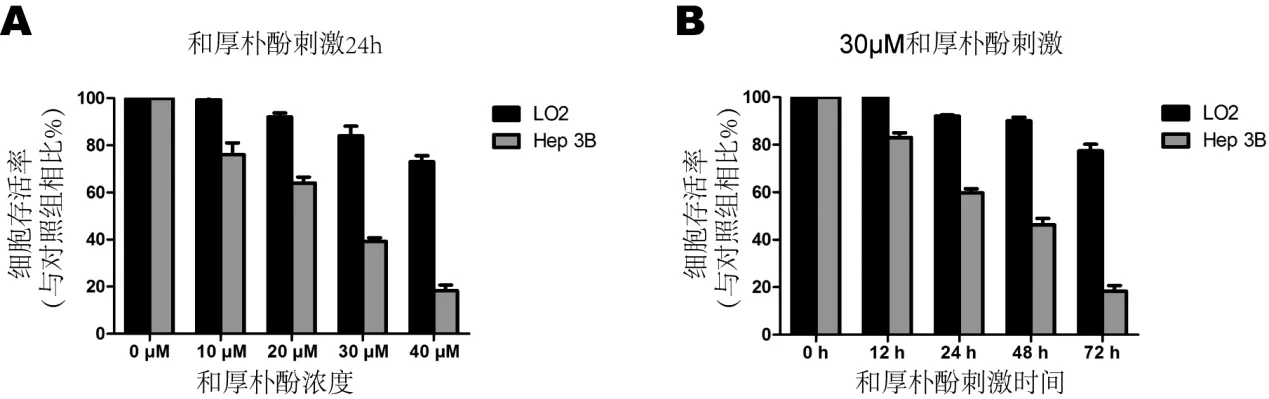
图1 HNK 对细胞活力的影响

图2 HNK 对Hep3B 细胞增殖能力的影响

图3 HNK 诱导Hep3B 细胞G1/S 期细胞周期阻滞

图4 HNK 对Hep3B 细胞体内成瘤能力的影响
表1 cyclin D1、P53、P27 和P21 蛋白的相对表达量,n=3)

表1 cyclin D1、P53、P27 和P21 蛋白的相对表达量,n=3)
注:与0 μM HNK 治疗组比较,*P <0.05;与20 μM HNK 治疗组比较,#P <0.05
2.4 HNK处理对细胞周期蛋白cyclin D1、P53、P27、P21的影响
如图5和表1所示:在HNK刺激24小时后,Hep3B中细胞周期蛋白cyclin D1表达水平下调,并呈现出剂量依赖性。同时, HNK处理后, Hep3B中细胞周期负性调节蛋白P53、P27、P21的表达水平上调。

图5 cyclin D1、P53、P27 和P21 蛋白的Western blot 结果
3 讨论
中草药活性成分用于预防和治疗癌症已有数百年历史,多种植物化学物质如生物碱、黄酮类、多酚化合物等均具有很大的抗癌潜力[9-10]。和厚朴酚(honokiol,HNK)是传统中草药厚朴的有效提取物之一,其抗肿瘤活性已在肺癌、乳腺癌、黑色素瘤等多种恶性肿瘤中得到验证[11-13]。
本研究表明,HNK能够在体外抑制HCC细胞Hep3B的增殖能力,这种抑制作用与诱导细胞周期G1/S阻滞有关,这与既往的相关研究结果一致[14]。为了进一步验证HNK对于HCC的治疗作用,我们构建了裸鼠皮下成瘤模型。体内实验结果与体外实验结果一致,结果均证实了HNK对HCC的增殖具有一定的抑制作用。
细胞周期调控涉及多种信号级联传导机制,包括DNA复制、细胞分裂和增殖等[15]。对G1期、S期、G2期等关键“检查点”的干扰将导致癌细胞的分裂失控和过度增殖[16]。细胞周期蛋白依赖性激酶(CDK)和细胞周期蛋白依赖性激酶抑制剂(CDKIS)的失衡在其中起着关键作用[17]。细胞周期蛋白D1是细胞周期蛋白家族的一员,它可以与CDK4或CDK6形成复合物,用于调节细胞周期从G1向S期的转变[18]。已证实,在多种肿瘤的发生发展过程中均存在细胞周期蛋白D1的过度表达并伴随CDK活性的失调,由此引发的肿瘤细胞异常增殖[19]。由于HNK可以影响Hep3B细胞的细胞周期并抑制细胞周期从G1向S期的转变,我们推测HNK可能通过调节细胞周期蛋白的表达来抑制Hep3B细胞的增殖。本研究中,我们发现NHK治疗可以显著下调Hep3B细胞周期蛋白cyclin D1,上调CDK抑制蛋白p21和p27。同时,HNK治疗后肿瘤抑制蛋白p53的表达明显增加,而P53已被证实与细胞周期停滞有关[20]。总之,本研究证实了NHK可能是一种天然的细胞周期蛋白cyclin D1抑制剂,其通过诱导G1/S期阻滞来抑制肝细胞癌的发生。
综上,我们得出结论:NHK通过抑制细胞周期蛋白cyclin D1诱导细胞周期G1/S阻滞,进而抑制了Hep3B细胞在体内和体外的增殖。因此,HNK可能作为一种天然、安全、有效的肝细胞癌辅助治疗药物。
