盐酸维格列汀对非酒精性脂肪肝大鼠肝组织UCP-2的表达及血清炎性因子的影响*
2019-12-17毛柳东
毛柳东
(深圳市葵涌人民医院葵丰社区健康服务中心,广东 深圳 518116)
非酒精性脂肪肝是指肝细胞内脂肪大量存积、变性导致的临床病理综合征,患者无过度饮酒史但大量的脂肪类食物摄入也造成了非酒精性脂肪肝发病率提高,严重者甚至发展为肝硬化或终末期肝病,严重威胁患者的健康和日常生活,并且目前临床上尚未出现有效的治疗药物[1-2]。肿瘤坏死因子-α(TNF-α)、白介素6(IL-6)是血清中常见的致炎因子,解偶联蛋白2(UCP-2)为肥胖的候选基因,与胰岛素形成抵抗,均与脂肪肝的形成密切相关,盐酸维格列汀为新型的抗高血糖药物,能够改善肝脏内的脂肪沉积,但是作用机制尚未明确[3]。本文旨在探讨盐酸维格列汀对非酒精性脂肪肝大鼠肝组织UCP-2的表达及血清炎性因子的影响,为非酒精性脂肪肝的防治提供新的思路。
1 材料与方法
1.1实验动物及分组 四川成都达硕生物有限公司提供的实验SD大鼠(合格证号:0018160)24只,体重120~170g,平均体重(152.92±10.23)g,随机分成3组,每组各8只。
1.2设备与试剂
1.2.1设备 动物IVC饲养系统(苏杭仪器),病理切片机(Leica),酶标仪(Tecan),显微镜(明美),微量核酸仪(北京奥凯),Real time PCR(ABI7500)。
1.2.2试剂 逆转录试剂盒(Takara),Real time PCR kit(Takara),Tirzol(Ginbio®),ELISA kit(武汉华美),EMSA kit(Ginbio®),DAB 显色试剂盒(福建迈新),ECL 显色试剂盒(碧云天),UCP-2 antibody(Abcam),苏木精-HE显色试剂盒(Ginbio®)。
1.3实验方法与检测指标
1.3.1实验方法 对照组大鼠给予正常饮食结合等量生理盐水皮下注射;模型组大鼠给予正常饮食,并以0.3 mL/10g 给予5 %CCl4花生油溶液皮下多点注射,1次/5 d;干预组大鼠在造模后给予盐酸维格列汀50 mg/kg·d,灌胃给药。8周后所有大鼠麻醉后断头取血分离血清,检测IL-6、TNF-α和转氨酶水平;将左叶肝组织取出并送检,检测其NF-κB活性和CUP-2表达。
1.3.2检测指标 (1)NF- B活性检测:采用EMSA法,利用BandScan5.0图象分析软件分析面积灰度,并根据结果计算NF-κB活性值。(2)病理学检查:麻醉后断头处死大鼠,逐层剪开腹腔皮肤黏膜,取出肝左叶,采用4 %甲醛固定,同时给予脱水,透明,浸蜡,包埋,4μm切片,HE染色,光镜下(100倍)观察大鼠肝组织病理变化。(3)大鼠肝组织UCP-2的表达:免疫组化法和逆转录聚合酶链反应(RT-PCR)法检测各组大鼠肝组织UCP-2的表达,具实施步骤如下:①RNA提取:液氮研磨组织,常规RNA提取,微量核酸仪检测,保证A260A280在1.8~2.0间 TAKARA逆转录试剂盒转录,荧光定量PCR鉴定基因表达,UCP-2引物 F: CTCCCAATGTTGCCCGAAAT,R: GAGGTCGTCTGTCATGAGGT,GAPDH 内参 F: GATGC TGGTG CTGAG TATGCCGR: GTGGT GCAGG ATGCA TTGCT CTGA,cDNA的合成,a从-80 ℃冰箱中取出样品 RNA,4 ℃下解冻,然后在 0.2 mL PCR 管中配制反应溶液(表1);b反应程序:37 ℃ 15 min (反转录反应),85 ℃ 5 s(反转录酶的失活反应),4 ℃,②SYBR Green RT-PCR:a配制反应体系(表2),b将 PCR管置于定量 PCR 仪中进行反应,反应程序:Stage 1: 预变性,Reps:1,95 ℃ 30 s,Stage 2:PCR 反应,Reps:40,95 ℃,3 s,60 ℃,30 s,Melt Curve Stage(由熔解曲线来判断引物特异性,若同一对引物的所有样品的熔解曲线均是单一峰且峰值一致则表示该引物特异性良好)。见表1,表2。(4)血清IL-6、TNF-α水平:ELISA法检测各组大鼠血清IL-6、TNF-α水平。(5)肝功能:检测各组大鼠的肝功能 。

表1 20 μL反转录反应溶液配制体系

表2 20 μL反应配制体系
2 结果
2.1不同组大鼠肝组织病理改变 正常对照组肝小叶结构清晰完整,肝细胞未见明显脂肪变性,细胞核清晰可见;模型组中,肝细胞肿胀,胞质疏散,含脂肪粒,肝细胞核固缩;干预组脂肪粒变小,肝细胞结果趋于正常。见图1。

图1 不同组大鼠肝组织 HE染色观察肝组织病理改变(400X)
2.2不同组大鼠肝组织UCP-2表达 光学显微镜下显示,对照组大鼠的肝组织病理学形态变化正常,且未见UCP2 阳性肝细胞;模型组大鼠肝组织病理学形态存在程度不一的变性情况,且细胞体积出现异常增大,并且UCP2 阳性肝细胞广泛分布,主要分布在细胞浆中与脂肪化程度呈现正相关;而干预组大鼠UCP2阳性肝细胞显著减少。见图2,图3。
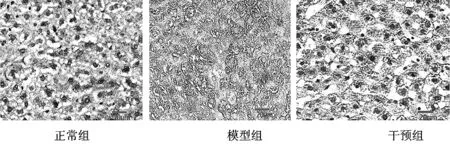
图2 不同组大鼠肝组织UCP-2 肝组织表达(400X)
2.3荧光定量PCR检测不同组大鼠肝组织UCP-2基因表达 在对照组,P65和探针基本没有结合;而在模型组,结合明显增多;干预组结合能力降低,说明干预后P65的细胞核转移能力和结合启动下游因子转录的能力降低,差异具有统计学意义(P<0.05)。见图3。
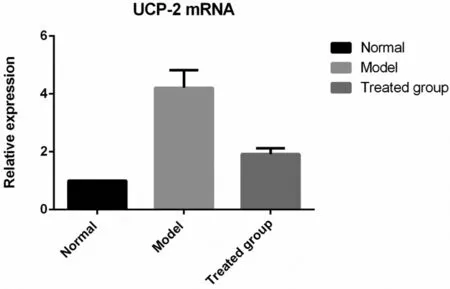
图3 荧光定量PCR检测不同组大鼠肝组织UCP-2基因表达
2.4不同组大鼠血清IL-6、TNF-α水平及肝功能比较 干预组大鼠血清IL-6、TNF-α水平及肝功能指标水平较模型组显著下降,差异具有统计学意义(P<0.05)。见表3。

表3 不同组大鼠血清IL-6、TNF-α水平及肝功能比较
注:与模型组比 a为P<0.05
3 讨论
解偶联蛋白存在于细胞线粒体膜中,可强化线粒体氧化磷酸化解偶联反应,促使形成线粒体ATP能量,使得体内热能得到释放,调节线粒体对能力的储备功能。UCP2是常见的解偶联蛋白,是线粒体内膜上的质子通道,UCP2在正常肝组织细胞内仅对库普夫细胞存在表达,而对肝细胞无表达或表达水平不高,ATP在肝细胞氧化物中的生成效率减弱,抑制脂质物质在肝脏中堆积,使得患者肝细胞需求平衡起到调节作用[4-5],UCP2的优势主要为:(1)对脂肪酸β氧化具有调节平衡作用,能够让干细胞内外转运脂肪酸的能力提高,脂肪酸利用增加,减少脂质物质沉积;(2)能够让线粒体内膜的电化学梯度以及合成ATP能力提高,介导质子的跨膜内流[6];(3)促进线粒体能量的分解,储备功能受到抑制,诱发肝细胞坏死,产生大量的LPO、ROS为UCP2的产生提供条件,UCP2表达增强,进而诱发肝细胞的坏死[7]。UCP2表达在脂肪肝形成过程中是具有双面性,一方面肝组织可以适应性做出反应,减少肝脏组织内脂质物质的沉积,但是另一方面由于脂质物质的过度分解,减弱了能量储备功能,使得肝细胞耐受性降低,并且禁食、应激注射等极易诱发肝细胞坏死[8]。
国内外研究表明,非酒精性脂肪肝肝细胞UCP2表达异常增强,与高脂质物质、游离脂肪酸、内毒素、肿瘤坏死因子、白介素水平密切相关。动物实验发现切除小鼠肝脏,发现肝细胞线粒体产物H2O2迅速增加,而后肝细胞中UCP2表达也迅速上升[8],Pheiffer[9]认为非酒精性脂肪肝的肝组织细胞中的UCP2表达增强,能量的储备受到影响,增加肝细胞坏死的敏感性,因此,下调肝细胞中UCP2表达为防治非酒精性脂肪肝提供了新的思路。
本实验中采用SD大鼠建立非酒精性脂肪肝模型,发现模型组大鼠肝组织病理学形态存在程度不一的变性,且细胞体积出现异常增大,UCP2 阳性肝细胞广泛分布,主要分布在细胞浆中与脂肪化程度呈现正相关。实验结果提示,在非酒精性脂肪肝的形成过程中,伴随着脂肪肝程度的不断发展,肝组织中UCP2表达增强,损伤肝细胞、肝功能与以往研究基本一致。同时本实验还显示,模型组大鼠血清IL-6、TNF-α水平及肝功能指标水平显著上升,进一步损伤肝脏组织,导致肝功能降低。
维格列汀是临床治疗2型糖尿病的常用药物,其选择性、竞争性较强,是可逆的DPP24抑制剂,正常情况下GIP(葡萄糖依赖性促胰岛素多肽)、GLP21(胰高血糖素样多肽)可有效维持机体内葡萄糖浓度,具有肠促胰岛素的作用,糖尿病患者的GIP作用损伤,仅有GIP21促进胰岛素分泌的作用,维格列汀能够与蛋白有效结合,形成DPP24复合物抑制该酶的活性,促进胰岛素产生降低血糖浓度[10]。近年来国外研究显示,维格列汀能够降低非酒精性脂肪肝的肝细胞UCP2表达,且具有促进血清IL-6、TNF-α水平,改善肝功能的作用[11]。本研究显示,维格列汀干预组大鼠UCP2阳性肝细胞显著减少,大鼠血清IL-6、TNF-α水平及肝功能指标水平较模型组显著下降。结果提示,盐酸维格列汀可抑制非酒精性脂肪肝大鼠肝组织UCP-2的表达,降低血清IL-6、TNF-α炎性因子水平,促进肝功能恢复,为非酒精性脂肪肝的防治提供新的思路。
