猪源IFN-λ3的克隆、表达及抗病毒活性分析
2019-12-16宋利娜郝鹏飞姜宇航付婷婷金宁一
陈 竞,许 汪,宋利娜,郝鹏飞,姜宇航,付婷婷,金 鑫,金宁一,李 昌
(1.延边大学农学院,延吉 133000;2.军事医学研究院军事兽医研究所,长春 130122)
干扰素根据其作用受体不同分为Ⅰ型、Ⅱ型和Ⅲ型,Ⅰ型干扰素包括IFNα、IFNβ、IFNε、IFNκ等,Ⅱ型干扰素包括IFNγ,Ⅲ型干扰素包括IFN-λs。在干扰素细胞因子家族中,IFN-λs是一类主要作用于上皮细胞的干扰素[1-4]。人用IFN-λ研究较广,且已进入临床应用[5]。兽用IFN-λ的研究起步较晚,相关文献报道不多。研究表明,猪的Ⅲ型干扰素(porcine interferon λ,pIFNλ)主要由 IFN-λ1、IFN-λ3两种亚型构成。pIFN-λ1基因的ORF为576个碱基,编码192个氨基酸,其中第1~19个氨基酸构成信号肽,第20~192个氨基酸为成熟蛋白;pIFN-λ3 基因的ORF为588个碱基,编码195个氨基酸,其中第1~23个氨基酸构成信号肽,第24~195个氨基酸为成熟蛋白。pIFN-λ1和pIFN-λ3氨基酸同源性仅为52.4%,且抗病毒活性存在差异[6-8]。pIFN-λ4未见相关研究报道。前期的猪源Ⅲ型干扰素研究主要围绕猪IFN-λ1进行。研究表明其对猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)、猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)、猪伪狂犬病毒(Porcine pseudorabies virus,PRV)等均有不同程度的抗病毒活性[8,9]。本实验室前期也进行了猪IFN-λ1的克隆、表达与抗病毒活性研究[10]。为了探究猪源IFN-λ3是否也同样具有抗病毒活性,本研究克隆了猪IFN-λ3基因,利用真核表达系统进行表达,并分析其在不同来源细胞如PK15、MDCK中对表达绿色荧光蛋白的重组水泡性口炎病毒(Vesicular stomatitis virus-green fluorescent protein,VSVG)活性的抑制,以期为深入研究猪IFN-λ3的抗病毒活性提供参考。
1 材料与方法
1.1 材料CRL2845细胞、PK15细胞、MDCK细胞、293细胞、VSVG病毒、pcDNA3.1(+)载体为本实验室保存;Bioflux凝胶回收试剂盒购自杭州博日科技
有限公司;UNIQ-10柱式Triziol总RNA抽提试剂盒购自生工生物工程(上海)股份有限公司;DNA Marker购自宝生物工程(大连)有限公司;pEASYBlunt Simple载体、Trans1-T1感受态细胞购自北京全式金生物技术有限公司;PEIpro Transfection Reagent转染试剂购自Polyplus- transfection公司;青-链霉素溶液购自Gibco公司;胎牛血清(FBS)(BI)、DMEM购自Hyclone公司;质粒DNA小量提取试剂盒购自Axygen公司;Anti-Flag抗体为中杉金桥产品;HRP-山羊抗鼠IgG 购自碧云天生物技术公司。
1.2 引物设计及合成参考GenBank中登录的猪IFN-λ3基因序列(登录号:GQ996936.1),设计扩增引物。在扩增引物的两端分别添加EcoR I和XhoI酶切位点(斜体、加粗、下划线表示)。为方便蛋白表达检测,在上游引物添加Flag基因序列(加粗、下划线表示)。上游引物pIFN-λ3-EcoR I-UP:5'-GATTACAAGGATGACG ACGATAAGATGGCCCTGGGTGGCTCGCT-3';下游引物pIFN-λ3-XhoI-DOWN:5'AAGCTTATGGGTACCtcagacacacaggtctccac-3'。
1.3 pIFN-λ3基因的克隆及序列分析Trizol法提取猪肺巨噬细胞CRL2845总RNA,并反转录为cDNA。以该cDNA为模板,通过PCR技术扩增pIFN-λ3基因。经1%琼脂糖凝胶电泳后分离回收目的片段,克隆至pEASY-Blunt Simple载体,经质粒转化、单菌落筛选、质粒提取及双酶切鉴定等常规方法获得重组质粒pEASY-pIFN-λ3,并进行DNA测序分析。
1.4 重组表达质粒构建与鉴定测序正确的pIFN-λ3基因片段经EcoR I和XhoI双酶切后,进行1%琼脂糖凝胶电泳,分离回收目的片段,用T4 DNA连接酶连接至真核表达载体pcDNA3.1,经常规分子克隆方法获得真核表达质粒pcDNA3.1-pIFN-λ3。
1.5 细胞转染将293细胞接种于6孔板中,5%CO2培养箱中培养过夜。转染前弃掉原培养基,更换为Opti-MEM,分别将重组质粒pcDNA3.1-pIFN-λ3及其对照载体pcDNA3.1与PEI pro转染试剂按1∶1混合均匀,室温静置20 min,均匀滴加到6孔板中,37℃培养48 h,收集细胞蛋白,同时收集培养上清。
1.6 Western blot分析pIFN-λ3表达将制备好的蛋白样品进行SDS-PAGE电泳,然后通过半干法转印至NC膜。转膜结束后5%脱脂乳室温封闭1 h,以Anti-Flag Tag为一抗室温孵育2 h,山羊抗鼠IgG为二抗室温孵育1 h,每个步骤之间均需要TBST洗膜3次,每次10 min。最后与化学发光液ECL反应,曝光显影。
1.7 pIFN-λ3在PK15、MDCK细胞上的抗病毒活性分析通过结晶紫染色、荧光观察和流式细胞术3种方法分析pIFN-λ3在PK15、MDCK细胞上的抗病毒活性。
1.7.1 结晶紫染色法 将PK15、MDCK细胞接种于12孔板,106cells/well,待细胞长满单层后进行实验。将12孔板中原有培养基弃掉,并使用PBS清洗1次。用双无DMEM分别稀释含pIFN-λ3的细胞培养上清和转染的空载体上清(稀释倍数为102),并加至相应的孔中(500 μL/well),37℃、5%CO2孵育12 h;弃掉培养基,并用PBS清洗细胞1次,接种VSVG至12孔板中(PK15为0.1MOI,MDCK为0.001MOI),并设置阴性对照,孵育1 h后,弃掉病毒液,PBS清洗2次,添加双无培养基(500 μL/well),继续培养。待空载组细胞几乎全部死亡时,进行结晶紫染色(500 μL/well),室温孵育15 min,PBS清洗至无色。
1.7.2 荧光观察法 将PK15、MDCK细胞接种于6孔板(2×106cells/well),待细胞长满单层后,用双无DMEM分别稀释含pIFN-λ3的上清和转染的空载体上清后,分别加入相应的孔中(1 mL/well),37℃、5%CO2孵育12 h;接种VSVG至16孔板中(PK15 0.1 MOI,MDCK 0.001 MOI),孵育1 h后弃掉病毒液,并用PBS清洗2次,加1 mL双无培养基继续培养;24 h后弃掉上清并用PBS清洗细胞,使用荧光显微镜观察荧光。
1.7.3 流式细胞术 荧光显微镜观察后,用胰酶消化细胞,吹匀,2176×g离心5 min,弃去上清,用500 μL PBS重悬细胞,通过流式细胞术计算表达绿色荧光蛋白(Green fluorescent protein,GFP)的细胞数。
2 结果
2.1 pIFN-λ3基因的扩增、克隆及鉴定分析提取猪肺巨噬细胞CRL2845的RNA,RT-PCR扩增pIFN-λ3基因,琼脂糖凝胶电泳结果可见约600 bp的条带(图1),回收后构建重组质粒pEASY-pIFN-λ3。双酶切鉴定(图2)及DNA序列测定显示与GenBank中登录的猪IFN-λ3基因参考序列(GQ996936.1)完全一致,表明猪肺巨噬细胞CRL2845中存在pIFN-λ3基因的转录本。将其编码的氨基酸序列经BLAST在线比对后,选取部分物种的IFN-λ3基因进行进化树分析,发现猪IFN-λ3与人源IFN-λ3的进化距离较远,而与骆驼、羊驼的IFN-λ3同处于一个大的分支,进化距离较近,表明他们的亲缘关系较近(图3)。猪源IFN-λ3与骆驼、羊驼IFN-λ3的序列同源性比对结果也显示其亲缘关系较近(图4)。
2.2 重组表达质粒构建与鉴定用EcoR I 和XhoI 酶切载体pcDNA3.1和重组克隆质粒pEASY -pIFN-λ3(37℃、1.5 h),胶回收目的片段后以T4 DNA连接酶连接,构建重组表达质粒pcDNA3.1--pIFN-λ3,并转化至trans1-T1感受态细胞,37℃倒置培养12 h,挑取阳性菌落,37℃震荡培养12 h后提取质粒,进行EcoR I 和XhoI双酶切鉴定(图5)。
2.3 pcDNA3.1- pIFN-λ3的表达鉴定重组质粒pcDNA3.1-pIFN-λ3转染293细胞48 h 时,通过Western blot分析重组蛋白pIFN-λ3瞬时表达情况,结果显示在22~25 kDa之间有单一特异性条带(图6),表明该蛋白成功获得表达。
2.4 结晶紫染色法分析pIFN-λ3在PK15、MDCK细胞上的抗病毒活性对表达pIFN-λ3的上清进行102倍稀释后,分别作用于PK15、MDCK细胞,通过VSVG感染分析其抗病毒活性,结晶紫染色法结果如图7所示,未接种病毒的细胞组(Mock)全部被染成紫色,表明细胞没有死亡;接种病毒且未使用含pIFN-λ3培养上清处理的细胞组(Vector)几乎全部死亡脱落,而经过pIFN-λ3培养上清处理的细胞对VSVG感染表现出抑制作用,表明pIFN-λ3能够在体外抑制VSVG对PK15、MDCK细胞的感染。
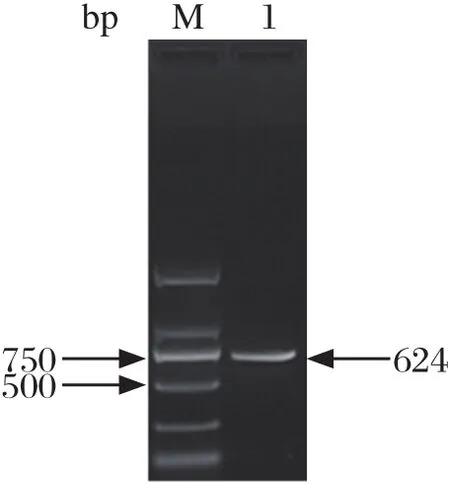
图1 pIFN-λ3基因的PCR扩增结果Fig.1 PCR amplification of pIFN-λ3 gene

图2 双酶切鉴定重组质粒pEASY -pIFN-λ3Fig.2 Restriction endonuclease digestion of recombinant plasmid pEASY-pIFN-λ3
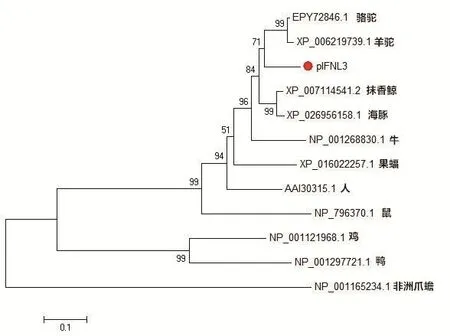
图3 pIFN-λ3基因的遗传进化分析Fig.3 Genetic evolution analysis of pIFN-λ3 gene

图4 猪源pIFN-λ3与羊驼、骆驼IFN-λ3的同源性分析Fig.4 Homology of porcine pIFN-λ3 with alpaca and camel IFN-λ3
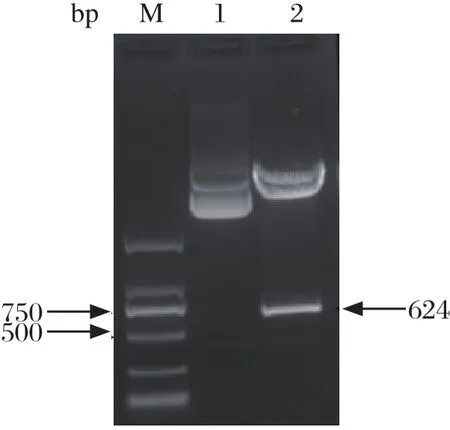
图5 重组质粒pcDNA3.1-pIFN-λ3的双酶切鉴定Fig.5 Double restriction enzyme digestion of recombinant plasmid pcDNA3.1-pIFN-λ3

图6 重组蛋白pIFN-λ3的Western blot分析Fig.6 Western blot analysis of recombinant protein pIFN-λ3
2.5 荧光观察法分析pIFN-λ3在PK15、MDCK细胞上的抗病毒活性荧光观察结果显示,未接种病毒的细胞组(Mock)无荧光且细胞状态良好;接种病毒但未使用含pIFN-λ3培养上清处理的细胞组(Vector)荧光强度最高且细胞出现明显病变;经过pIFN-λ3培养上清处理的细胞荧光强度与密度、细胞病变程度均低于不含pIFN-λ3培养上清处理的细胞(图8),证实pIFN-λ3在PK15、MDCK细胞上对VSVG感染具有抑制作用。
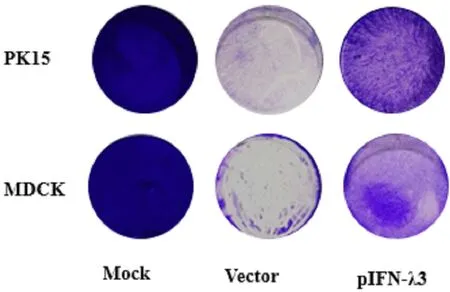
图7 结晶紫染色法分析pIFN-λ3在PK15、MDCK细胞上的抗病毒活性Fig.7 Analysis of antiviral activity of pIFN-λ3 on PK15 and MDCK cells by crystal violet staining
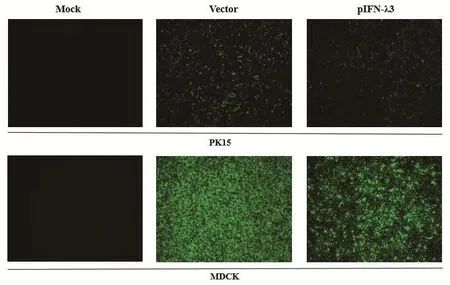
图8 荧光观察法分析pIFN-λ3在PK15、MDCK细胞上的抗病毒活性(100×)Fig.8 Fluorescence observation analysis of antiviral activity of pIFN-λ3 on PK15 and MDCK cells (100×)
2.6 流式细胞术分析pIFN-λ3在PK15、MDCK细胞上的抗病毒活性流式细胞术分析结果显示,未接种病毒的PK15、MDCK细胞组(Mock)荧光率分别为1.5%、1.5%;接种病毒但未使用含pIFN-λ3培养上清处理的PK15、MDCK细胞组(Vector)荧光率分别为74.27%、99.30%;经过pIFN-λ3培养上清处理的PK15、MDCK细胞荧光率分别为60.94%、77.35%(图9)。经过pIFN-λ3培养上清处理的荧光百分比均低于未使用pIFN-λ3培养上清处理的细胞,说明pIFN-λ3能够在PK15、MDCK细胞上抑制VSVG的感染。

图9 流式细胞术分析pIFN-λ3在PK15、MDCK细胞上的抗病毒活性Fig.9 Flow cytometry analysis of antiviral activity of pIFN-λ3 on PK15, MDCK cells
3 讨论
Ⅲ型干扰素(iterferon lambda,IFN-λ)是2003年首次被报道的一类不同于I型干扰素和II型干扰素的新干扰素家族,包括IFN-λ1、IFN-λ3、IFN-λ2、IFN-λ4。IFN-λ与其受体结合可刺激与I型干扰素相类似的下游通路,如Jak-STAT信号转导通路和MAPK通路,最终诱导干扰素刺激基因ISGs的表达,产生抗病毒效应[11]。目前,pIFN-λ3的相关研究已表明,猪IFN-λ3能够在体外对猪源细胞实现一定的抗病毒效果,并且当病毒感染细胞后,pIFN-λ3的表达水平也会出现明显的上调。郭珊珊[12]等利用杆状病毒表达系统在昆虫细胞上表达重组pIFN-λ3并进行了抗猪流行性腹泻病毒(PEDV)的研究,结果表明rPoIFN-L3可呈剂量依赖性抑制PEDV复制,并且上调相关干扰素-刺激基因(interferon-stimulated genes,ISGs)的表达。刘伟[13]等利用PRRSV强毒与弱毒株感染猪肺泡巨噬细胞(porcine alveolar macrophage,PAM),通过实时荧光定量PCR检测发现PRRSV感染PAM细胞后在mRNA水平上诱导IFN-λ1和IFN-λ3表达上调,且IFN-λ3比IFN-λ1上调更明显。刘勇仕等[14]在重组植物乳杆菌表面锚定表达猪IFN-λ3,利用重组菌刺激细胞后,通过荧光定量PCR检测发现该重组菌能够显著抑制PEDV在IPEC-J2中的复制,并能诱导细胞中ISGs的高转录水平。
研究表明,在肠上皮屏障限制病毒感染的过程中,与pIFN-λ1相比,pIFN-λ3具有更高效的抑制猪肠道冠状病毒感染的作用,说明pIFN-λ3抗病毒活性优于pIFN-λ1[6,15],这为后续猪源III型干扰素的研究提供了一个新的方向和思路。因此,本研究克隆了猪源IFN-λ3基因,利用真核表达系统表达其蛋白,收集转染后上清并在PK15、MDCK细胞上进行抗病毒活性实验,利用结晶紫染色法、荧光观察法和流式细胞术三种方法分析结果。结果表明,表达pIFN-λ3的上清能够在体外抑制VSV对细胞的感染能力,且在不同来源的细胞上存在程度不同的抗病毒活性,为后续深入研究pIFN-λ3对于其他病毒的抗病毒活性提供了参考。
