核素显像在原发性醛固酮增多症患者中的应用
2019-12-14丁洁李方霍力
丁洁 李方 霍力
中国医学科学院北京协和医学院北京协和医院核医学科,核医学分子靶向诊疗北京市重点实验室 100730
原发性醛固酮增多症(primary aldosteronism,PA)是肾上腺皮质增生或肿瘤导致醛固酮分泌过多而出现的多系统症候群,也是继发性高血压的病因之一,占新发高血压患者的11.2%[1]。PA常累及心血管、神经、肌肉、肾脏等多个系统,其中PA患者心血管疾病发病率及病死率均高于其他病因导致的高血压患者[2]。降低PA患者心血管疾病风险的有效手段是早期诊断并采用积极有效的治疗手段,其治疗方法包括手术治疗及药物治疗[3],治疗方式的选择与PA病因及患者意愿密切相关。因此,PA的诊断除定性诊断外,病因诊断也是其治疗的关键。
1 PA的病因
PA的定性诊断相对简单,除高血压、低血钾以及典型血尿生化改变这几个指标外,若安体舒通试验能纠正代谢紊乱和降低血压,并且能证实体内存在醛固酮分泌水平增高及肾素-血管紧张素活性受抑制,即可确诊[3]。
PA的病因诊断相对复杂,包括:①醛固酮瘤(aldosterone-producing adenoma,APA)占PA的60%~85%,常为单个,直径多为1~2 cm,但有约25%的APA的瘤体直径<1 cm。通过手术,这些患者的高血压都能得到改善,且其中35%~60%的患者的高血压能被治愈[4]。②双侧特发性肾上腺增生占PA的15%~40%,以药物保守治疗为主。③其他发病率极低的病变包括糖皮质激素可抑制性PA、家族性PA、单侧肾上腺增生和异位醛固酮肿瘤等。一般单侧病变可以考虑手术治疗,如为双侧病变,则采取药物治疗。
由此可见,PA的病因诊断需明确是单侧病变还是双侧病变(又称为偏侧性检验),另外PA还需要与发病率约4%~7%[5](大于40岁的人群)的无功能肾上腺偶发瘤(adrenal incidentaloma,AI)相鉴别,以上两点成为PA病因诊断中临床医师关心的问题。
2 病因诊断中的问题
以CT与MRI为代表的常规影像学检查方法,可以通过观察肾上腺的形态学变化(增粗、占位)对临床诊断PA的患者病因进行初步评定,无创且安全,灵敏度优势突出,但对双侧多发结节或与AI进行鉴别时,由于无法分辨肾上腺占位病变的功能,其特异度和准确率低[6]。因此,除非临床明确诊断为PA、年龄小于35岁且肾上腺只有一个占位的患者可以直接选择手术治疗外,其余的患者如选择手术治疗则必须进行偏侧性检验[3],即肾上腺静脉取血,以明确是否有手术机会(图1)。
肾上腺静脉取血检查需要通过介入插管测量右肾上腺静脉、左肾上腺静脉和下腔静脉血样中的醛固酮和皮质醇浓度,文献[3]的研究结果表明,肾上腺静脉取血对分型诊断的灵敏度与特异度均可达90%以上,是目前偏侧性检验常用的方法。但是,开展肾上腺静脉取血主要存在以下突出问题[7]:①有创检查风险高(如肾上腺静脉破裂等),操作难度大,成功率参差不齐(30.5%~96.0%),这主要与操作者的熟练程度有关;②操作流程及结果判读标准不统一;③检查前需停用较长时间(6周)盐皮质激素受体拮抗剂等药物,导致患者持续高血压及低血钾。
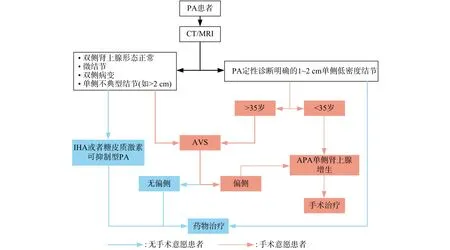
图1 PA患者的诊断和治疗的流程图 图中,PA:原发性醛固酮增多症;CT:计算机体层摄影术;MRI:磁共振成像;IHA:特发性肾上腺增生;AVS:肾上腺静脉取血;APA:醛固酮瘤。Fig.1 Flow chart for diagnosis and treatment of patients with primary aldosteronism
因此,临床迫切需要一种无创、灵敏度高的方法,安全有效地筛查可以手术治愈的PA患者。以分子影像为基础的核医学检查方法在肾上腺疾病诊断、肿瘤分泌功能等特征检测方面显示了突出的优势,为PA的病因诊断提供了新思路和新方法。
3 核医学显像药物
目前临床用于肾上腺皮质功能显像的放射性药物包括胆固醇类似物、美托咪酯类似物、趋化因子受体4(CXC chemokine receptor 4,CXCR4)配体以及葡萄糖类似物(表1)。
胆固醇类似物显像研究中时间最久、样本量最大、使用较多的为131碘-6β-碘甲基-19-去甲胆固醇(131I-6beta-iodomethyl-19-norcholesterol,131I-NP)-59单光子显像,其检查过程繁琐,需在显像开始前3天每天口服6 mg地塞米松以抑制正常肾上腺对胆固醇的摄取,增加肿瘤检出率,同时需要封闭甲状腺以防止脱落的放射性碘对甲状腺组织的破坏,随后分别在注射药物后的第3、5天显像2次,前后位采集后根据需要增加断层融合检查[12]。由于75硒-6-β-硒甲基-19-去甲胆固醇(75Se-6-betaselenomethyl–norcholesterol)的半衰期长达119 d,目前临床上已很少使用。
美托咪酯类似物11C-美托咪酯(metomidate,MTO)是目前主要用于PA患者临床研究的PET显像药物,具有合成时间短、产率高等优点。值得注意的是,11β-羟化酶(CYP11B1)在正常肾上腺组织和AI中均高表达,故对11C-MTO摄取也会增高。现多利用检查前3天口服0.5 mg小剂量地塞米松(抑制CYB11B1酶活性)的方法来降低正常肾上腺组织和AI的摄取,从而提高对APA诊断的准确率[13-14]。但是,11C-MTO未能在临床广泛推广,主要与11C的半衰期较短(20 min)有关。也有研究者进行123I-MTO SPECT显像,证明其在肾上腺占位的功能显像中具有发展前景[15]。
68Ga-pentixafor具有合成简单、放射化学纯度较高、稳定性好、半衰期较长(68 min)、检查前无需特别准备、PET/CT空间分辨率较高以及检查时间短等优势[16],但是68Ga的生产需要专用的68Ge/68Ga发生器,且该检查必需由PET/CT设备完成,因此制约了其在临床上的广泛应用。
18F-FDG是葡萄糖类似物,能反映体内细胞对葡萄糖的摄取情况。其他18F标记的新型显像剂大多处于临床前研究中,目前最有临床应用前景的显像剂是18F-CDP2230,其是一种选择性醛固酮合成酶(CYP11B2)抑制剂,体外放射自显影研究结果证实18F-CDP2230只对APA细胞中表达CYP11B2的区域具有特异性结合能力,未来有可能用于PA患者肾上腺占位功能的评估[17]。

表1 临床上使用的肾上腺皮质显像药物Table 1 Clinically used adrenal cortical radiopharmaceuticals
4 核医学显像的临床应用
4.1 131I-NP-59的SPECT/CT显像
Volpe等[18]研究纳入33例PA患者,结果发现131I-NP-59 SPECT诊断APA的真阳性率为76%(25/33)。而131I-NP-59 SPECT/CT融合显像将功能影像与解剖影像相结合,能显著提高SPECT的诊断效能。近年来,一项更多病例(n=145)的研究结果表明,131I-NP-59 SPECT/CT诊断APA的灵敏度、特异度及阳性预测值分别为85.0%、60.0%及89.5%[19]。另外,结合图像半定量参数:肿物/肝脏(tumor to liver ratio,TLR)以及病灶/对侧肾上腺(tumor to contralateral ratio,LCR)的SUVmax的比值可以将APA诊断灵敏度从73.7%提高至94.7%[20]。这些结果表明了131I-NP-59 SPECT/CT对APA诊断的灵敏度较高,但特异度较差。其他临床应用领域包括PA患者手术疗效预测,Yen等[21]发现,27例手术治疗的PA患者中,131I-NP-59 SPECT/CT诊断阴性的7例患者术后临床症状均无改善。
4.2 11C-MTO与123I-MTO
小样本量研究结果表明,11C-MTO可用于肾上腺皮质与非皮质来源肿物的鉴别诊断,灵敏度与特异度均可达100%[22-23],而较大样本量(n=79)的研究结果发现,其灵敏度和特异度分别为89%和96%[13]。Hennings等[14]纳入了11例PA及2例无功能AI的患者,11C-MTO PET显像结果表明PA病灶的SUV高于后者(P<0.05)。Burton等[10]纳入44例患者(39例PA、5例无功能AI)进行研究,结果发现APA病灶(SUVmax=21.7±1.6)对11C-MTO的摄取明显高于正常肾上腺组织(SUVmax=13.8±0.6)、AI(SUVmax=11.5±3.3)及特发性肾上腺增生(SUVmax=17.3±1.2),当以1.25作为肿瘤与正常肾上腺组织SUVmax比值的阈值时,其灵敏度为76%、特异度为87%,当SUVmax>17时,特异度可达100%。
虽然一直有学者在检查准备、图像采集以及数据分析方面做出改进,但是回旋加速器高昂的价格、11C较短的半衰期(20 min),让部分研究者转而使用123I-MTO进行PA的临床研究。研究结果表明,123I-MTO鉴别肾上腺皮质源性肿瘤的灵敏度为89%、特异度为85%,而通过TLR进行半定量分析,当TLR=1.3为阈值时,灵敏度为83.3%、特异度为86.4%;当TLR=3.8为阈值时,特异度可达100%、灵敏度为61.1%[15]。总之,11C-MTO与123I-MTO在鉴别肾上腺皮质与非皮质来源肿物方面具有较高的灵敏度和特异度。此外,11C-MTO在鉴别APA中也有较好表现,是具有较好发展前景的显像药物,但较短的半衰期仍限制了其在临床上的使用;123I-MTO具有合适的半衰期,与肾上腺皮质受体也具有高的亲和力,但据我们了解,目前尚无临床研究探究其在APA上的应用,尚需进一步探讨。
4.3 68Ga-pentixafor
Heinze等[11]对9例APA患者进行了68Gapentixafor PET/CT检查,7例术后患者中有6例表现出了病灶侧较对侧摄取明显增高,仅1例瘤体直径为6 mm的APA患者表现出了偏侧错误,这可能与空间分辨率较低有关。与正常的肾上腺组织相比,当SUVmax=4.8为阈值时,68Ga-pentixafor诊断APA的灵敏度与特异度分别为89%、85%;当SUVmax=7.8为阈值时,灵敏度与特异度分别为67%、100%;当SUVmax=4.7为阈值时,灵敏度与特异度分别为100%、81%。尽管68Ga-pentixafor PET/CT在PA患者中的应用目前只有小样本研究结果,但其在PA患者中的应用价值值得期待。
4.4 18F-FDG
18F-FDG作为肿瘤广谱显像剂在肿瘤良恶性鉴别中被广泛应用,也可在PA患者肾上腺病变良恶性鉴别中发挥一定的作用。有研究者认为APA摄取18F-FDG较AI明显增高[24],但也有研究者认为18F-FDG无法鉴别肾上腺有无功能[25]。18F-FDG在PA患者偏侧性检验方面的价值值得进一步研究,对扩大18F-FDG临床应用领域,解决临床问题,均有重要意义。
5 小结与展望
PA患者分型诊断的各种核素显像方法的优缺点见表2。综上所述,随着高血压患者被诊断为PA的比例越来越高,评价PA患者肾上腺病变的类型,进行明确的病因诊断,选择个体化治疗方案,将成为临床越来越关注的问题。以分子探针、功能显像为特点的核素检查,通过开发新探针和临床转化研究,与常规影像学检查联合,为PA患者的治疗方式选择提供更积极、有效的无创方法,发挥越来越重要的作用。

表2 PA患者分型诊断的核素显像方法的优缺点Table 2 Advantages and disadvantages of the radionuclide imaging methods for subtyping of patients with primary aldosteronism
