4种观赏苔藓植物适应不同水体环境的生理分析
2019-12-13李圆圆李倩李丹丹于晶
李圆圆 李倩 李丹丹 于晶

摘 要: 苔藓植物是园林绿化和园艺观赏的重要种类,在城市绿化和水族箱装饰市场上有良好的应用前景.在不同光照时长和温度条件下,对大灰藓(Hypnum plumaeforme Wilson.)、东亚泽藓(Philonotis turneriana (Schwgr.) Mitt.)、刺叶桧藓(Pyrrhobryum spiniforme (Hedw.) Mitt.)和美姿羽苔(Plagiochila pulcherrima Horik.)4种陆生苔藓植物在沉水环境中的水体适应能力进行了评估,同时研究了4种苔藓植物对模拟的不同水族箱水体条件的生理响应.研究结果表明这4种苔藓均适合生长在20 ℃左右的水环境中,其中大灰藓和刺叶桧藓适宜12 h以上全光照的水族环境,东亚泽藓和美姿羽苔需要24 h全光照的水族环境,该环境下4种苔藓的叶绿素含量均表现为明显上升,丙二醛和脯氨酸含量都无显著变化.
关键词: 陆生苔藓; 沉水环境; 生理指标; 水族应用
中图分类号: Q 945.3 文献标志码: A 文章编号: 1000-5137(2019)05-0581-10
Abstract: Bryophytes are important plant resources of landscaping and ornamental horticulture.They have good application prospects in urban greening and aquarium decoration market.We studied the water adaptability of four terrestrial bryophytes,including Hypnum plumaeforme Wilson., Philonotis turneriana (Schwgr.) Mitt.,Pyrrhobryum spiniforme (Hedw.) Mitt.and Plagiochila pulcherrima Horik.under different light duration and temperature conditions.At the same time,the physiological responses of the four bryophyte species on simulated aquarium water conditions were studied.The results showed that the four bryophyte species were suitable for growing in the water environment at about 20 ℃.Among them,H.plumaeforme and P.spiniforme were suitable for the aquarium environment with full light for more than 12 hours per day,and the aquarium environment with full light for 24 hours per day was needed for P.turneriana and P.pulcherrima.The chlorophyll content of the four species of bryophytes increased significantly,but the contents of malondialdehyde (MDA) and proline (Pro) did not change significantly in this environment.
Key words: terrestrial bryophyte; submerged environment; physiological index; aquarium applications
0 引 言
苔蘚植物是起源于泥盆纪的古老陆生生物种群之一,距今大约37亿年[1],是一类由水生向陆生过渡的、以孢子繁殖的高等植物[2].全世界有苔藓植物191科,1 230属,21200余种[3],在物种数量上仅次于被子植物,其分布十分广泛[4].苔藓植物是植物演替的“先锋植物”,是生态系统中重要的组成部分[5],在水土保持、维护生态系统等方面都有其独特地位[6].
城市自然环境问题很早就受到了关注,OKE[7]和STREUTKER[8]在研究中发现,因全球变暖,大部分城市温度逐渐升高,使得城市中的湿度、温度等环境因子也在变化.这些变化使得城市中植物的生境也发生了相应的改变,尤其是苔藓植物的分布及其群落生态结构,并在适应环境的过程中逐渐产生耐受性[9].
苔藓植物形态特殊,观赏性很强,是水族应用中重要的类群.在形态学上,苔藓植物与陆生的维管植物相比,无专门的吸收和输导组织,更类似于水生维管植物[10].从进化上,苔藓植物被认为是一类由水生向陆生过渡的植物类群,有可能现有的陆生苔藓植物更易引种栽培到水生环境[11].
世界上种植和欣赏水草的历史由来已久,能应用于水族箱培植的品种有很多.随着近年来水族产业的繁荣,中国观赏水草产业也逐渐发展起来,但中国本土观赏水草在水族箱中的应用品种很少,中国观赏水草研究起步较晚,大多要引进,“忽视本土,盲目引种”的观念普遍存在[12].目前市场上常见的多为水生苔藓植物,如匐灯藓属 (Plagiomnium T.J.Kop.)、灰藓属 (Hypnu Hedw.) 等耐湿性强的苔藓,常被种植在水族缸的“山石”、“瀑布”等周围,作为主景或点缀[13].中国有着非常丰富的水生苔藓资源,但人们却一直忽略了对水生观赏苔藓资源的研究和开发利用[3].
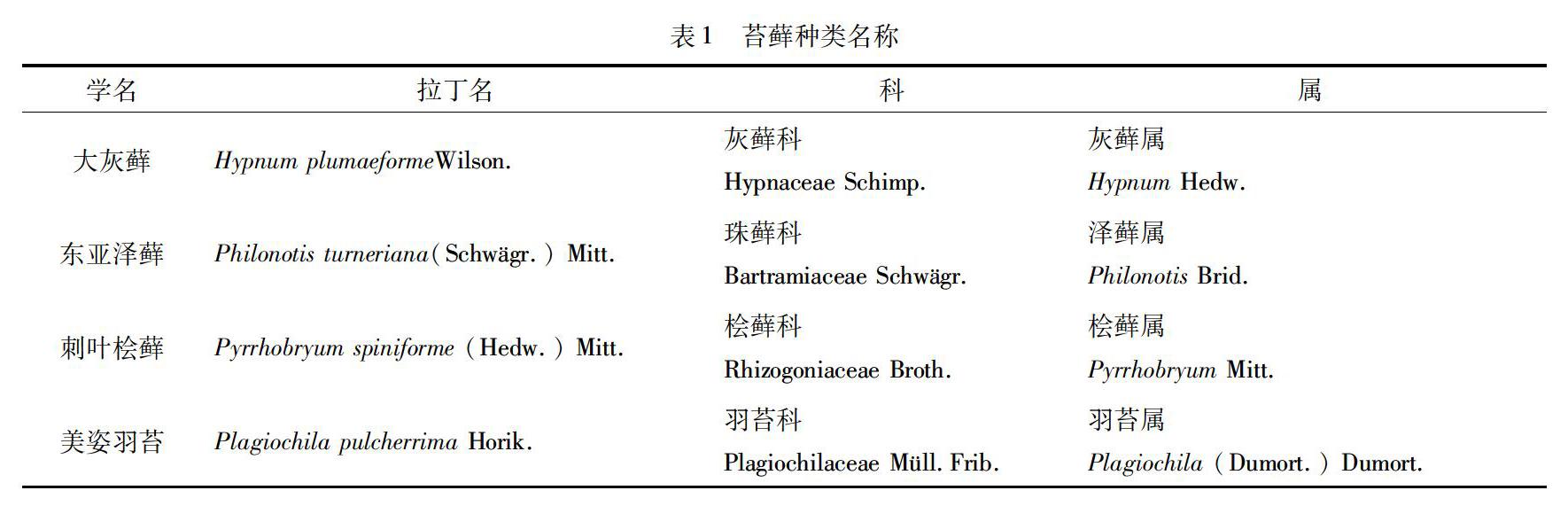
本文作者研究了大灰藓 (Hypnum plumaeforme Wilson.)、东亚泽藓 [Philonotis turneriana (Schwgr.) Mitt.]、刺葉桧藓 [Pyrrhobryum spiniforme(Hedw.)Mitt.]和美姿羽苔 (Plagiochila pulcherrima Horik.) 4种苔藓植物在不同光照时长和温度的水体条件下,叶绿素含量和细胞内生理生化指标方面的变化,探讨了苔藓植物对水体环境的适应能力.
1 实验材料与方法
1.1 实验材料
本实验材料于2012年3月,采自于苔藓资源丰富的浙江凤阳山(东经119°06′— 119°15′,北纬27°46′—27°58′),苔藓种类名称和植株照片分别如表1和图1所示.
1.2 实验方法
1.2.1 实验仪器与药品
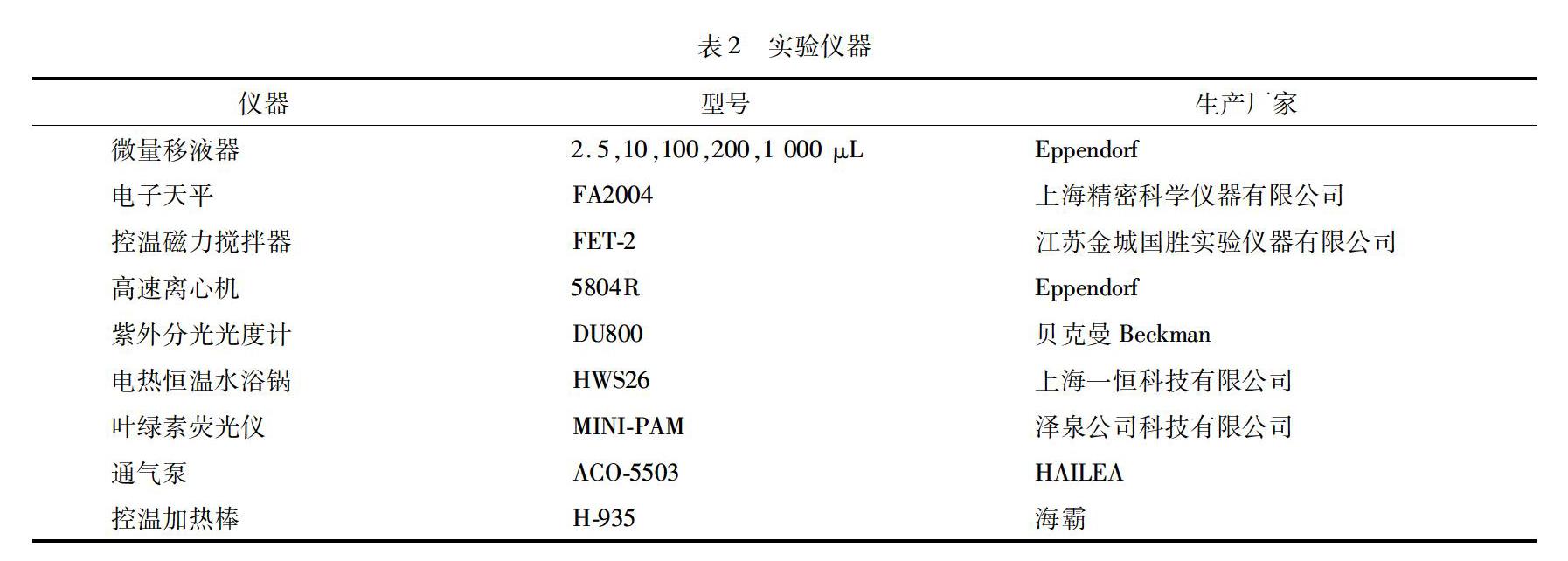
实验仪器(型号、生产厂商)如表2所示.
药品:95%(体积分数)酒精、石英砂、碳酸钙粉、蒸馏水、三氯乙酸、硫代巴比妥酸、氢氧化钠、冰醋酸、甲苯、酸性茚三酮、磺基水杨酸.
1.2.2 实验设计
1)将每种实验材料反复清洗后取长势一致的苔藓分别置于长30 cm、宽20 cm、高25 cm的透明玻璃水缸内,铺满底层,加入自来水至4/5缸体,若材料上浮,便用鱼线捆绑在铁丝网格上,并放入少量洗净的小石子使其沉在水底.材料在光照强度为3000~4000 lx的24 h光照、正常水体、室温下生长2周后,转至不同的水环境.
2) 水体温度对苔藓生长的影响:在正常水体环境、24 h全光照下(光照强度为3000~4000 lx),设定3组温度梯度,分别为10,20,30 ℃,用纯净冰块和加热棒调节温度.
3)光照条件对苔藓生长的影响:在正常室温和水体环境下,设定3组光照时长(光照强度为3000~4000 lx),分别为24 h全光照、12 h光照、6 h光照,用遮光布进行调节.
4)每隔1周取样测定叶绿素、丙二醛和脯氨酸含量,每种处理3次重复,实验周期为6周.其中叶绿素、丙二醛含量的测定参考了李合生等[14]的方法,脯氨酸含量的测定参考了张殿忠等[15]的“磺基水杨酸法”.
1.2.3 数据分析
利用Excel 2007和SPSS 22进行单因素方差分析和最小显著性差异法(LSD)分析,检验处理间的差异显著性.
2 结果与分析
2.1 不同水族箱环境对大灰藓生长的影响
2.1.1 光照长短对水体环境中大灰藓生理指标的影响
大灰藓在不同光照条件的水体环境下培养6周,其叶绿素、丙二醛和脯氨酸测定结果如图2~4所示.
由图2~4可知:当光照时长为6 h时,大灰藓的叶绿素含量在第2周有明显下降,丙二醛、脯氨酸的含量随大灰藓沉水培养时间延长有显著增长;当光照时长为12 h时,其叶绿素含量随培养时间延长有所下降,丙二醛和脯氨酸的含量无明显变化;当光照时长为24 h时,其叶绿素含量在第2周有所下降,之后又随培养时间延长出现缓慢上升,丙二醛、脯氨酸的含量均下降.由此可得出结论:光照时间的长短对沉水环境中大灰藓的生长有明显影响,要保证大灰藓的正常生长光照时长达到12 h以上.
2.1.2 温度对水体环境中大灰藓生理指标的影响
大灰藓在不同水温条件下培养6周后,其叶绿素、丙二醛和脯氨酸含量的测定结果如图5~7所示.
由图5~7可知:当水温为10 ℃时,大灰藓的叶绿素含量呈下降趋势,丙二醛和脯氨酸含量随培养时间延长无明显变化,可见大灰藓在10 ℃的水温下长势不良,光合能力受到限制;当水温为20 ℃时,其叶绿素含量在第3周呈现明显上升,丙二醛和脯氨酸含量在第6周时则下降,表明20 ℃的水温适于大灰藓的生长;而当水温为30 ℃时,其叶绿素含量在第2周就明显下降,丙二醛和脯氨酸的含量随着培养时间延长均增加,说明大灰藓的生长明显受到高温胁迫.
2.2 不同水族箱环境对东亚泽藓生长的影响
2.2.1 光照长短对水体环境中东亚泽藓生理指标的影响
东亚泽藓在不同光照条件的沉水环境下培养6周期间,其叶绿素、丙二醛和脯氨酸含量如图8~10所示.
由图8~10可知:在不同光照时长下东亚泽藓的叶绿素含量在第3周呈现显著差异;当光照时长为6 h和12 h时,其叶绿素含量明显下降,丙二醛含量则明显上升;当光照时长为6 h时,其脯氨酸含量在第6周时比对照有所上升,说明当光照时长为6 h和12 h时,东亚泽藓的生长明显受到抑制;24 h全光照条件下,其叶绿素含量随培养时间的延长明显上升,丙二醛含量无明显变化,脯氨酸含量则呈下降趋势.由此可知,对东亚泽藓,24 h全光照最适宜其生长.
2.2.2 温度对水体环境中东亚泽藓生理指标的影响
东亚泽藓在不同水温条件下培养6周后,其叶绿素、丙二醛和脯氨酸含量的测定结果如图11~13所示.
由图11~13可知:当水温为20 ℃时,东亚泽藓叶绿素含量在第3周开始明显上升,第6周达到最高,丙二醛含量无明显变化,脯氨酸含量明显下降;但当水温为10 ℃和30 ℃时,叶绿素含量呈下降趋势;当水温为30 ℃时,丙二醛和脯氨酸含量均增加;当水温为10 ℃时,其脯氨酸含量没有随培养时间延长呈现明显积累,但丙二醛含量也明显上升.由此可见,东亚泽藓的最适宜生长温度为20 ℃左右,温度过高或过低对其生长状况极为不利.
2.3 不同水族箱环境对刺叶桧藓生长的影响
2.3.1 光照长短对水体环境中刺叶桧藓生理指标的影响
刺叶桧藓在不同光照条件的沉水环境下培养6周后,其叶绿素、丙二醛和脯氨酸含量如图14~16所示.
由图14~16可知:当光照时长为6 h时,刺叶桧藓的叶绿素含量随培养时间延长呈现下降趋势,丙二醛和脯氨酸含量均有所增加;當光照时长为12 h时,其叶绿素含量没有随培养时间延长出现显著变化,丙二醛和脯氨酸含量则持续增长;当受到24 h全光照时,刺叶桧藓能在沉水环境中正常生长,其叶绿素含量随培养时间延长呈现显著上升趋势,丙二醛含量较对照组略有上升但脯氨酸含量出现缓慢下降.由此可知,刺叶桧藓在沉水环境中需光照时长保持在12 h以上才能正常生长.
2.3.2 温度对水体环境中刺叶桧藓生理指标的影响
刺叶桧藓在不同水温条件下培养6周后,其叶绿素、丙二醛和脯氨酸含量的测定结果如图17~19所示.
由图17~19可知:当水温为10 ℃时,在沉水环境中生长3周后,刺叶桧藓的叶绿素含量开始下降,丙二醛和脯氨酸含量在第6周时均有所上升;当水温为20 ℃时,其叶绿素含量从第3周开始呈显著上升趋势,第6周后,其丙二醛含量较对照有所增长,而脯氨酸含量没有显著变化;当水温为30 ℃时,其叶绿素含量随培养时间延长持续下降,丙二醛和脯氨酸含量随培养时间延长持续增长,说明在高温环境中刺叶桧藓明显受到胁迫.由此可知,刺叶桧藓的最适生长水温是20 ℃左右.
2.4 不同水族箱环境对美姿羽苔生长的影响
2.4.1 光照长短对水体环境中美姿羽苔生理指标的影响
美姿羽苔在不同光照条件的沉水环境下培养6周后,其叶绿素、丙二醛和脯氨酸含量如图20~22所示.
由图20~22图可知:当光照时长为6 h和12 h时,美姿羽苔的叶绿素含量随培养时间延长明显下降,丙二醛和脯氨酸含量随培养时间延长呈上升趋势;在24 h全光照条件下,第3周时其叶绿素含量达到最高,随后虽有所下降,但与对照相比,叶绿素含量依然有所增长.
2.4.1 温度对水体环境中美姿羽苔生理指标的影响
美姿羽苔在不同温度条件的沉水环境下培养6周后,其叶绿素、丙二醛和氨酸含量如图23~25所示.
由图23~25可知:当水温为10 ℃时,美姿羽苔的叶绿素含量随培养时间延长呈下降趋势,丙二醛含量无明显上升但脯氨酸含量呈缓慢上升的趋势;当水温为20 ℃时,叶绿素含量在第4周达到最大值,随后虽有下降,但与对照相比依然增长;当温度为30 ℃时,第2周后美姿羽苔的叶绿素含量便出现显著下降;丙二醛含量和脯氨酸含量则显著上升,说明高温对美姿羽苔产生了严重胁迫.
3 讨 论
通过对大灰藓、东亚泽藓、刺叶桧藓、美姿羽苔在不同水族箱环境下生长适应能力的研究,可以初步得出以下结论:
这4种苔藓均适合生长在20 ℃左右的水环境中,在高温下受到胁迫,低温环境也不利于其生长.在3种不同光照处理条件下,大灰藓、东亚泽藓和刺叶桧藓在光照时长为12 h时处于正常生长,且3种不同处理之间存在显著性差异(p<0.05).在20 ℃水温环境下,大灰藓的叶绿素含量明显上升,丙二醛和脯氨酸含量在第6周时出现下降;当光照时长为12 h时,其叶绿素含量有所下降,丙二醛和脯氨酸含量则无明显变化.东亚泽藓在24 h全光照条件和20 ℃水温环境下,其叶绿素含量明显上升,丙二醛含量无明显变化,脯氨酸含量呈下降趋势.刺叶桧藓要保持12 h以上的光照时长且在20 ℃左右的水温环境下,其叶绿素含量显著上升,丙二醛含量较对照有所增长,而脯氨酸含量无显著变化.美姿羽苔在24 h光照时长和20 ℃的水温环境下叶绿素含量达到最高,丙二醛和脯氨酸含量则无显著变化.
逆境下植物体内会产生大量的丙二醛,丙二醛是自由基作用于脂质发生过氧化反应的终产物,对植物体产生毒害作用[16].KUPPER等[17]发现重金属可以诱导植物体产生大量活性氧,其中超氧阴离子自由基会造成植物体内叶绿素含量下降、光合色素合成受阻,从而抑制光合作用[18-19].光合色素能客观反映植物光能利用率,可以作为判断植物环境胁迫状况的重要指标[19-21].叶绿素含量与植被的光合能力、发育阶段具有较好的相关性,它通常是光合作用能力和植被发育阶段(特别是衰老阶段)的指示器[22].植物体受到胁迫后叶绿素含量会受到严重影响.对于陆生植物来说,在水分胁迫过程中,叶绿素的含量往往下降[23].但是也有一些研究报道了某些植物(如复苏植物)在水分胁迫过程中其叶绿素含量并没有显著降低[24-25].水分胁迫还会加剧植物光合作用的光抑制[26-27],因此在逆境环境中叶绿体是最易受到破坏的细胞器之一,其结构的正常与否是判断植物细胞活性的一个重要指标[28].
脯氨酸是植物蛋白质的组成成分,在逆境条件下,植物为了防御伤害,维持正常的生理生化功能,植物体内游离脯氨酸含量就会大量积累[29].在干旱、盐渍、低温等胁迫条件下,植物体内脯氨酸含量的增加是植物对逆境胁迫的一种生理生化反应[9].本研究发现:脯氨酸的积累和丙二醛含量也具有明显的正相关,丙二醛大量增加时,表明体内细胞受到较严重的破坏[30],产生的丙二醛具有细胞毒性,会引起蛋白质、核酸等生命物质大分子的交联聚合,从而对植物产生毒害作用[31].而在水分胁迫下,苔藓植物中丙二醛含量随胁迫强度的增加而上升[32],随着水淹时间的延长,植物对不良环境的抵抗能力下降,保护酶的活性降低[33-34].植物体叶片组织多种酶活性降低,脯氨酸氧化受阻,造成逆境下植物叶片游离脯氨酸积累.因此,根据这些指标的变化能够了解苔藓植物对水体环境条件变化的适应能力.
参考文献:
[1] HECKMAN D S.Molecular evidence for the early colonization of land by fungi and plants [J].Science,2001,293(5532):1129-1133.
[2] 艾应伟,刘浩,李伟,等.苔藓植物资源保护利用中的生态环境效应研究进展 [J].生态环境学报,2010(1):227-232.
AI Y W,LIU H,LI W,et al.Advance in research on ecological and environmental effects on protection and utilization of bryophyte resources [J].Ecology and Environmental Science,2010(1):227-232.
[3] 曹同,郭水良,娄玉霞,等.苔藓植物多样性及其保护 [M].北京:中国林业出版社,2011.
CAO T,GUO S L,LOU Y X,et al.Bryophyte Diversity and Its Protection [M].Beijing:China Forestry Publishing House,2011.
[4] 朱瑞良,王幼芳,熊李虎.苔藓植物研究进展Ⅰ:我国苔藓植物研究现状与展望 [J].西北植物学报,2002,22(2):444-451.
ZHU R L,WANG Y F,XIONG L H.Progress in bryological research I:status and prospects of bryological research in China [J].Acta Botanica Boreali-Occidentalia Sinica,2002,22 (2):444-451.
[5] 蔡锦蓉.浙江舟山嵊泗列岛苔藓植物区系及地理分布研究 [D].上海:上海师范大学,2017.
CAI J R.Studies on flora and geographic distribution of bryophytes in Shengsi archipelago,Zhoushan,Zhejiang [D].Shanghai:Shanghai Normal University,2017.
[6] 汪岱华,王幼芳,左勤,等.浙江西天目山主要森林类型的苔藓多样性比较 [J].植物生态学报,2012(6):550-559.
WANG D H,WANG Y F,ZUO Q,et al.Bryophyte species diversity in seven typical forests of the West Tianmu Mountain in Zhejiang,China [J].Acta Phytoecologica Sinica,2012(6):550-559.
[7] OKE T R.Boundary layer climates [J].Earth Science Reviews,1987,27 (3):265-265.
[8] STREUTKER D R.Satellite-measured growth of the urban heat island of Houston,Texas [J].Remote Sensing of Environment,2003,85(3):282-289.
[9] 洪春桃.大灰藓的耐盐性研究 [D].杭州:浙江农林大学,2015.
HONG C T.Study on salt tolerance of Hypnum plumaeforme [D].Hangzhou:Zhejiang A&F University,2015.
[10] 臧程.浙江舟山岛及附近岛屿苔藓植物多样性和生物地理学研究 [D].上海:上海师范大学,2018.
ZANG C.Studies on flora and geographic distribution of bryophytes in Zhoushan Island and the nearby islands,Zhejiang Province [D].Shanghai:Shanghai Normal University,2018.
[11] TAKAKI N,WATANABE R,IWAT6UKI Z.Bryophytes in aquariums for tropical fish [J].Proceeding of the Bryological Society of Japan,1982,3(5):65-68.
[12] 张金锋.世界观赏水草产业现状与展望 [J].世界农业,2008(12):43-45.
ZHANG J F.Current development and prospect of the world ornamental aquatic plant industry [J].World Agriculture,2008 (12):43-45.
[13] 陈俊和,蔣明,张力.苔藓植物园林景观应用浅析 [J].广东园林,2010,32(1):31-34.
CHEN J H,JIANG M,ZHANG L.Application of bryophytes in landscaping [J].Guangdong Garden,2010,32 (1):31-34.
[14] 李合生,孙群,赵世杰.植物生理生化实验原理和技术 [M].北京:高等教育出版社,2000.
LI H S,SUN Q,ZHAO S J.Experimental Principle and Technique of Plant Physiology and Biochemistry [M].Beijing:Higher Education Press,2000.
[15] 张殿忠,汪沛洪,赵会贤.测定小麦叶片游离脯氨酸含量的方法 [J].植物生理学通讯,1990(4):62-65.
ZHANG D Z,WANG P H,ZHAO H X.Determination of the content of free proline in wheat leaves [J].Plant Physiology Communications,1990(4):62-65.
[16] 王焕校.污染生态学 [M].3版.北京:高等教育出版社,2012.
WANG H X.Pollution Ecology [M].3rd ed.Beijing:Higher Education Press,2012.
[17] KUPPER H,IVAN S,MARTIN S.Heavy metal-induced inhibition photosynthesis:targets of in vivo heavy metal chlorophyll formation [J].Journal of Phycology,2002,38(3):429-441.
[18] 邵晶,柴之芳,毛雪瑛,等.苔藓对大气沉降重金属元素富集作用的研究 [J].核化学与放射化学,2002,24(1):6-10.
SHAO J,CHAI Z F,MAO X Y,et al.Study on concentration of heavy metals deposited from atmosphere by mosses [J].Journal of Nuclear and Radiochemistry,2002,24 (1):6-10.
[19] 张光飞,段仲昭,罗晓娟,等.2种苔藓的叶绿素荧光特性及耐受性对Pb2+浓度的响应 [J].环境污染与防治,2011,33(1):36-40.
ZHANG G F,DUAN Z Z,LUO X J,et al.Response of chlorophyll fluorescence characteristics and tolerance of two moss species to Pb2+ concentration [J].Environmental Pollution and Prevention and Control,2011,33(1):36-40.
[20] MARTINEZ-ABAIGAR J,NUNEZ-OLIVERA E,SANCHEZ-DIAZ M.Seasonal changes in photosynthetic pigment composition of aquatic bryophytes [J].Transactions of the British Bryological Society,1994,18(1):97-113.
[21] BARSIG M,KATHRIN S,CAROLA G.Effects of UV-B radiation on fine structure,carbohydrates,and pigments in polytrichum commune [J].Bryologist,1998,101(3):357-365.
[22] MARTINEZ-ABAIGAR J,NUNEZ-OLIVERA E,SANCHEZ-DIAZ M.Effects of organic pollution on transplanted aquatic bryophytes [J].Journal of Bryology,1993,17(4):553-566.
[23] 黎修东,骆华容,莫惠芝,等.不同水分条件下3种苔藓植物的生理响应 [J].江西农业学报,2018,30(4):39-43.
LI X D,LUO H R,MO H Z,et al.Physiological response of three species of bryophytes to different moisture conditions [J].Acta Agriculturae Jiangxi,2018,30(4):39-43.
[24] ALBERTE R S,THORNBER J P.Water stress effects on the content and organization of chlorophyll in mesophyll and bundle sheath chloroplasts of maize [J].Plant Physiology,1977,59(3):351-353.
[25] 邓馨,胡志昂,王洪新,等.脱水和复水对复苏植物牛耳草离体叶片光合作用的影响 [J].植物学报,2000,42(3):321-323.
DENG X,HU Z A,WANG H X,et al.Effects of dehydration and rehydration on photosynthesis of detached leaves of the resurrective plant Boea hygrometrica [J].Acta Botanica Sinica,2000,42(3):321-323.
[26] 陽文龙,胡志昂,王洪新,等.更苏被子植物的光合作用 [J].植物学报,2003,45(5):505-508.
YANG W L,HU Z A,WANG H X,et al.Photosynthesis of resurrection angiosperms [J].Acta Botanica Sinica,2003,45(5):505-508.
[27] POWLES B S.Photoinhibition of photosynthesis induced by visible light [J].Annual Review Plant Physiology,1984,35(1):15-44.
[28] DEMMIG-ADAMS B,III W W A.Carotenoid composition in sun and shade leaves of plants with different life forms [J].Plant Cell and Environment,1992,15(4):411-419.
[29] 汪贵斌,景茂.水分胁迫对银杏叶片叶肉细胞超微结构的影响 [J].南京林业大学学报(自然科学版),2008,32(5):65-70.
WANG G B,JING M.The effect of water stress on mesophyll cell ultrastructure of Ginkgo [J].Journal of Nanjing Forestry University (Natural Science Edition),2008,32(5):65-70.
[30] 湯章城.逆境条件下植物脯氨酸的累积及其可能的意义 [J].植物生理学通讯,1984(1):17-23.
TANG Z C.The accumulation of proline in plants under stress and its possible significance [J].Plant Physiology Communications,1984(1):17-23.
[31] 张怡,罗晓芳,沈应柏.土壤逐渐干旱过程中刺槐新品种苗木抗氧化系统的动态变化 [J].浙江林学院学报,2005,22(2):166-169.
ZHANG Y,LUO X F,SHEN Y B.Dynamic changes of anti-oxidation system in new cultvars of Robinia pseudoacacia under gradual drought stress of soil [J].Journal of Zhejiang Forestry College,2005,22(2):166.
[32] 谭淑端,朱明勇,张克荣,等.植物对水淹胁迫的响应与适应 [J].生态学杂志,2009,28(9):1871-1877.
TAN S D,ZHU M Y,ZHANG K R,et al.Response and adaptation of plants to submergence stress [J].Chinese Journal of Ecology,2009,28(9):1871-1877.
[33] DHINDSA R S,MATOWE W.Drought tolerance in two mosses:correlated with enzymatic defense against lipid peroxidation [J].Journal of Experimental Botany,1981,32(1):79-91.
[34] 谭淑端,朱明勇,张克荣,等.水淹对双穗雀稗抗氧化酶活性及碳水化合物含量的影响 [J].草业学报,2013,22(1):217-224.
TAN S D,ZHU M Y,ZHANG K R,et al.Effects of submergence on the antioxidative enzymes and carbohydrate contents of Paspalum distichum [J].Acta Prataculturae Sinica,2013,22(1):217-224.
[35] 郑园园.陆生苔藓植物对水体环境适应的光合生理基础及其在水环境监测中的应用 [D].上海:上海师范大学,2010.
ZHENG Y Y.The photosynthetic physiology of the terrestrial bryophytes and the application of their monitoring in the water [D].Shanghai:Shanghai Normal University,2010.
(责任编辑:顾浩然)
