硫化氢对白桦悬浮细胞硫氮代谢的影响
2019-12-13王海燕范桂枝张李香
王海燕,菅 端,范桂枝,张李香
(1.黑龙江大学 农业资源与环境学院,黑龙江 哈尔滨 150080;2.东北林业大学 生命科学学院,黑龙江 哈尔滨 150000)
硫化氢(hydrogen sulfide,H2S)是一种带有臭鸡蛋味的气体,是继一氧化氮(NO)和一氧化碳(CO)之后发现的第3 种气体信号分子[1]。H2S 在动物方面的研究较为深入,而在植物中的研究才刚刚起步。在植物中H2S 的主要合成酶为半胱氨酸脱巯基酶,在L-或D-半胱氨酸脱巯基酶(磷酸吡哆盐依赖性酶)的作用下催化半胱氨酸降解成H2S、丙酮酸盐和NH4[2]。近年来的研究发现,H2S 可以促进种子的萌发,根器官的发生,光合作用的增强,调节花的衰老过程和气孔运动过程[3-6];H2S 提高了植物处于非生物胁迫下的耐性[7],植物在干旱、高盐与重金属胁迫下的响应都受到H2S 的调节[8-11]。由此可见,H2S 在调节植物生长发育以及植物抵御环境胁迫方面的研究取得了一定进展。
H2S 是硫代谢的中间产物之一,植物在硫素充足的状态下可以释放H2S。H2S 还可以调控硫代谢相关物质的含量,如H2S 供体(NaHS)处理上调了半胱氨酸,谷胱甘肽和内源H2S 水平,同时上调了O-乙酰-丝氨酸巯基裂合酶与L-半胱氨酸脱巯基酶活性[12]。H2S 与NO 在许多生理过程中都有着相互作用,Wang 等的研究表明,外源施加H2S 促进种子萌发的现象与产生的NO 相关[13],H2S 是否也与氮代谢相关还有待考证。
本研究将不同浓度的外源H2S 供体NaHS 添加到白桦Betula platyphylla悬浮培养体系中,分析不同浓度的H2S 供体对白桦悬浮细胞体系的pH 值、电导率、丙二醛含量、超氧阴离子含量、硫代谢和氮代谢的影响,为揭示外源H2S 对植物细胞生理代谢的影响提供参考依据。
1 材料与方法
1.1 白桦悬浮细胞系的培养
产白桦酯醇的白桦悬浮细胞系由东北林业森林生物工程研究室选育。悬浮细胞的培养基为B5 附加0.1 mg·L-16-benzyladenine(6-BA)和0.01 mg·L-1thidiazuron(TDZ)以及20 g·L-1蔗糖,灭菌前调pH 至5.5~ 6.0。100 mL 摇瓶中盛50 mL 培养液,每瓶接种6 g 愈伤组织,培养温度为25~ 27℃,光照强度为2 000 lx,光照16 h·d-1,摇床转速为120 r·min-1。实验中所用的白桦悬浮细胞已经过50~ 60 次继代培养,具有稳定的形态特征和生长速率。
1.2 外源H2S 供体的添加
将0 mmol·L-1(CK,无菌水),0.5 mmol·L-1,1 mmol·L-1,5 mmol·L-1无菌的NaHS(分析纯)溶液添加到培养8 d 的白桦悬浮培养体系中,在处理后0~ 5 d 取样分别测定白桦悬浮细胞培养液pH 值、电导率,白桦悬浮细胞中丙二醛(MDA)含量、超氧阴离子含量,ATP 硫酸化酶(ATPS)活性及谷胱甘肽(GSH)含量等硫代谢相关指标,铵态氮、硝态氮含量及硝酸还原酶(NR)与谷氨酸合成酶(GS)的活性等氮代谢相关指标。对照加入等体积的无菌水,每种处理重复3 次。添加的NaHS 溶液采用无菌的0.45 μm 微孔滤膜进行过滤除菌。
1.3 测定方法
使用pH 计与电导仪(昆明市雷兹电导率仪厂)测定pH 值与电导率。MDA 含量测定采用硫代巴比妥酸比色法[14]。超氧阴离子测定采用羟胺氧化法[15]。硫代谢相关生理指标测定参照高吉霞[16]的方法,谷胱甘肽使用南京建成试剂盒测定。氮代谢相关生理指标测定参照王媛媛[17]的方法,铵态氮测定方法使用水杨酸-次氯酸盐分光光度法[18]。
测定ATPS 使用磷酸根做标准曲线,回归方程为:y=0.089 1x+0.001 4,R2=0.997 8。
硝态氮标准曲线为:y=7.987 9x+0.061 6,R2=0.999 9。
铵态氮标准曲线为:y=0.157 1x+0.012 7,R2=0.997 8。
NR 的标准曲线为:y=0.013 5x+0.002 8,R2=0.999 3。
1.4 数据处理
每个处理重复3 次,应用Excel 和SPSS 软件进行相关数据处理。
2 结果与分析
2.1 NaHS 处理对白桦悬浮细胞培养液pH 值和电导率的影响
NaHS 处理对白桦悬浮培养液pH 值和电导率的影响如图1 所示,1 mmol·L-1NaHS 处理第2 天、5 mmol·L-1NaHS 处理第1 天、第4 天和第5 天的pH 值显著高于CK(P<0.05);5 mmol·L-1NaHS 处理第1 天、第2 天、第4 天和第5 天时的电导率值显著高于CK(P<0.05)。另外,5 mmol·L-1NaHS 处理第3 天时pH 值和电导率虽均高于CK,但与CK 的差异均未达到显著水平。由此可见,pH 值和电导率对NaHS 处理的响应存在浓度和时间效应。

图1 NaHS 处理对白桦悬浮细胞培养液pH 值和电导率的影响Figure 1 Effect of NaHS on pH and electrical conductivity in cell suspension culture of B.platyphylla
2.2 NaHS 处理对白桦悬浮细胞MDA 和超氧阴离子含量的影响
如图2A 所示,与同期CK 相比,1 mmol·L-1和5 mmol·L-1NaHS 均对MDA 含量产生显著影响(P<0.05),其中5 mmol·L-1NaHS 处理后,MDA 含量呈上升的趋势,而0.5 mmol·L-1NaHS 处理,仅在处理的4~ 5 d 时差异达显著水平(P<0.05),呈降低趋势;细胞内的超氧阴离子对NaHS 处理的响应趋势为,处理0~ 2 d 时差异未达到显著水平,处理3~ 5 d 差异均达到显著水平(P<0.05),且一直呈上升趋势(图2B)。

图2 NaHS 处理对白桦悬浮细胞中MDA 和超氧阴离子含量的影响Figure 2 Effect of NaHS on MDA and O2-in cell suspension culture of B.platyphylla
2.3 NaHS 处理对白桦悬浮细胞中ATPS 活性与GSH 的影响
如图3 所示,ATPS 的活性总体呈现下降的趋势。处理组的ATPS 活性总体高于CK,在处理处理浓度为0.5 mmol·L-1与1 mmol·L-1时,ATPS 的活性出现了先上升后下降的结果,在0.5 mmol·L-1与1 mmol·L-1NaHS 处理后2 d,ATPS 的活性达到极值,分别比CK 显著增高了24%与22%(图3A)。除第5 天外,随着NaHS 处理浓度的增高,GSH 含量也呈增加趋势。其中5 mmol·L-1NaHS 处理后0 d 达到了峰值,比CK 显著增高117.87%(图3B)。
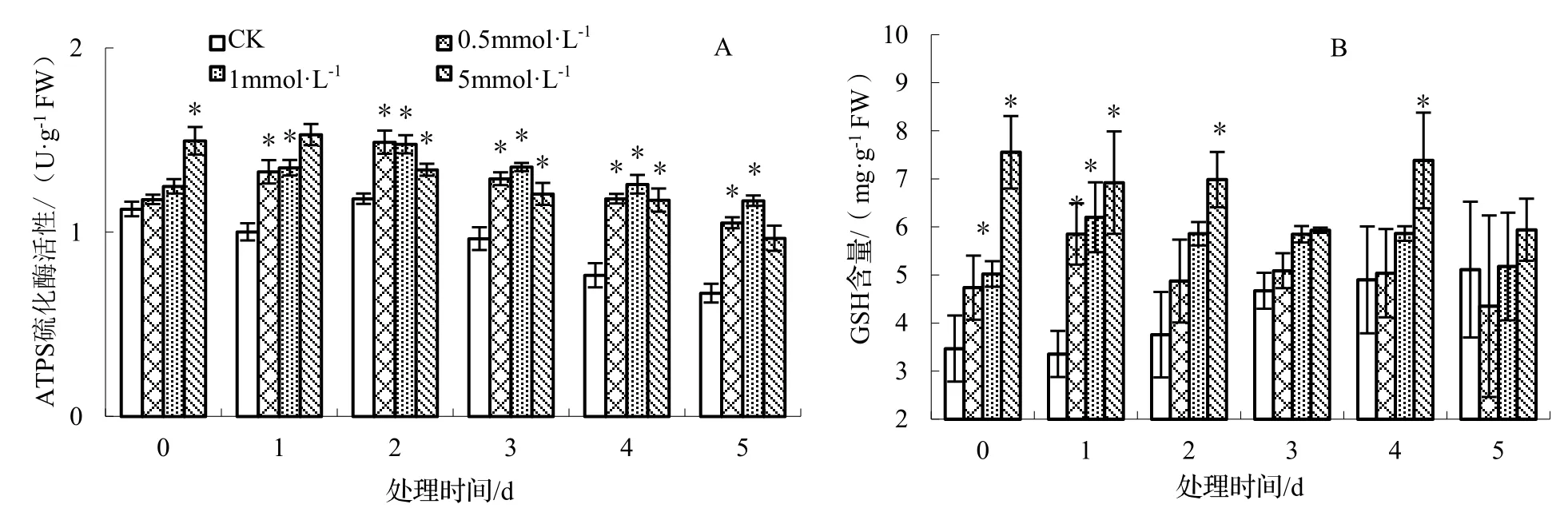
图3 NaHS 对白桦悬浮细胞内ATPS 活性与GSH 含量的影响Figure 3 Effect of NaHS on the activity of ATPS and the content of GSH in cell suspension culture of B.platyphylla
2.4 H2S 处理对白桦悬浮细胞硝铵态氮、NR 与GS 的影响
如图4A 所示,不同浓度的NaHS 处理后第0 天,第1 天和第5 天均增加了硝态氮含量,而在第2 天至第4天变化趋势不同。其中5 mmol·L-1NaHS 处理第4 天时 达到最高值,比对照显著增加了32.1%;图4B 所示,不同浓度NaHS 处理0~ 5 d 均显著增加了铵态氮含量,其中5 mmol·L-1NaHS 处理第5 天达到峰值,比CK 显著增加了801.9%;图4C 所示,0.5 mmol·L-1NaHS 处理0~ 5 d 均未对NR 活性产生显著影响,而1 和5 mmol·L-1NaHS 处理增加了NR 活性(除第4 天外)。其中1 mmol·L-1NaHS 处理第2 天达到峰值,比CK 显著增加了53.0%;图4D 所示,除第0 d 外,1 和5 mmol·L-1NaHS 处理未对GS 活性产生显著影响,虽然1 mmol·L-1NaHS 第5 天达到最高值,但与对照相比未达到显著差异水平。

图4 NaHS 对白桦悬浮细胞内硝态氮、铵态氮含量及对NR、GS 活性的影响Figure 4 Effect of NaHS on the content of nitrate nitrogen and ammonium nitrogen,the activity of NR and GS in cell suspension culture of B.platyphylla
3 结论与讨论
无机态的硫素进入植物后的第一步反应就是在ATPS 的激活作用下生成磷酸腺苷(APS),ATPS 是无机硫素进入植物体后的第一个硫代谢相关酶。而在硫代谢中H2S 是半胱氨酸合成中重要的中间产物,H2S 进一步被还原为半胱氨酸,半胱氨酸进一步合成GSH 或蛋白[19]。王紫晴等的研究表明,H2S 处理提高了白桦悬浮细胞中多胺和次生代谢物含量,H2S 与多胺共同处理可进一步促进次生代谢物的累积[20]。Miginiac-Maslow 等发现最适浓度H2S 处理后,菠菜的GSH 含量增加[21]。同时发现,拟南芥中的乙烯与NO 参与下调H2S 水平[22],H2S 诱导的气孔开闭过程中,有NO 的积累[23]。H2S 对硫代谢和氮代谢的影响还未见详细报道。
本研究发现,电导率、MDA 含量与超氧阴离子等对NaHS 处理的响应存在浓度和时间效应,0.5 mmol·L-1NaHS 处理未对白桦悬浮细胞产生显著响应,随着处理浓度的增加呈增加趋势。可见,0.5~1.0 mmol·L-1低浓度NaHS 未对白桦悬浮细胞造成伤害,浓度大于1 mmol·L-1将对白桦悬浮细胞产生不同程度的伤害,表现为超氧阴离子浓度增加,有机物外渗等。相同处理下,不同浓度的NaHS 处理增加了ATPS 活性、GSH 含量、硝态氮含量、氨态氮含量以及NR 与GS 活性。由此可见,NaHS 处理可以改变白桦悬浮细胞中的硫代谢和氮代谢。
综上还可知,H2S 不仅可以促进白桦悬浮细胞的硫、氮代谢,并且在0.5 mmol·L-1NaHS 处理下对硫氮代谢的促进作用最强。同时发现,NaHS 促进了下游的GSH 与半胱氨酸的形成,中间产物的减少又促进了硫素的还原。另外,H2S 对白桦悬浮细胞的硫、氮代谢的影响趋势基本相同,二者可能存在正相关关系。同时推测H2S与NO 的相互关系影响了氮代谢水平,但还需要进一步实验验证。
