蒸汽爆破预处理对樟芝液体培养的影响
2019-12-13沈宇健景思佳
沈宇健,张 蕾,景思佳,刘 洋,张 帆
(1.浙江科技学院 生物与化学工程学院生物工程系,浙江 杭州 310023;2.浙江省农业生物资源生化制造协同创新中心,浙江 杭州 310023;3.浙江省农产品化学与生物加工技术重点实验室,浙江 杭州 310023;4.杭州市园林科学研究院,浙江 杭州 310013)
樟芝Ganoderma camphoratum是台湾地区特有珍贵食(药)真菌。近年已证实的具有保肝、抗氧化、抗发炎、抗肿瘤、抗血小板凝集等作用[1-10],其中主要生物活性成分有三萜类化合物,多糖、腺苷等[11]。但樟芝的自然生长条件苛刻,生长极为缓慢,再加上野生牛樟树Cinnamomum kanehirai老树更是罕见,导致其自然资源严重短缺,价格一路飙升,因此人工培养樟芝是未来发展的方向,只是不同的培养方法都有缺陷[12]。目前认为椴木培养法所获得的樟芝子实体功效最佳,该方法用樟芝原特有宿主牛樟树椴木为培养基,可获得与野生子实体相同的生物活性成分,尤其是三萜类化合物,但其存在培养时间长达1~ 3 a、培养成本较高,且发展樟芝的椴木培养法成为了牛樟树被盗伐的主要原因,也让原本就稀少的牛樟树到了濒临绝种的地步[13-14]。虽然樟芝仍无法以椴木方式大量栽培子实体,但已可用固体及液体菌种培养方式进行工业化生产樟芝菌丝体。固体菌种培养法获得的子实体具有与野生樟芝更为接近的生物活性,培养时间约3 个月[15],但是此方法面临不能去除木屑及其他不可食用部分、产量少,且周期长,不太适宜工业化生产。液体培养具有生长周期短、成本低、易于大规模生产的优点,但仍然存在生物活性含量较低的问题,所以有关如何提高樟芝液体培养生物活性产物的研究报道就一直层现叠出。
本实验前期通过添加牛樟树C.kanehirai,黄樟C.porrectum,华南桂C.austrosinense,樟C.camphora,山橿Lindera reflexa,香桂C.subavenium,银木C.septentrionale,猴樟C.bodinieri,兰屿肉桂C.kotoense,浙江桂C.chekiangense,天竺桂C.japonicum,新木姜子Neolitsea aurata共12 种樟科Lauraceae 植物的提取物对樟芝液体培养基进行优化,结果表明猴樟水提物对樟芝液体培养具有很好的促进作用。但提取主要分布在樟科植物纤维内侧的活性成分,就必须克服表皮、纤维层,以及细胞壁的传质阻力,特别是结构致密的细胞壁,是提取活性成分的主要障碍,现行的化学浸提等方法的效率不高且容易对人体有害[16]。因此迫切需要一种预处理方法,即可提高得率、缩短时间、且成本低对环境无害。经济、环保、处理时间短且易于大规模生产的蒸汽爆破[17-20](以下简称汽爆)预处理法是近年来逐渐发展起来的一种方法,使用一定压力的水蒸气、空气等介质对植物进行爆破,此技术已广泛应用于制浆工业、动物饲料的生产,根据徐红关于蒸汽爆破预处理红柳Tamarix ramosissima的酶解发酵性能研究[18],降低蒸汽压力而延长维压时间对提取效果更好,因此汽爆技术在对樟科植物的预处理中具有一定的可行性。本实验在汽爆压力为2.00 MPa 的条件下,选择7 个维压时间来分析汽爆对于猴樟树枝水提物的影响,以期优化樟芝液体培养的工艺。
1 材料与方法
1.1 材料
1.1.1 菌种 樟芝,2012 年从台湾自然科学博物馆引进,在浙江省农产品化学与生物加工技术重点实验室采用超低温保藏法-80℃低温保藏。
1.1.2 植物材料 2016 年10 月和2017 年10 月分别在杭州植物园采集树龄10 a 以上的猴樟树枝,由于樟芝仅生长在牛樟树腐朽之心材内壁或枯死倒地的牛樟木之阴暗潮湿面,故使用高枝剪剪取同一株树的老枝,使用粉碎仪进行粉碎至小碎片,粉碎后的总树枝量在720.00 g 以上。
1.1.3 试剂 马铃薯葡萄糖琼脂培养基(PDA)、马铃薯葡萄糖肉汤培养基(PDB)、樟脑油、95%乙醇、齐墩果酸标准品、葡萄糖标准品、高氯酸、冰醋酸、香兰素、香草醛、二氯甲烷、浓硫酸、蒽酮,均购自浙江常青化工有限公司,其中试剂类为国产分析纯或化学纯。
1.1.4 试剂配制 0.80 mol·L-1重铬酸钾标准溶液:基准重铬酸钾39.25 g·L-1;0.20 mol·L-1硫酸亚铁溶液:硫酸亚铁56.00 g·L-1,浓硫酸15.00 mL;邻啡罗啉指示剂:邻二氮菲11.46 g·L-1,硫酸亚铁6.95 g·L-1;1.00%醋酸溶液:36.00%乙酸1.00 mL;72.00%硫酸溶液:98.00%硫酸652.00 mL;10.00%氯化钡溶液:氯化钡100.00 g·L-1;10.00%硫酸溶液:98.00%硫酸593.40 mL;20.00%碘化钾溶液:碘化钾200.00 g·L-1;1.00%淀粉溶液:淀粉10.00 g·L-1;0.20 mol·L-1硫代硫酸钠溶液:硫代硫酸钠49.60 g·L-1,碳酸钠0.50 g;0.10 mol·L-1硫代硫酸钠溶液:硫代硫酸钠24.80 g·L-1,碳酸钠0.50 g;以上试剂配制的溶液均为去离子水。乙醇、乙醚混合液:乙醚 1.00 mL,乙醇 20.00 mL;醋酸、硝酸混合液:醋酸5.00 mL,硝酸5.00 mL。
1.1.5 培养基 菌种活化培养基:PDA 39.00 g·L-1,葡萄糖10.00 g·L-1,琼脂10.00 g·L-1,pH 自然;液体一级培养基:PDB 24.00 g·L-1,葡萄糖10.00 g·L-1,pH 自然;液体二级培养基:PDB 24.00 g·L-1,葡萄糖10.00 g·L-1,pH 自然。
1.1.6 主要仪器 QBS-80 汽爆试验台,鹤壁正道生物能源有限公司;紫外分光光度计UV-5500PC,上海元析仪器有限公司;EYELA 旋转蒸发仪,上海爱朗仪器有限公司;真空冷冻干燥仪,宁波新芝生物科技股份有限公司;高效液相色谱仪,美国waters 公司;无菌操作台,苏州佳宝净化工程设计有限公司。
1.2 方法
1.2.1 汽爆处理 将粉碎并放置于烘箱50℃烘干至恒质量后的猴樟树枝进行汽爆,每次投料量为90.00 g 左右,加热介质为150~ 180℃饱和水蒸汽,汽爆压力为2.00 MPa,按120,180,240,300,360,420,480 s 共7 个维压时间分7 个实验组,汽爆后,再放置于烘箱50℃烘干,干燥保存,对照组为同样放置于烘箱50℃烘干至恒质量但未汽爆的猴樟,共8 个组。
1.2.2 树枝提取物制备 将8 个组的猴樟,各取16.00 g 分别加入400.00 mL 的去离子水中,100℃水浴1 h,过滤,再将滤渣加入400.00 mL 的去离子水,100℃水浴1 h,过滤后将2 次滤液合并,真空冷冻干燥后,保存在4℃的冰箱内备用。
1.2.3 扫描电镜 8 个组各取一小片烘干后的猴樟,用黑色导电胶固定于玻片上,放入仪器进行扫描。
1.2.4 碳元素的测定 8 个组各取0.010 g 的样品放入硬管,加5.00 mL 重铬酸钾标准溶液和5.00 mL 浓硫酸并转移至试管。油浴加热,油浴温度为170~ 180℃,保持溶液沸腾5 min。取出并冷却后进行滴定,指示剂为邻啡罗啉,滴定液为硫酸亚铁溶液,滴定终点为溶液从橙黄变到棕红色时。同时以加0.10~ 0.50 g 的石英砂作为空白对照进行空白滴定,记录硫酸亚铁的用量(V0),并以重量法测定样品水分,根据公式(1)计算出含碳量。每组样品设3 个重复。

式中,0.800 0 为1/6 重铬酸钾标准溶液的浓度,mol·L-1;0.003 为1/4 碳原子的摩尔质量,g·mol-1;1.1 为氧化校正系数;V0为空白滴定用去硫酸亚铁溶液的体积,mL;V为滴定试样用去硫酸亚铁溶液的体积,mL;m为风干试样质量,g;K为将风干试样换算成烘干试样的水分换算系数。
1.2.5 氮元素的测定 8 个组各称取1.00~ 2.00 g 的样品,放入装有10.00 mL 硝酸、20.00 mL 浓硫酸的消化管,加入0.20 g 硫酸铜和6.00 g 硫酸钾,进行消化并升温:140℃维持30 min,320℃维持10 min,420℃维持40 min。然后使用凯氏测氮仪测定含氮量[21]。每组样品设3 个重复。
1.2.6 木质素的测定 8 个组各称取 0.050 g 的样品于离心管中,加入1%的醋酸溶液10.00 mL,离心15 min。加3.00~ 4.00 mL 乙醇、乙醚混合液,浸泡3 min,弃去上清液,浸洗3 次。沉淀于100℃水浴蒸干,加入72%硫酸3.00 mL,静置16 h。加入10.00 mL 蒸馏水,100℃水浴5 min,冷却。加入5.00 mL 蒸馏水和10%的氯化钡溶液0.50 mL,离心15 min。沉淀用蒸馏水冲洗2 次,加入10%的硫酸10.00 mL 和0.025 mol·L-1的重铬酸钾溶液10.00 mL,100℃水浴15 min,并搅拌。冷却并进行滴定,指示剂为5.00 mL 20%的碘化钾溶液,滴定液为0.20 mol·L-1硫代硫酸钠,滴定终点为溶液变为棕红色时。滴定结束后,再加入1.00 mL 1%的淀粉溶液作为指示剂,滴定液仍为0.20 mol·L-1硫代硫酸钠,滴定终点为溶液从蓝色变为亮绿色时。同时以未加样品,加入10%的硫酸10.00 mL 和0.025 mol·L-1的重铬酸钾溶液10.00 mL 作为空白对照进行空白滴定作为验证。根据公式(2)计算木质素含量。每组样品设3 个重复。

式中,K为硫代硫酸钠的浓度,mol·L-1;a为空白滴定所消耗硫代硫酸钠的体积,mL;b为溶液所消耗硫代硫酸钠的体积,mL;N为所取锯末的质量,g;48 为1 mol C6H10O5相当于硫代硫酸钠(一定浓度)的滴定度。
1.2.7 纤维素的测定 8 个组各称取0.10 g 的样品于试管中,加入5.00 mL 醋酸、硝酸混合液,100℃水浴30 min,转移至离心管,加去离子水,冷却并离心15 min,弃去上清液,离心3 次,烘干。取烘干样加入0.50 mol·L-1的重铬酸钾溶液10.00 mL 和浓硫酸8.00 mL,摇匀,100℃水浴15 min,冷却并进行滴定,指示剂为20%的碘化钾溶液5.00 mL,滴定液为0.10 mol·L-1硫代硫酸钠,滴定终点为溶液变为蓝色,且半分钟内不褪色,再以未加样品作为空白对照进行空白滴定。根据公式(3)计算纤维素含量。每组样品设3 个重复。

式中,K为硫代硫酸钠浓度,mol·L-1;a为空白滴定所耗硫代硫酸钠体积,mL;b为溶液滴定所耗硫代硫酸钠体积,mL;N为样品的质量,g。
1.2.8 菌株培养
1.2.8.1 活化菌株 对低温保存的菌株采用菌种活化培养基的方式进行活化。把配制好的菌种活化培养基放入灭菌锅内,在121℃,0.10 MPa 的条件下灭菌20 min,取出培养基并冷却至室温,在无菌条件下,将菌株接入培养基,置于人工智能气候箱,28℃避光培养15 d,于-4℃冰箱冷藏保存备用。
1.2.8.2 液体一级培养 分别将配制好的100.00 mL 液体一级培养基放入250.00 mL 的锥形瓶中,分别添加8 个组的猴樟水提物各40.00 mg,在121℃,0.1 MPa 的条件下灭菌20 min,取出培养基并冷却至室温;在无菌条件下接入活化好的菌种,转接量为每瓶2 粒(2×1 cm2),并封口。置于摇床(120 r·min-1,28℃)震荡培养4d,促进菌丝体的生长。每组样品设3 个重复。
1.2.8.3 液体二级培养 分别将配制好的100.00 mL 液体二级培养基放入250.00 mL 的锥形瓶中,并在二级培养基中分别添加8 个组的猴樟水提物各40.00 mg,在121℃,0.10 MPa 的条件下灭菌20 min,取出培养基并冷却至室温;在无菌条件下接入培养4 天后的一级培养液,转接量为二级培养基的10%,置于摇床(120 r·min-1,28℃)震荡培养4 d,进行菌丝体的扩大培养。每个样品设3 个重复。
1.2.9 生物量的测定 取二级液体培养基中的发酵液,用3 层200 目的尼龙网过滤,得到菌丝体,用蒸馏水冲洗菌丝体3 次后,置于真空冷冻干燥机中冷冻干燥后,研磨成粉,分别测定樟芝菌丝体粉末的干重,保存备用。
1.2.10 总三萜含量测定 取实验组培养基与对照组培养基上生长并过滤冷冻干燥后的樟芝菌丝体,研磨成粉,测定总三萜的含量。参照陆震鸣等[22]的方法,以齐墩果酸为标准品,采用香草醛-冰乙酸显色法测定。测定前,采用紫外分光光度计于400~ 700 nm 波长处进行全波长扫描,结果显示在550 nm 处具有最大吸光值,所以该反应的吸收波长设定为550 nm。
齐墩果酸标准品溶液:精确称取齐墩果酸10.00 mg,置于50.00 mL 容量瓶,加二氯甲烷定容至刻度,配制成浓度为0.20 mg·mL-1的标准溶液。
齐墩果酸标准曲线的绘制:精确量取浓度为0.20 mg·mL-1的齐墩果酸标准品溶液0.00,0.10,0.20,0.50,1.00,1.50 mL,分别放入具塞磨口试管中,加热去除溶剂,然后各加入0.30 mL 的5%香草醛—冰醋酸溶液和1.00 mL 高氯酸,加塞。于60℃恒温水浴20 min,取出后立即用冰水冷却,再分别加入5.00 mL 冰醋酸,在漩涡混合器混合均匀,在550 nm 处测定吸光度值。以吸光度值为纵坐标,齐墩果酸浓度为横坐标绘制标准曲线。
样品溶液及总三萜测定:取樟芝菌丝体粉末0.10 g 于10.00 mL 的蒸馏水中,于100℃水浴回流2 h,冷却后以1:4 的比例加入无水乙醇,置于4℃沉淀过夜,抽滤,取其滤液各1.00 mL,置于3 个磨口试管中,加热蒸干溶剂,按照绘制标准曲线的方法测定吸光度值,计算不同培养基樟芝菌丝体中总三萜含量。根据下式计算总三萜得率:

式中,X为样品中总三萜类含量,g·100g-1;M1为样品的质量,g;M2为通过标准曲线算得的测定用样液三萜类含量,mg;V1为待测液定容的体积,mL;V2为待测用的样液体积,mL。
1.2.11 多糖含量测定 取实验组培养基与对照组培养基上生长并过滤冷冻干燥后的樟芝菌丝体,研磨成粉,测定多糖含量。参照《中国药典》的多糖测定方法[23],以无水葡萄糖为标准品,采用苯酚—硫酸法测定。测定前,采用紫外分光光度计于400~ 800 nm 波长处进行全波长扫描,结果显示在620 nm 处具有最大吸光值,所以该反应的吸收波长设定为620 nm 。
葡萄糖标准品溶液:精确称取105℃干燥至恒重的葡萄糖标准品100.00 mg 定容于1 000.00 mL,配制成浓度为0.10 mg·mL-1的葡萄糖标准液。
葡萄糖标准曲线的绘制:精确吸取0.10%葡萄糖标准液0.00,0.10,0.20,0.30,0.40,0.50,0.60 mL,分别放入具塞磨口试管中,分别加水至1.00 mL,各加5.00 mL 蒽酮试剂,震荡混匀,水浴20 min,取出冷却至室温,在620 nm 处测定吸光度值,以吸光度值为纵坐标,葡萄糖浓度为横坐标绘制标准曲线。
样品溶液及胞内多糖测定:取樟芝菌丝体粉末0.20 g 于20.00 mL 的蒸馏水中,80℃水浴加热2 h,冷却,然后加入1:4 体积的无水乙醇混匀,置于4℃沉淀过夜,离心分离沉淀、过滤,除去滤渣,得樟芝粗多糖样品溶液,按照绘制标准曲线的方法测定吸光度值,计算多糖含量。
1.3 数据处理
采用Excel 2007 软件进行数据处理,DPS 统计分析软件对数据进行样本检验统计分析,以P<0.05 为差异显著,以P<0.01 为差异极显著。
2 结果与分析
2.1 不同维压时间猴樟组织结构的研究
汽爆预处理可以有效的改变猴樟木质纤维的天然结构,随着汽爆时间的延长,反应的激烈程度不断增加,导致猴樟的颜色由原来的褐色逐渐过渡到黑色,外形也由原来的块状过渡到纤维状。根据文献记载[24],纤维素完全降解的温度约360℃,木质素的降解温度在280~500℃。虽然本实验汽爆过程的蒸汽温度在 150~ 180℃之间,并没有到让纤维素和木质素可以完全降解的程度,但不同的维压时间也会让纤维素、木质素发生不同程度的降解。
图1 为不同汽爆时间猴樟组织结构在扫描电镜下的图片(×1 000 倍)。从图1 中可以看出不同汽爆时间预处理过的猴樟有明显的不同。图1(A)为未汽爆过的样品,标明粗糙,纤维束结合紧密;图1(B)为汽爆120 s,组织变得松散,纤维表面开始出现裂纹;图1(C)为汽爆180 s 后,组织的空腔开始增大,纤维表面出现更多的裂纹和裂片;图1(D)为汽爆240 s 后,纤维束间发生分离,表面的孔增多;图1(E)汽爆300 s 后,可以明显看到纤维的断裂;图1(F)汽爆360 s 后、(G)为汽爆420 s 后,样品表面出现微孔;图1(H)汽爆480 s 后,结合在纤维束周围的细小纤维消失,表面出现更多微孔。文献显示对植物的提取过程中传质过程是关键的限速步骤。汽爆预处理后,猴樟树枝破碎成更小的碎块,且表面造成很多微孔,可以增加提取效率[20]。

图1 不同汽爆时间猴樟的扫描电镜图Figure 1 Pictures by scanning electron microscope of C.bodinieri after different duration of steam explosion
2.2 不同维压时间对猴樟纤维素、木质素含量的影响
一般植物纤维素占40%~ 50%,木质素占20%~ 30%,均是构成植物细胞壁的主要成分。纤维素是一种不溶于水及一般有机溶剂的大分子多糖,被木质素包裹,占植物界碳含量的50%以上;木质素是包围于管胞、导管及木纤维素等纤维束细胞及厚壁细胞外的物质,具有某些侧链的苯环结构,很难分解。因此,纤维素、木质素阻碍了植物的提取。汽爆是依靠一定压力的饱和蒸汽对汽爆缸里的物料进行加热和渗透,再突然将物料置于一定的大气压力下,从而完成纤维素和木质素有选择性的分离,所以汽爆的维压时间对其处理的效果起到决定性的作用。图2 是蒸汽压力在2.00 MPa 时,不同的维压时间对纤维素和木质素的影响,从图2 可见由于维压时间越长汽爆的强度就越大,对猴樟的纤维素和木质素的破坏力就越大。
纤维素在120 s 的时候与未汽爆呈现的是下降的趋势,这可能是一下汽爆之后,压力和温度的同时作用,造成纤维性的降解,在120~180 s 的时候纤维素含量开始增加,维压时间在240 s 时,纤维素含量基本维持不变,在300~480 s 时间段内,纤维素含量持续呈上升趋势,最高在480 s 时达到58.20 %。而随着维压时间的增加,猴樟中的木质素含量持续呈上升趋势。造成这一现象的原因估计是猴樟本身的特殊性,猴樟是慢生树种,质地坚实、纹理细密,木质素含量较高,且木质素的降解温度在280~ 500℃,短时间的维压时间,不能有效的破坏木质素。对猴樟进行汽爆预处理有效提高了纤维素的有效含量,同时也有效破坏了猴樟的木质天然结构,增加了猴樟作为提取物料的比表面积,以利于后续的提取。
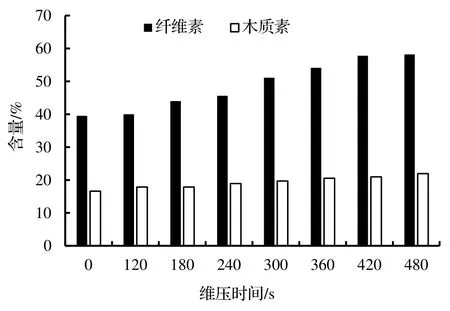
图2 不同维压时间对猴樟纤维素和木质素的影响Figure 2 Effect of different duration of steam explosion on cellulose and lignin of C.bodinieri
2.3 不同维压时间对猴樟碳、氮含量的影响
表1 是在不同维压时间内碳、氮含量以及碳氮比。从表1 中可以看出随着维压时间的增加,碳、氮含量总体趋势是呈上升的,这也和图2 中纤维素和木质素含量的情况一致,汽爆预处理破坏了细胞壁的结构,且维压时间越长破坏的程度就越大,更减少木质素对纤维素的包裹作用。
碳源、氮源在生物的生长过程中起着非常重要的作用,研究表明,过高或过低的碳氮比均不利于细胞的生长,浓度过高,不利于产物的积累。在未汽爆前,猴樟树枝的碳氮比为89,汽爆后由于细胞壁结构的破坏,引起细胞内含物的溢出,氮含量随之上升,使得碳氮比持续下降,在300 s 时下降到真菌培养基的理想水平25,而到480 s 时已降到16,因此,后续可用汽爆预处理后的猴樟树枝作为固体培养基培养樟芝。
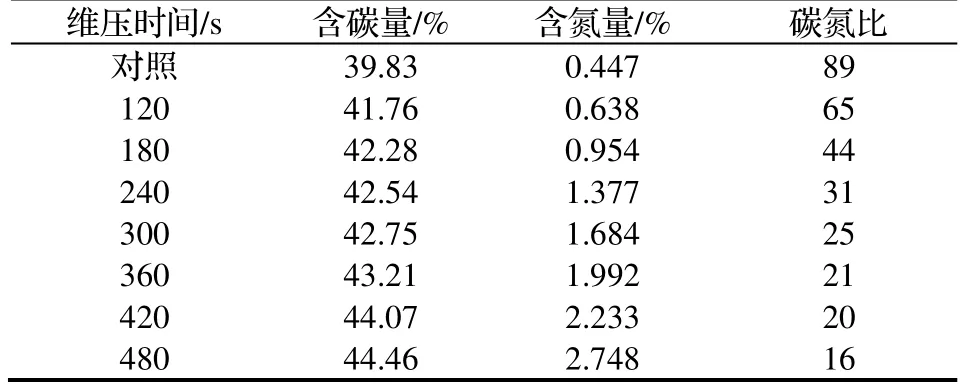
表1 不同维压时间对猴樟碳、氮含量以及碳氮比的影响Table 1 Effect of different duration of steam explosion on carbon,nitrogen content and carbon-nitrogen ratio of C.bodinieri
2.4 不同维压时间的猴樟水提物对樟芝液体培养总三萜、总多糖含量的影响
从图3 中可见,与对照猴樟水提物培养的菌丝体相比,在液体培养基中添加汽爆预处理的猴樟水提物培养的菌丝体,均呈现出不同程度促进总三萜含量的作用,其中维压时间在120~ 300 s,菌丝体总三萜含量持续上升,并在300 s 达到最高值2.90%,比对照组提高了16.80%,而维压时间在360~ 480 s,总三萜含量持续下降,到480 s 时比300 s 的总三萜含量下降了2.50%,但仍比对照组提高了13.90%。从图4 可见,与对照猴樟水提物培养的菌丝体相比,在液体培养基中添加汽爆预处理的猴樟水提物培养的菌丝体,总多糖含量持续上升。480 s 维压时间时总多糖含量到最高值2.80%,比对照组提高25.00%。由此可见,汽爆预处理对猴樟的木质纤维结构产生了一定的破坏,有效提高了猴樟的水提效果,间接促进了樟芝液体培养菌丝体的总三萜、总多糖的含量。虽然目前测定的总三萜、总多糖是液体培养樟芝菌丝体的粗提物,但也可以间接反映出汽爆后的猴樟水提物有效促进了樟芝液体培养时分泌一些活性成分。
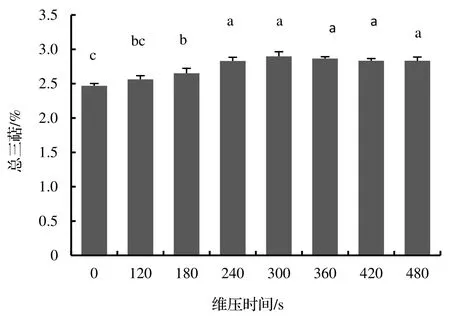
图3 不同维压时间的猴樟水提物对樟芝液体培养菌丝体总三萜含量的影响Figure 3 Effect of water extract from C.bodinieri treated by different explosion duration on total triterpene content of mycelium in liquid culture of G.camphoratum
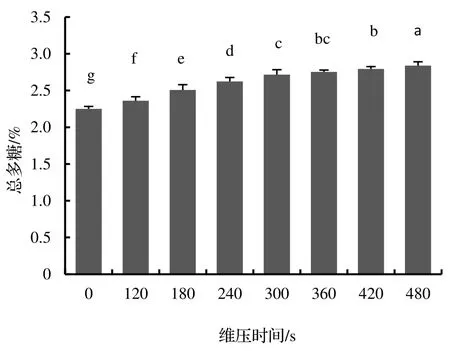
图4 不同维压时间的猴樟水提物对樟芝液体培养菌丝体总多糖含量的影响Figure 4 Effects of water extract from C.bodinieri treated by different explosion duration on total polysaccharide content of mycelium in liquid culture of G.camphoratum
3 结论与讨论
高效、清洁预处理是给培养基添加促进因子的首要步骤,现在常用的化学法存在化学品消耗、环境污染和有毒害等的压力,与其相比,汽爆具有处理时间短、污染少和无毒害等的优点,具有研究和发展的前景。
汽爆前后猴樟的组织结构发生了明显变化,颜色也明显变深,推测是由于纤维降解产生的糖类与猴樟树枝中的某些物质产生美拉德反应和焦糖化反应。随着维压时间的增加,汽爆后猴樟树枝的细小碎块量明显增加,扫描电镜图中可以看出大的碎块断裂成小的纤维束,这是由于一些物理化学变化加速了纤维等的降解。且汽爆预处理的强大机械力一定程度上破坏了猴樟的细胞壁,更加便于之后的浸润,提取。
从本实验的结果中可以看出汽爆预处理是一种有效方法,经过蒸汽爆破处理后各组分含量显著变化,破坏猴樟的木质天然结构,提高纤维素、木质素、碳和氮含量,降低碳氮比,且添加汽爆预处理之后的猴樟水提物到樟芝液体培养基中,7 个组均可以有效提高菌丝体的总三萜和总多糖含量,最高值比对照组分别提高了16.80%和25.00%。当维压时间在300 s 时,总三萜的含量最大,随着维压时间的增加而略微有点下降,排除实验误差的可能性,本实验采用2.00 MPa 的蒸汽压力对应的蒸汽温度为150~ 180℃,而纤维素、木质素的完全降解温度都在280℃之上,推测蒸汽压力不够导致对纤维素和木质素的破坏不够,这就证实了维压时间只是破坏猴樟细胞壁提高活性物质提取率的主要因素之一。近年来的研究表明降低蒸汽压力而延长维压时间的提取效果更好,故本实验仅采用单因素即只考虑汽爆不同的维压时间对猴樟树枝水提物的影响,造成这个现象的原因可能是因为之前汽爆应用在秸秆等木质素含量低的植物为主,对木质素含量较高的植物来说,质地更为坚硬,延长维压时间不能有效的软化物料,效果不如提高蒸汽压力,今后需要将二者整合为强度系数来作为汽爆预处理的综合指标,便于后续最佳的工艺参数确定。
