人热休克蛋白B6在膀胱癌组织中的表达及其预后意义
2019-12-13周皓洁邵凯迪沈雪敬陆士新王留兴
周皓洁,邵凯迪,沈雪敬,陆士新,王留兴
(郑州大学第一附属医院肿瘤科,河南 郑州 450052)
中国国家肿瘤注册中心2015年报告显示,在男性恶性肿瘤的发病率中,膀胱癌和前列腺癌分别居第6、7位;在过去几年中,膀胱癌的发病率和死亡率逐渐增加[1]。膀胱癌不仅发病率高,且复发率高,临床上需要患者定期行经尿道膀胱镜复查,增加了患者的经济负担[2]。然而目前并无对膀胱癌特异性较强的标志物。因此,本文旨在探索能够较好诊断及评估病情的膀胱癌相关标志物。
人热休克蛋白B6( heat shock protein B6,HSPB6)也称为P20,在心肌及其他许多人体组织中高表达。HSPB6在生理条件下无活性或具有部分活性,在应激激酶调节后转变为活性磷酸化状态[3]。磷酸化的HSPB6抑制转化生长因子(transforming growth factor,TGF)-α诱导的肝癌细胞迁移和侵袭,且HSPB6过表达可诱导结直肠癌细胞凋亡而显著抑制细胞进程[4]。然而,HSPB6是否与膀胱癌的发生、发展、患者预后相关,目前尚无研究证实。
1 资料与方法
1.1 TCGA数据库癌症基因组数据库(The Cancer Genome Atlas,TCGA)是一个公共资助的项目,旨在编目和发现主要的致癌基因的突变以创建癌症基因组谱的全面“图谱”。到目前为止,TCGA共覆盖人体60多个组织或器官的癌种及其亚型、50多个项目、3 000多例患者,综合分析了2 000多种基因。本文通过分析TCGA数据库中的数据揭示HSPB6与膀胱癌临床病理特征和预后的相关性.
1.2 应用Oncomine数据库分析HSPB6的表达Oncomine(https://www.oncomine.org/resource/login.html)是一个基于癌症基因芯片数据和互联网数据的挖掘平台,旨在促进全基因组表达的新发现,并将常见癌种的癌组织与对应的正常组织转录组数据进行比对[5-6]。迄今为止,该数据库已经收集了715个基因表达数据集, 86 733个癌组织和正常组织的样本数据。我们在Oncomine数据库收集的413项不同类型的研究中分析了HSPB6的表达差异,并对HSPB6与膀胱癌关系研究的其中4项研究的数据进行了Meta分析。
1.3 应用GEPIA数据库分析HSPB6与膀胱癌患者的生存预后基因表达谱数据动态分析(gene expression profiling interactive analysis,GEPIA;http://gepia.cancer-pku.cn/index.html)是由北京大学开发的交互式Web服务器,提供包括差异表达分析、分析绘图、相关性分析、患者生存分析、相似基因检测等功能[7]。本文通过GEPIA分析HSPB6与膀胱癌的生存预后的关系。
1.4 应用HPA进一步印证HSPB6在膀胱癌与正常膀胱组织表达差异人蛋白质数据库(The Human Protein Atlas,HPA;https://www.proteinatlas.org/)是一个收集44种正常人体组织和20种癌组织中分布的20 356种蛋白质的公共数据库。本文通过HPA搜集了膀胱癌及正常膀胱组织的免疫组化染色图,印证我们关于HSPB6表达差异的猜想。
1.5 应用String数据库分析HSPB6的蛋白相关作用网络蛋白质之间的功能联系通常可以从其编码基因之间的关联推断出来:相同功能所需的基因组往往表现出相似性;String数据库(https://www.string-db.org/)旨在通过整合已知和预测未知的生物体蛋白质间的直接或间接关联[8]。我们通过String数据库分析了与HSPB6有相关作用的基因及蛋白,以期预测HSPB6发挥作用的具体机制。
2 结果
2.1 HSPB6在常见肿瘤类型中的表达结果通过Oncomine数据库的检索结果可以发现,在人体不同的器官组织中HSPB6的表达水平不同。比较HSPB6在癌组织与正常组织的表达差异后发现,膀胱癌组织中的表达水平明显低于正常组织。见图1。
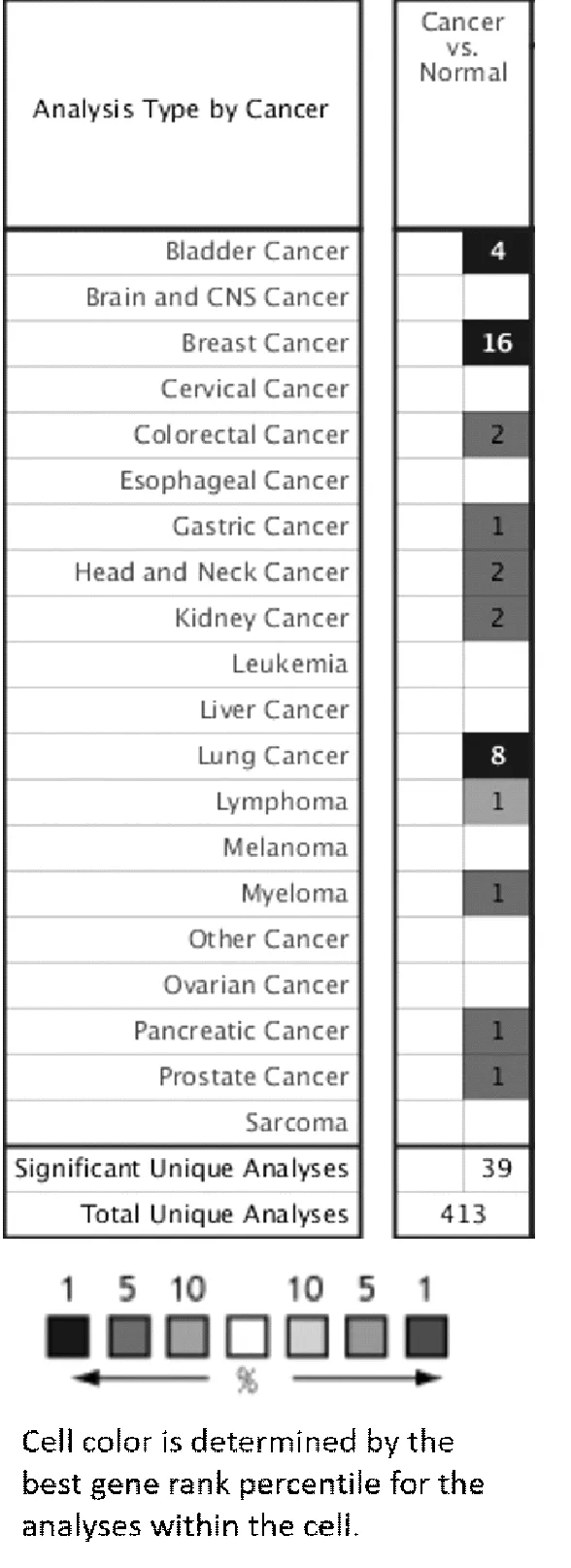
图1 Oncomine数据库示HSPB6在常见肿瘤中的表达情况
2.2 HSPB6在膀胱癌组织中的表达我们对涉及HSPB6在膀胱癌组织和正常组织中的表达的4项研究的数据进行了Meta分析,结果发现,与对照组比较, HSPB6基因在所有差异表达基因中的中位数值排名为318.0(P<0.001),提示HSPB6在膀胱癌组织中低表达。见图2。
2.3 HSPB6在不同膀胱癌研究芯片中的表达差异在Sanchez-Carbayo Bladder 2和Lee Bladder等2项研究中,分别对非浸润性及浸润性膀胱癌中HSPB6的表达情况进行了分析,结果均为HSPB6在癌组织中表达水平较正常膀胱组织低,差异均有统计学意义(P<0.05)。见图3。

图2 Oncomine数据库示HSPB6在膀胱癌组织中的表达

图3 Oncomine数据库中HSPB6在不同膀胱癌研究芯片中的表达
2.4 HSPB6与膀胱癌患者的生存的关联我们在GEPIA数据库中将切点设置为50%,将401例膀胱癌患者分为HSPB6高水平组(n=201)和低水平组(n=201),并分析其生存预后,结果显示,HSPB6低水平组的总生存率明显优于高水平组(HR=12.1,P<0.05),HSPB6低水平组的疾病无进展生存率明显优于高水平组(HR=1.8,P<0.05)。见图4。
2.5 免疫组化检测示HSPB6在正常膀胱组织与膀胱癌组织中的表达我们利用HPA数据库分析了正常膀胱组织与膀胱癌组织中HSPB6的免疫组化染色情况,结果显示:同样应用CAB001974抗体染色,在3例正常膀胱组织中HSPB6表达强度均为“中”,3例膀胱癌组织中HSPB6表达强度均为“低”;进一步证实了HSPB6在膀胱癌组织中较正常膀胱组织中低表达。见图5。
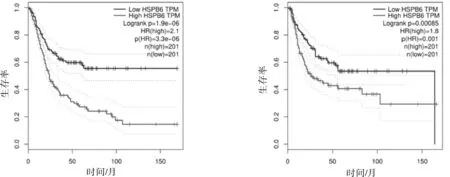
图4 HSPB6表达与膀胱癌预后之间的关系
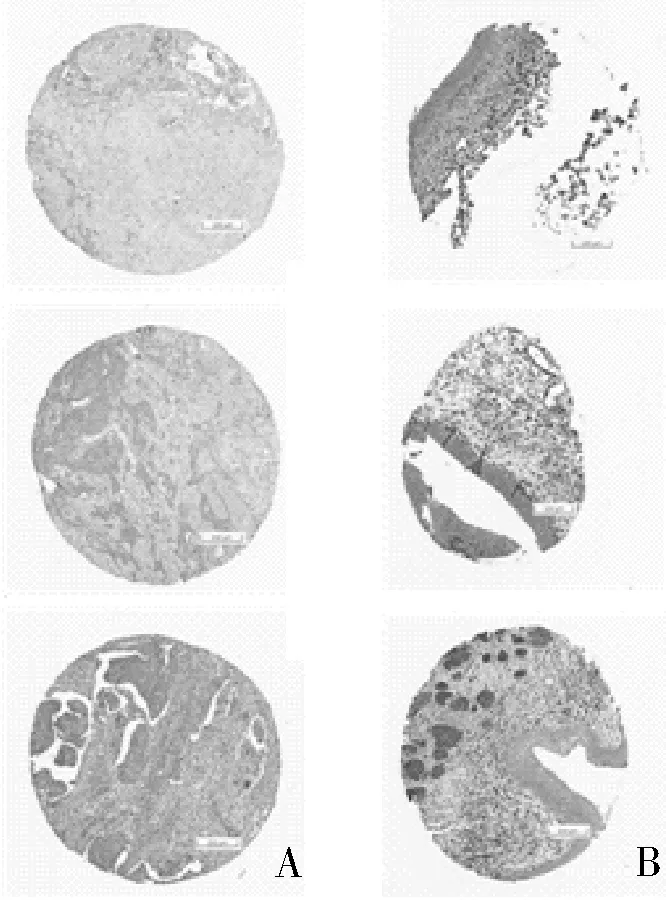
图5 免疫组化染色示HSPB6
2.6 HSPB6相关基因的检测及其功能预测情况我们利用String-DB数据库检测了与HSPB6相互作用的蛋白网络,与HSPB6相关的有HSPB9、HSPA4、HSP90AA1、BAG3、CIZ1、SFN、SHQ1、AKAP13、FN3K、TBC1D21;主要作用机制有与抗凋亡蛋白结合并发挥协同作用、参与DNA复制与功能修复等。见图6。
3 讨论
膀胱尿路上皮癌可分为肌层浸润型和非肌层浸润型,非肌层浸润型的主要治疗手段为经尿道电切和术后辅助化疗,而肌层浸润膀胱癌则多采取全膀胱切除治疗。膀胱癌细胞集落呈现复杂的异质性,其临床表现和肿瘤组织形态不一,占非肌层浸润型绝大多数的乳头状癌患者,80%会在治疗后的1~2 a内复发。浸润性膀胱癌患者即使进行根治性的膀胱切除并系统性的放化疗后,仍有约50%的患者死于肿瘤转移[9]。可见,肿瘤的复发、进展及转移是膀胱癌患者接受治疗后面临的主要风险。传统的临床、病理学指标对这些风险的预测能力十分有限。因此,探索与膀胱癌的诊疗密切相关的指标具有重要临床意义。
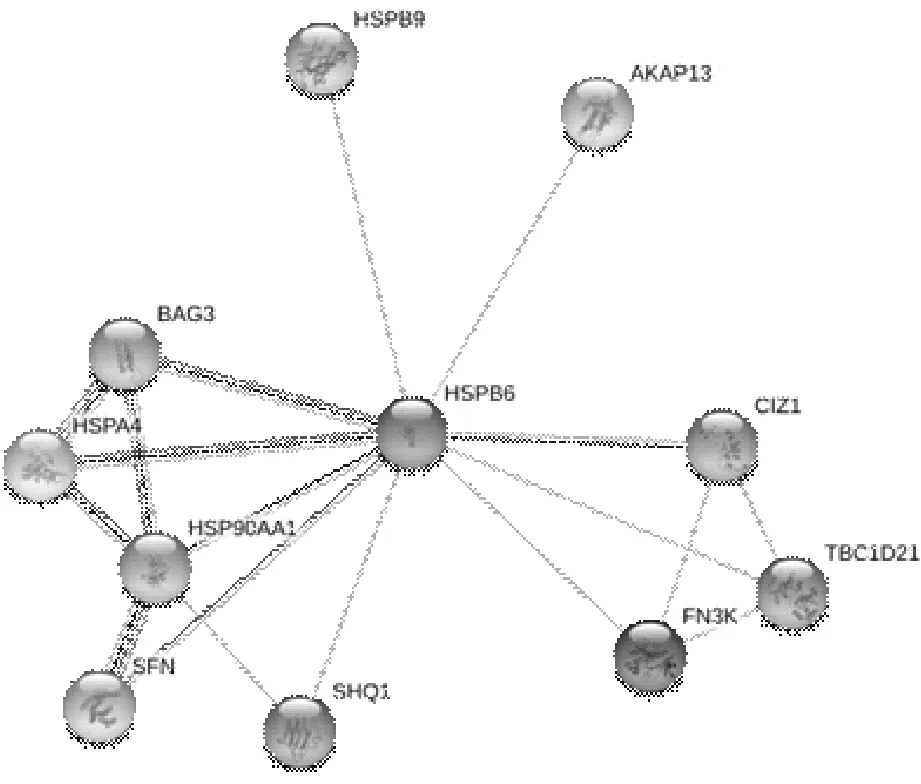
图6 与HSPB6相互作用的蛋白网络
HSPs是一组能够逆转或抑制细胞蛋白的变性以应对外界压力或高温的蛋白;因这些因子在细胞中的生理功能和保护作用,故也被称为分析伴侣。根据相对分子质量,HSPs大致可分为HSP27、HSP40、HSP60、HSP70、HSP90和大型HSPs(HSP110和葡萄糖调节蛋白170、GRP170)组[10]。有许多证据表明HSPs与恶性肿瘤的发病机制有关[11]。肿瘤细胞依赖这些蛋白质来适应其微环境,并稳定产生大量支持生长和生存的致癌蛋白质。不同的HSPs家族作为潜在的抗肿瘤靶点被广泛研究,主要有2个原因:1)HSPs与多种恶性肿瘤相关的通路相互作用,靶向作用于多种致癌通路;2)一些肿瘤通过HSPs来躲避致癌基因产物的伤害[12]。
HSPB6最初是从哺乳动物的肌肉中分离出来的,是HSPB1和HSPB5的部分产物的混合物[13]。HSPB27是在调节恶性肿瘤的发展、进展和转移以及细胞凋亡和耐药性中起重要作用的物质,其作用机制主要包括:1)HSP27通过调控p53信号通路抑制细胞衰老[14];2)HSP27的下调可诱导磷酸酶和肿瘤抑制基因PTEN的表达,表明HSP27负调控PTEN;3)HSP27通过激活肿瘤细胞中的激活蛋白-1来促进细胞增殖[15];4)HSP27与细胞色素c相互作用,调节其抗凋亡作用;5)C-X-C趋化因子受体1 (CXCR1)触发恶性肿瘤的发生和发展,CXCR1的缺失可使HSP27的表达下调,提示CXCR1、HSP27与恶性肿瘤的发生有关[16];6)可溶性环氧化物水解酶抑制剂t-AUCB阻断HSP27的活化,增加半胱天冬酶-3活性,诱导胶质母细胞瘤细胞凋亡[17]。
在本研究中,我们通过分析TCGA数据库中的大样本数据,发现了HSPB6在膀胱癌组织中的表达水平较正常膀胱组织低,但在生存分析中发现HSPB6的高表达却是膀胱癌患者的不良预后因素,其具体作用机制还未可知。总之,HSPB6可能作为临床上与膀胱癌的诊断、治疗、评估病情相关的重要指标。今后,我们可以从上述可能的作用通路着手做更深一步研究。
