粗饲料来源对育肥湖羊瘤胃微生物区系及肌肉脂肪酸组成的影响
2019-12-12董春晓吕佳颖牛骁麟马万浩李发弟
董春晓,吕佳颖,牛骁麟,马万浩,李 飞,李发弟,2
(1. 兰州大学草地农业生态系统国家重点实验室 / 兰州大学农业农村部草牧业创新重点实验室 / 兰州大学草地农业科技学院,甘肃 兰州 730020;2. 甘肃省肉羊繁育生物技术工程实验室,甘肃 民勤 733300)
来源广泛、价格低廉的粗饲料是反刍家畜的主要基础饲料,通常占日粮组成的60%~80%[1]。粗饲料中的纤维类物质被瘤胃微生物利用后可发酵产生挥发性脂肪酸(volatile fatty acids, VFA),为动物机体活动提供能量,同时也能为机体的蛋白质合成提供碳架和其他营养物质[2]。研究粗饲料对瘤胃微生物的影响可为其在畜牧业中的进一步开发利用提供重要依据。瘤胃微生物对饲料的发酵过程受日粮组成影响较大。高精料日粮中添加适量粗饲料能够有效维持瘤胃功能,保持瘤胃正常pH,降低瘤胃酸中毒风险,促进动物咀嚼和反刍[3]。有研究报道,随着日粮精粗比的提高,肉牛瘤胃中乙酸含量显著降低,丙酸和丁酸的含量显著升高[4];日粮粗饲料来源不同,则湖羊瘤胃发酵参数也有差异,花生(Arachis hypogaea)藤处理组湖羊瘤胃中丙酸、丁酸及总VFA含量均显著高于油菜(Brassica campestris)秆处理组[5];日粮不同粗饲料组合可显著影响瘤胃微生物多样性[6]。对奶牛分别饲喂苜蓿(Medicago sativa) + 玉米(Zea mays)青贮和秸秆两种不同粗饲料来源的日粮,苜蓿+玉米青贮处理组奶牛瘤胃中产琥珀酸丝状杆菌和白色瘤胃球菌的数量显著高于秸秆处理组[7]。李艺[8]将谷草和玉米黄贮以不同比例饲喂肉牛(10∶90、20∶80和30∶70),谷草与玉米黄贮比例为20∶80的处理组肉牛瘤胃中拟杆菌门的相对丰度显著高于另两处理组。生产实践中为有效对反刍动物进行育肥,提高其肉用价值,常对其饲喂营养价值高并易发酵的高淀粉日粮,导致动物瘤胃pH值降低,瘤胃酸中毒风险提高[9]。研究表明,日粮添加粗饲料不仅有利于反刍动物生产性能的提高,还能减少瘤胃食糜粘附,维持瘤胃健康[10]。
甘肃河西地区拥有丰富的农副产品,其中,玉米秸秆、玉米芯、葵花籽壳和油菜秸秆来源广泛、纤维含量较高。目前,关于此类农副产品作为粗饲料时对育肥湖羊瘤胃健康的研究报道较少。本研究拟采用玉米秸秆、玉米芯、葵花籽壳和油菜秸秆分别作为湖羊日粮唯一粗饲料来源,探索其对育肥湖羊瘤胃发酵、瘤胃菌群结构及肌肉脂肪酸组成的营养作用,为进一步阐述其在反刍动物饲料应用中的可行性提供理论依据。
1 材料与方法
试验羊购自甘肃三洋金源农牧股份有限公司羊场,于2016年9月-12月在甘肃省民勤县兰州大学试验基地进行饲养管理,各项常规指标在兰州大学草地农业科技学院反刍动物研究所进行测定。
1.1 试验设计
试验选用120只2月龄左右、平均体重为22.9 ±1.2 kg的健康湖羊公羔为研究对象,根据体重相近原则随机分成4组,每组5个栏位,每个栏位6只羊。4组试验羊分别饲喂以玉米秸秆(corn stalk,CS)、玉 米 芯(corn cob, CC)、葵 花 籽 壳(sunflower seed hull, SH)和 油 菜 秸 秆(rapeseed straw, RS)作 为粗饲料唯一来源的日粮,粗饲料配给比例均为20%,试验日粮配方及营养成分如表1所列。

表 1 日粮配方及营养水平(饲喂基础)Table 1 Formula and nutritional value of diets (per feed basis)
1.2 饲养管理
试验开始前,对所有羊只进行体内外驱虫,并对羊舍进行全面消毒。整个试验持续77 d,预试期7 d,正试期70 d。每日于08:00和16:00饲喂各试验饲粮,精粗比为80∶20,所有羊只自由采食及饮水。
1.3 样品采集
试验结束后,每个栏位选择体重接近该栏平均体重的3只羊进行屠宰,共60只。禁食24 h,禁水2 h时,颈动脉放血屠宰。屠宰后将湖羊瘤胃分离出来,取出瘤胃内容物2份,分装在50 mL冻存管,-20 ℃冷冻保存,用于提取微生物DNA;将剩余内容物用4层纱布过滤,收取瘤胃液置于20 mL冻存管,-20 ℃保存,用于VFA的提取测定。取湖羊右侧倒数第1和2肋骨处背最长肌样品200 g左右,真空包装,-20 ℃保存,用于肌肉脂肪酸的提取。
1.4 测定指标及方法
1.4.1 瘤胃液VFA的测定
参照Liang等[11]的方法提取瘤胃液VFA,利用气相色谱(Thermo Scientific, TRACE 1300, Milan, Italy)测定其含量。测定条件:色谱分析柱为DB-FFAP毛细管色谱柱,进样量为1 μL,分流比为50∶1,进样口和检测器温度均为240 ℃,氢气流率为35 mL·min-1,空气流率为350 mL·min-1,载气(N2)流率为20 mL·min-1,温度设置为以25 ℃·min-1的速率将温度从50 ℃升高到190 ℃保留2 min,再以10 ℃·min-1的升温速率升高到200 ℃保留5 min,最后以10 ℃·min-1的升温速率升高到220 ℃保留5 min。
1.4.2 微生物DNA的提取及分析
使用EZNA Stool DNA试剂盒(Omega Bio-tek,Norcross, GA, USA)提取微生物基因组DNA,方法参考说明书。每组选择5只试验羊的微生物DNA样品通过Illumina Hiseq 2500平台进行测序分析(百迈克生物科技有限公司,北京)。
1.4.3 肌肉脂肪酸的提取及分析
肌肉样品带回实验室后利用冷冻干燥机(新芝生物,SCIENTZ-10ND,宁波)脱水,参考田华勤[12]的方法提取肌肉脂肪酸,利用气相色谱(Thermo Scientific, TRACE 1300, Milan, Italy)测定含量。测定条件:色谱分析柱为HP-88毛细管色谱柱,进样量为1 μL,分流比为50∶1,进样口温度为240 ℃,检测器温度为250 ℃,氢气流率为40 mL·min-1,空气流率为400 mL·min-1,载气(N2)流率为20 mL·min-1,初始温度为50 ℃,维持4 min,随后以13 ℃·min-1的速度升至175 ℃维持27 min,再以3 ℃·min-1的速度升至215 ℃维持27 min。37种标准脂肪酸甲基酯样品均购于Sigma公司,用十九烷酸甲酯作为内标进行定量分析。
1.5 数据处理及统计方法
使用Excel 2013整理初始数据,采用SPSS 18.0统计分析软件进行单因素方差分析(ANOVO),检测各组间差异的显著性,利用Duncan法进行多重比较。其中P < 0.05表示结果差异显著,P >0.05表示结果差异不显著。
2 结果
2.1 不同粗饲料来源日粮处理中育肥湖羊瘤胃VFA的含量
不同粗饲料来源的日粮处理对育肥湖羊瘤胃中总挥发性脂肪酸(total volatile fatty acid, TVFA)浓度和单个VFA比例的影响如表2所列。CC组TVFA浓度显著高于RS组(P < 0.05);CC组乙酸的比例显著高于CS组和RS组(P < 0.05),后两组间差异不显著(P > 0.05),且此3组乙酸的比例均显著高于SH组(P < 0.05);RS组丙酸的比例显著低于其他3组(P < 0.05);RS组乙酸/丙酸显著高于CS组和SH组(P < 0.05);RS组异丁酸的比例显著高于CS组和SH组(P < 0.05),后两组间差异不显著(P >0.05),且此3组异丁酸的比例均显著高于CC组(P <0.05);SH组丁酸的比例显著高于CS组和CC组(P <0.05),RS组丁酸比例显著高于CC组(P < 0.05);RS组异戊酸的比例最高,CS组异戊酸的比例最低,各组间差异显著(P < 0.05);SH组和RS组戊酸的比例显著高于CS组和CC组(P < 0.05);其他组间差异不显著(P > 0.05)。
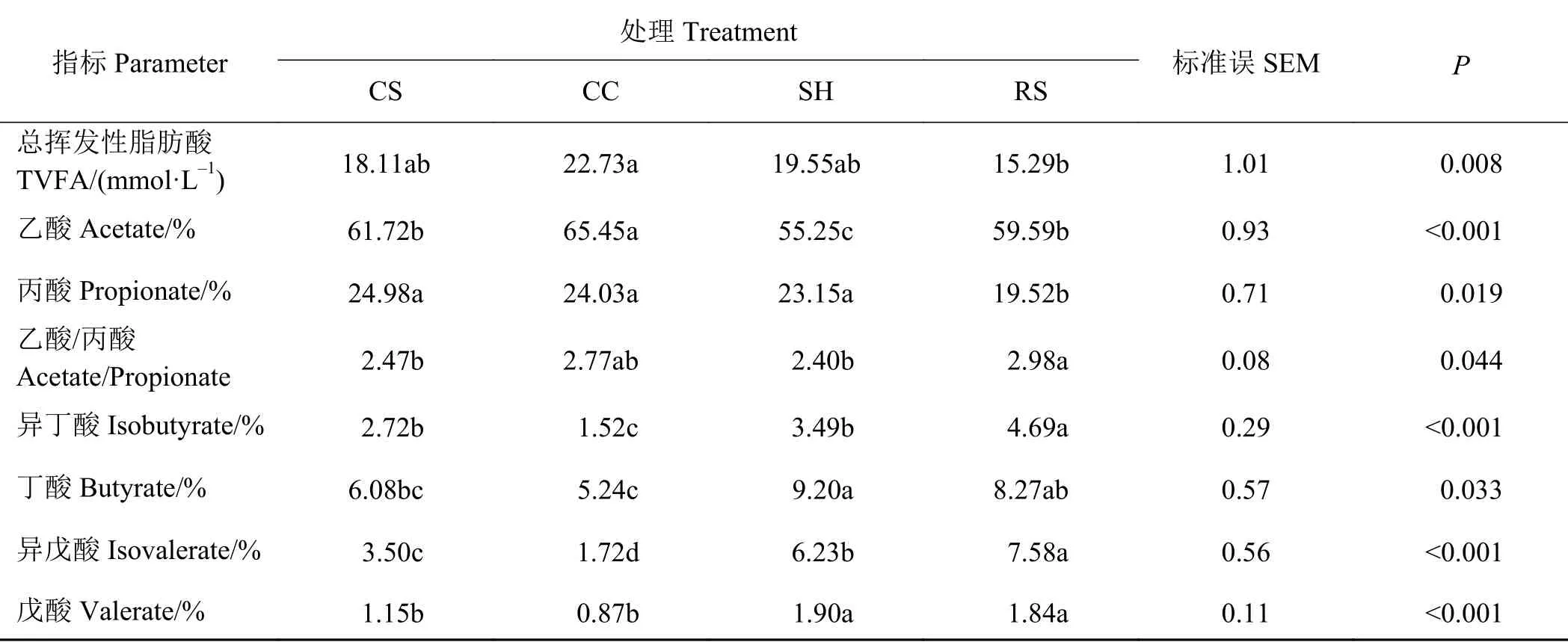
表 2 不同粗饲料来源对育肥湖羊瘤胃VFA比例的影响Table 2 Effect of roughage sources on rumen VFA proportion of finishing Hu lamb
2.2 不同粗饲料来源日粮处理中育肥湖羊瘤胃微生物多样性
在97%的相似度水平下,各处理组α多样性指数各异(表3)。通过Illumina Hiseq高通量测序得出,RS组湖羊瘤胃微生物DNA序列的分类操作单元(operational taxonomic unit, OTU)数目、物种丰富度指数Chao1和Ace均显著高于其他3组(P < 0.05);CS组物种多样性指数Simpson显著高于SH组(P <0.05);SH组和RS组物种多样性指数Shannon显著高于CS组和CC组(P < 0.05);其他组间差异不显著(P > 0.05)。而β多样性主坐标分析(principal coordinates analysis, PCoA)结果显示(图1),各试验组湖羊瘤胃菌群多样性的相似性较低。

表 3 不同粗饲料来源对育肥湖羊瘤胃微生物α多样性的影响Table 3 Effect of roughage sources on alpha diversity of the rumen microbes in finishing Hu lamb

图 1 不同粗饲料来源组湖羊瘤胃群落PCoA分析图Figure 1 PCoA analysis of the rumen community in Hu lamb following disposition to different forms of roughage
将OTU的代表序列与微生物参考数据库进行比对可得到每个OTU对应的物种分类信息,进而统计各水平上的样品群落组成。在门水平上统计比例占序列总数的1%以上的菌门,结果如表4所列,各组中厚壁菌门和拟杆菌门均为含量最丰富的菌门。RS组湖羊瘤胃厚壁菌门的相对丰度显著高于CC组(P < 0.05);CS组和CC组螺旋菌门的相对丰度显著高于RS组(P < 0.05),CC组螺旋菌门的相对丰度显著高于SH组和RS组(P <0.05);RS组湖羊瘤胃纤维杆菌门的相对丰度显著低于其他3组(P < 0.05);其他组间差异不显著(P >0.05)。
在属水平上统计比例占序列总数1%以上的菌属(表5)显示,RS组湖羊瘤胃Prevotella_1的相对丰度显著高于SH组(P < 0.05);CC组Treponema_2的相对丰度显著高于SH组和RS组(P < 0.05),CS组显著高于RS组(P < 0.05);CC组Ruminococcus_1的相对丰度显著高于SH组和RS组(P < 0.05);RS组Christensenellaceae_R-7、Ruminococcaceae_NK4A214和Candidatus_Saccharimonas的相对丰度均显著高于CC组(P < 0.05);RS组Fibrobacter的相对丰度显著低于其他3组(P < 0.05);SH组Bacterium的相对丰度显著高于RS组(P < 0.05);CC组Olsenella的相对丰度显著高于RS组(P < 0.05);CS组和CC组Roseburia的相对丰度显著高于RS组(P < 0.05);其他组间差异不显著(P > 0.05)。
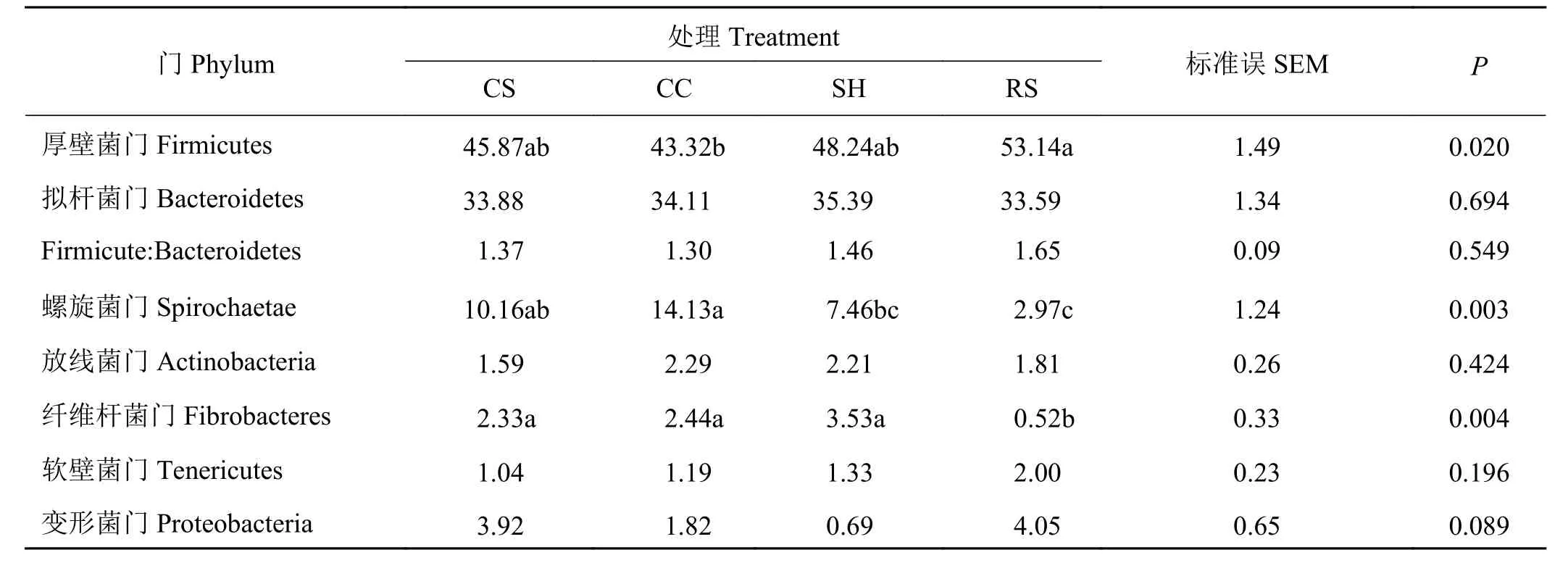
表 4 粗饲料来源对育肥湖羊瘤胃中主要菌门(相对丰度 > 1%)水平的影响Table 4 Effect of roughage sources on the main phyla (relative abundance of > 1%) of rumen microbial in finishing Hu lamb%

表 5 粗饲料来源对育肥湖羊瘤胃中主要菌属(相对丰度 > 1%)水平的影响Table 5 Effect of roughage sources on the main genus (relative abundance of > 1%) of rumen microbial in finishing Hu lamb%
2.3 不同粗饲料来源日粮处理中育肥湖羊肌肉脂肪酸的含量
不同粗饲料来源的日粮对育肥湖羊肌肉脂肪酸含量的影响(表6)显示,SH组湖羊肌肉中C10:0和C22:1n-9的含量显著高于CC组(P < 0.05);SH组C18:2n-6的含量和多不饱和脂肪酸(polyunsaturated fatty acid, PUFA)的总量显著高于CS组(P < 0.05);其他组间差异不显著(P > 0.05)。
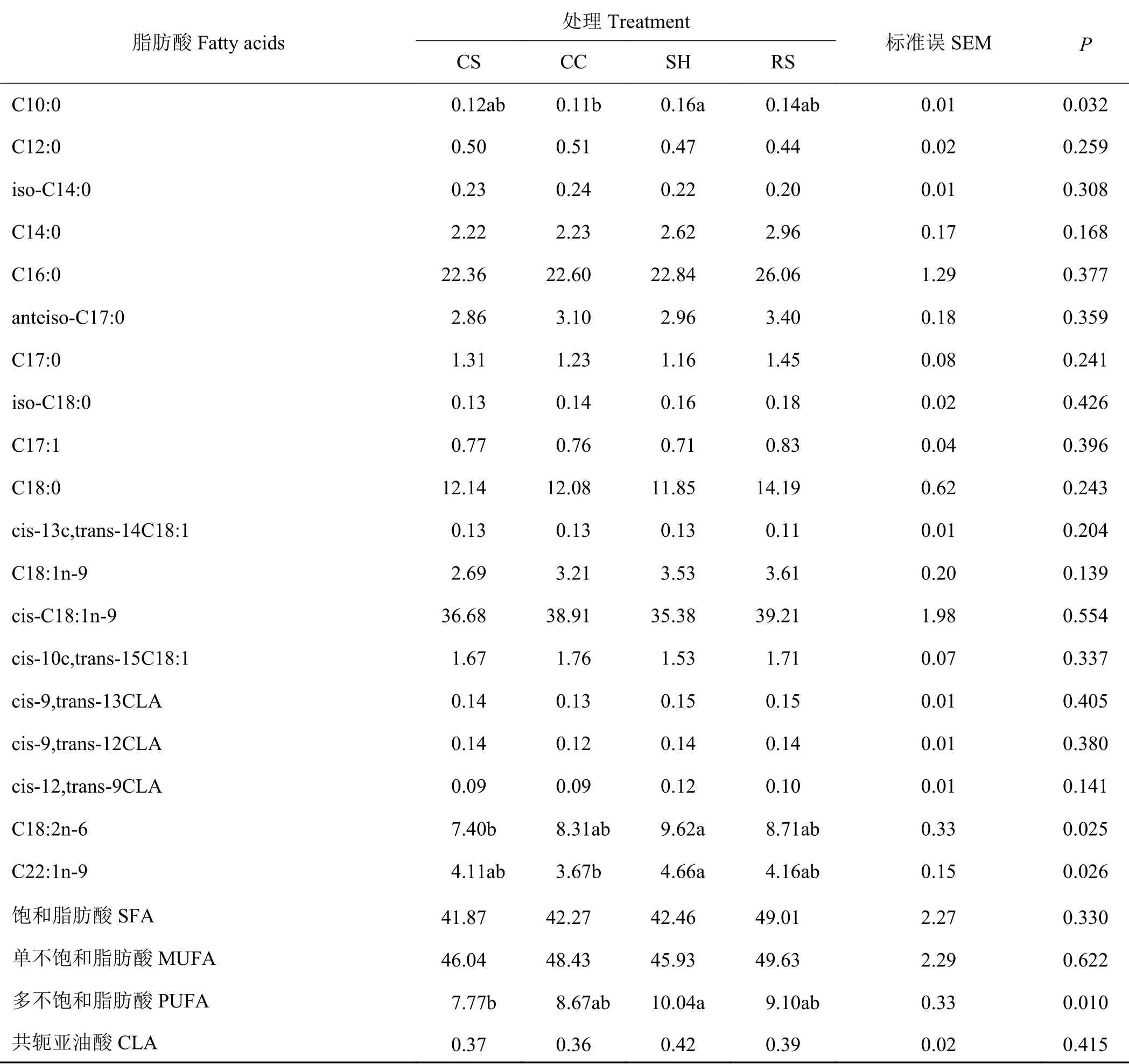
表 6 粗饲料来源对育肥湖羊肌肉脂肪酸含量的影响Table 6 Effect of roughage sources on muscle fatty acids quantity in finishing Hu lamb mg·g-1
3 讨论
3.1 不同粗饲料来源的日粮处理对育肥湖羊瘤胃VFA的影响
反刍动物瘤胃微生物发酵可产生大量VFA,能为机体活动提供能量并维持瘤胃功能[13]。本研究中,4组试验羊瘤胃中的TVFA浓度范围为15.29 ~22.73 mmol·L-1;该结果与刘婷等[14]以茴香(Foeniculum vulgare)秸秆为粗饲料来源测得的58.99~62.69 mmol·L-1,以及与沈美英[15]探究含70%~80%粗饲料来源测得的50.77~59.85 mmol·L-1的绵羊瘤胃浓度范围有所不同。这可能是由于采样时间和方法的差异所致,研究发现,绵羊采食后瘤胃内TVFA浓度呈先上升后下降的变化趋势,这主要是因为随时间的延长,动物瘤胃内发酵产生的VFA被瘤胃微生物利用,以及被瘤胃上皮吸收,从而导致TVFA浓度的降低[16]。本研究中,羔羊经过数小时禁食,瘤胃内的VFA大都被瘤胃上皮吸收,因此浓度偏低。RS组的瘤胃TVFA浓度显著低于其他组别,可能是由于该组羔羊采食量较低,不能够为瘤胃发酵提供充足的营养底物。
前人研究表明,VFA很大程度上受日粮类型的影响,如Corley和Murphy[17]通过体外发酵试验发现,高精料日粮发酵产生的丙酸和丁酸显著高于高粗料日粮,而高粗料日粮发酵产生的乙酸、异丁酸、异戊酸和戊酸显著高于高精料组;华金玲等[18]研究发现,相比精粗比为4∶6和5∶5的日粮,精粗比为3∶7的日粮组黄淮白山羊瘤胃中乙酸比例更高(P < 0.05),而精粗比为5∶5的日粮组山羊瘤胃中丙酸比例显著高于其他两组。本研究中,CC组试验羊瘤胃中乙酸的比例显著高于其他3组,且除RS组外其余组别的丙酸比例无差异,这与刘大程等[19]研究不同品质粗饲料日粮对蒙古绵羊瘤胃发酵的结论一致,可能是由于玉米芯木质化程度较低,湖羊对该处理组饲粮中性洗涤纤维(neutral detergent fiber, NDF)的消化率较高,使瘤胃pH升高,有利于纤维分解菌产生乙酸。瘤胃内的戊酸和异戊酸比例是亚急性瘤胃酸中毒(subacute ruminal acidosis, SARA)的 重 要 指 标[20-21]。本 研 究中,SH组和RS组瘤胃戊酸和异戊酸比例显著高于CS组和CC组,说明饲喂葵花籽壳和油菜秸秆时,湖羊发生SARA的风险更高。另有研究指出,瘤胃中纤维分解菌的数量和戊酸利用率之间呈正相关关系[22],说明CS组和CC组试验羊瘤胃内纤维分解菌的数量相对较高。
3.2 不同粗饲料来源的日粮处理对育肥湖羊瘤胃微生物区系的影响
瘤胃微生物群落的多样性受反刍动物品种、年龄和摄入日粮组成等多方面影响。其中,日粮成分越复杂,瘤胃微生物多样性越高[23]。本研究中,RS组的OTU数目、微生物群落丰度和多样性指数Chao1和Ace均显著高于其他3组,说明油菜秸秆成分的复杂性可能更高。此外,PCoA图分析结果显示CC和CS组瘤胃群落与RS组瘤胃菌群有着较为明显的差别,这表明试验羊喂以油菜秸秆时,对其瘤胃微生物组成有较大影响。对于优势菌群观测发现,4组试验羊瘤胃中相对丰度最高的菌群均为厚壁菌门,其次为拟杆菌门。这与Kim等[24]利用16S rRNA基因测序技术研究发现反刍动物瘤胃菌群中厚壁菌门(57.8%)和拟杆菌门(26.7%)在数量上占主导地位的结论相一致。由于油菜秸秆组饲粮NDF水平更低,可能导致了油菜秸秆组厚壁菌门的相对丰度显著高于玉米芯组。厚壁菌门主要分解纤维,该菌门下梭菌纲占比最大,其中丁酸弧菌属、醋酸弧菌属和瘤胃球菌属占有很大比例[25]。虽然本研究CC组瘤胃球菌属的相对丰度显著高于SH组和RS组,但可能因为厚壁菌门中其他菌属如淀粉分解菌等的影响使CC组该菌门的相对丰度显著降低。拟杆菌门是瘤胃中非纤维植物多糖和蛋白质的主要分解者,其相对丰度与饲粮NDF水平呈负相关关系[26],该菌门中的普雷沃氏菌属在反刍动物瘤胃中含量最高[27],本研究结果与该结论一致。油菜秸秆组的普雷沃氏菌属1的相对丰度显著高于葵花籽壳组,但是普雷沃氏菌属7的丰度较低,且该菌属在不同组别的绵羊瘤胃中并未呈现规律性变化。该现象可能是由于不同种类的普雷沃氏菌在绵羊瘤胃中分别作用于饲料中的多糖、半纤维素及淀粉等成分,从而导致各组绵羊瘤胃中不同普雷沃氏菌属的丰度有所差异。本研究CC组螺旋菌门相对丰度显著高于SH和RS组,且与该菌门下密螺旋菌属相对丰度的结果一致。研究指出密螺旋菌属与果胶降解密切相关,相比淀粉,以果胶为唯一发酵底物时该菌属的相对丰度增加了5倍[28],且能够与纤维分解菌互作而参与纤维素的降解[29]。因此,CC组饲粮可能为湖羊瘤胃中的密螺旋菌提供了较适宜的瘤胃环境,使其丰度增加。纤维杆菌属是纤维杆菌门下的唯一菌属[30],RS组纤维杆菌的丰度显著低于其余3组,表明在油菜秸秆日粮饲喂条件下,羔羊的瘤胃环境不利于纤维杆菌的生长。
3.3 不同粗饲料来源的日粮处理对育肥湖羊肌肉脂肪酸的影响
羊肉风味、嫩度和多汁性等主要受肌肉脂肪酸的组成和含量的影响。研究表明,随着绵羊体脂中C10:0含量的增加,其羊肉的膻味会随之加重[31]。本研究中SH组试验羊的肌肉内C10:0含量显著高于CS和CC组,表明以葵花籽壳为粗饲料来源的日粮可能会导致羊肉膻味的增强。各组试验羊中,SH组试验羊肌肉中C18:2n-6含量最高,是由于该组日粮中C18:2n-6的含量最高,其被动物采食后沉积在肌肉中。PUFA可降低人类血样脂蛋白中的胆固醇含量,以提高心脑血管疾病的抵抗能力[32]。本研究中,SH组试验羊肉中PUFA的含量显著高于CS组,可能与瘤胃微生物的生物氢化作用有关。瘤胃中发挥生物氢化作用的微生物主要是纤维分解菌,研究表明,PUFA对纤维分解菌的增殖有抑制作用[33],CS组羔羊肌肉中PUFA含量较低,说明该组羔羊瘤胃中纤维分解菌的数量可能相对较高。
4 结论
本研究结果表明,相比玉米秸秆日粮,玉米芯日粮显著提高湖羊瘤胃中乙酸的比例,改善瘤胃环境,有利于纤维分解菌的增殖;葵花籽壳日粮显著提高湖羊瘤胃中丙酸和戊酸的比例,湖羊发生SARA的风险更高,且该饲粮提高湖羊肌肉中C10:0的含量,会导致羊肉膻味的增强;油菜秸秆日粮显著提高湖羊瘤胃微生物的物种丰富度和多样性。
