中华稻蝗共生菌Fusarium sp.ZMT01固相培养代谢产物
2019-12-12陈嘉晴朱水容钟毓李晓琪张小琳杨玉莹何泽康佘志刚李春远
陈嘉晴,朱水容, 钟毓 ,李晓琪,张小琳,杨玉莹,何泽康,佘志刚,李春远
(1. 华南农业大学材料与能源学院,广东 广州 510642;2. 中山大学化学学院,广东 广州 510275)
昆虫种类约100多万种,是植物的3倍,但对昆虫共生菌代谢产物的研究较少[1]。一些结构新颖、活性强烈的昆虫共生菌代谢产物正陆续被发现[2-4]。中华稻蝗(OxyachinensisThunber)在我国各地均有分布,主要危害水稻、玉米、高粱、麦类等多种粮食作物。我们从中华稻蝗肠道中分离到了十多株共生菌,在对其中NigrosporasphaericaZMT05代谢产物研究中,得到了8个新化合物,包括6个环戊烯酮衍生物[5],1个乙酰苯衍生物和1个吡咯烷酮衍生物[6],均具有抗植物病原菌活性。本文继续研究来自于中华稻蝗的另一株共生菌Fusariumsp. ZMT01固相培养代谢产物,共分离鉴定了8种化合物,分别为3-苯基-2-环戊烯-1-酮 (1),2-羟基-3-苯基-2-环戊烯-1-酮 (2),曲酸 (3),曲酸单甲醚 (4),(S)-5-羟基-2, 6-二甲基-4H-呋喃 [3, 4-g] 苯并吡喃-4, 8 (6H)-二酮 (5),7, 8-二甲基苯并蝶啶-2, 4 (1H, 3H)-二酮(6), (9Z, 11E)-8,13-二羟基-9, 11-十八碳二烯酸(7),豆甾- 7, 22-二烯-3β, 5α, 6α-三醇(8)。其中化合物1,2是首次以天然产物形式分离到,化合物2的波谱数据为首次报道,化合物5~7为首次从Fusarium属分离到。活性测试表明,化合物5对小麦赤霉菌 (FusariumgraminearumSchw.)和荔枝炭疽菌 (ColletotrichumgloeosporioidesPenz.)显示强抗菌活性。

图1 化合物1~8的结构Fig.1 The structures of compounds 1-8
1 结果与讨论
化合物1的1H NMRδ7.68 (dd, 7.8, 2.4 Hz, 2H),7.45~7.54 (m, 3H)表明分子中存在1个单取代苯环,3.06 (t, 4.8 Hz, 2H),2.57 (t, 4.8 Hz, 2H)是2个连接在一起的亚甲基,6.59 (s, 1H)是双键中的CH信号,同时表明与之相连的双键碳为季碳。13C NMRδ209.6表明分子中存在1个酮羰基。以上结果结合质谱,进一步与文献合成化合物3-苯基-2-环戊烯-1-酮波谱数据对照基本一致[7],结构得到确认。该化合物以往未以天然产物的形式分离到过。
化合物2的1H NMRδ7.99 (d, 7.8 Hz, 2H), 7.46 (dd, 7.8, 7.2 Hz, 2H), 7.38 (t, 7.2 Hz, 1H),表明分子中存在一个单取代苯环,2.87 (t, 4.8Hz, 2H), 2.48 (t, 4.8Hz, 2H)是两个连接在一起的亚甲基,8.47(s, 1H)是OH信号,13C NMRδ202.8表明分子中存在1个酮羰基,剩余的不饱和碳表明分子中除了苯环外,还有1个双键且该双键的2个碳均为季碳。由此结合分子式,推测化合物2结构为2-羟基-3-苯基-2-环戊烯-1-酮。进一步测试熔点为192~194 ℃,与文献对照基本一致[8],结构得到确定。化合物2以往未以天然产物的形式分离到过,其氢谱碳谱数据以往未见文献报道。
化合物313C NMR数据表明分子中存在1个羰基,2个双键,1H NMRδ4.29 (s, 2H) 结合13C NMR数据表明分子中存在1个与季碳连接的连羟基的亚甲基,1H NMRδ9.07 (s, 1H)是羟基信号,进一步与相对分子质量对照,表明分子还有1个氧原子且具有单环结构。在此基础上波谱数据与文献对照基本一致[9],因此鉴定化合物3为曲酸。
化合物4的氢谱碳谱数据与化合物3十分类似,主要区别在于化合物41H NMR中少了δ9.07 (s, 1H) 的羟基信号,而多了3.64 (s, 3H) 的甲氧基信号,结合质谱及13C NMRδ56.1的碳信号,表明化合物4为化合物3羟基甲醚化的产物。在此基础上与文献波谱数据对照基本一致[9],鉴定为曲酸单甲醚。
化合物51H NMRδ2.52 (s, 1H) 为连不饱和双键碳的甲基信号,5.73 (q, 6.6 Hz, 1H) 是连氧的次甲基,1.67 (d, 6.6 Hz, 3H) 是甲基,从偶合常数判断与该次甲基相互连接,δ13.43 (s, 1H) 是羟基,δ6.37和7.83是两个芳环质子。13C NMRδ184.0是与双键共轭的羰基碳信号,168.2是酯羰基,9.7, 18.2为甲基,76.5为连氧的次甲基, 剩余均为sp2杂化碳,由此结合分子量推断该化合物可能为取代有2个甲基、1个羟基的色原酮并五元内酯环结构,进一步与文献波谱数据及比旋光度对照基本一致[10],鉴定化合物5为(S)-5-羟基-2, 6-二甲基-4H-呋喃[3, 4-g] 苯并吡喃-4, 8 (6H)-二酮。
化合物6通过高分辨质谱HRESIMSm/z: 243.0887 [M+H]+确定分子式为C12H10N4O2,不饱和度为10,1H NMR谱δ11.84 (s, 1H) 和11.67 (s, 1H) 是酰亚氨基质子信号,δ7.92 (s, 1H),δ7.71 (s, 1H)是芳香质子信号,δ2.49 (s, 3H) 和δ2.46 (s, 3H) 是两个甲基质子信号。13C NMRδ160.7, 150.1为两个酰亚胺羰基,20.2, 19.6为两个甲基,剩余的芳香碳结合分子式及所含的氮原子数推测分子具有苯并蝶啶骨架,在此基础上与文献波谱数据对照基本一致[11],鉴定化合物6为7, 8-二甲基苯并蝶啶-2, 4 (1H, 3H)-二酮。
化合物71H NMR谱δ6.51 (dd, 11.3, 15.2 Hz, 1H), 5.75 (dd, 15.1, 6.6Hz, 1H)为E式双键, 6.05 (dd, 11.2, 11.0, 1H), 5.39 (dd, 9.0, 11.0, 1H)为Z式双键,4.64 (dt, 6.6, 8.8, 1H), 4.19 (dt, 6.6, 6.8 Hz, H-13, 1H)为连羟基的CH,0.89 (t, 7.2, 3H)结合 1.31~2.34的信号表明分子骨架为一条长链,分子硅胶薄层层析展开拖尾,表明具有羧基,在此基础上结合相对分子质量推测可能结构,与文献波谱数据对照基本一致[12],鉴定为 (9Z, 11E)-8,13-二羟基-9, 11-十八碳二烯酸。
化合物8氢谱和碳谱数据表明属于甾醇类化合物,δ5.24(dd, 15.0, 7.2 Hz, 1H), 5.18(dd, 15.0, 8.4 Hz, 1H)为甾醇侧链的反式双键,5.09(d, 2.4 Hz, 1H)是双键质子,0.99(d, 6.0 Hz, 3H), 0.88(d, 6.6 Hz, 3H), 0.82(d, 7.2 Hz, 3H), 0.80(d, 7.2 Hz, 3H)是4个连在CH上的甲基, 0.54(s, 3H),0.91(s, 3H)是2个连在季碳上的甲基,4.50(d, 5.4 Hz, 1H), 4.23(d, 5.4 Hz, 1H), 3.59(s, 1H)在滴加重水后信号消失,表明为3个羟基,前两者连接在CH上,后者连接在季碳上,在此基础上与文献波谱数据对照基本一致[13],鉴定为豆甾-7, 22-二烯-3β, 5α, 6α-三醇。
用文献二倍稀释法[14]测试化合物1~7对小麦赤霉菌及荔枝炭疽菌活性(阳性对照三唑酮对两菌最小抑菌浓度MIC分别为150和50 μg/mL),结果表明化合物5对两菌的MIC分别为150,50 μg/mL,与阳性对照持平。此外化合物6对两菌MIC分别为300,200 μg/mL, 化合物3对荔枝炭疽菌的MIC为400 μg/mL,其余测试结果MIC均大于400 μg/mL。以上结果表明化合物5和6可作为抗上述植物病原真菌的先导化合物开展深入研究。
2 实验部分
2.1 试剂与实验仪器
AV 600核磁共振波谱仪(Bruker Biospin AG),MDS SCIEX APCI 2000液质联用仪,Horiba SEPA-300旋光仪,X4精密显微熔点仪(北京中仪博腾科技有限公司)。GF254薄层层析硅胶、200~300目柱层析硅胶(青岛海洋化工公司),Sephadex LH-20凝胶(GE Healthcare),其他常规试剂均为分析纯。
2.2 菌种
真菌Fusariumsp. ZMT01分离自中华稻蝗的肠道,通过PCR扩增真菌核糖体ITS基因区段并与NCBI BLAST数据库中编码为KM231809.1菌株对比(相似度99%)得到鉴定[15],植物病原菌小麦赤霉菌和荔枝炭疽菌引种自华南农业大学农学院,保藏于华南农业大学材料与能源学院。
2.3 菌种发酵培养及分离
采用大米固相培养基 (1 000 mL 锥形瓶,每瓶含大米80 g,水100 mL) 静置培养30 d,共培养100瓶。将培养物用乙醇提取4次,减压浓缩,得到提取物35 g。提取物经常规真菌代谢产物分离流程[16],包括正相硅胶柱层析,以石油醚-乙酸乙酯-甲醇梯度淋洗分段,再经反复硅胶柱层析,Sephadex LH-20凝胶色谱和重结晶纯化后得到化合物1(18 mg),2(15 mg),3(8 mg),4(8 mg),5(6 mg),6(15 mg),7(12 mg),8(25 mg),9(100 mg),10(80 mg)。
2.4 抗真菌活性测试
采用二倍稀释法[14]测试化合物1~7对小麦赤霉、荔枝炭疽的抗菌活性,记录结果时间为28 ℃下小麦赤霉菌培养24 h,荔枝炭疽菌培养48 h,用三唑酮作为抗真菌的阳性对照,无菌生长的样品浓度即为最小抑菌浓度(MIC)值。
2.5 化合物的物理和波谱数据
化合物1:C11H10O,白色粉末状固体,MS (ESI)m/z: 159.1 [M+H]+,1H NMR (400 MHz, CDCl3)δ7.68 (dd, 7.8, 2.4 Hz, 2H), 7.45~7.54 (m, 3H), 6.59 (s, 1H), 3.06 (t, 4.8 Hz, 2H), 2.57 (t, 4.8 Hz, 2H);13C NMR(100 MHz, CDCl3)δ209.6, 174.1, 134.3, 131.5, 129.0, 127.6, 126.9, 35.4, 28.8。
化合物2:C11H10O2,白色粉末状固体,θmp192~194 ℃, MS (ESI)m/z: 175.1 [M+H]+,1H NMR (600 MHz, acetone-d6)δ8.47(s, 1H), 7.99 (d, 7.8 Hz, 2H), 7.46 (dd, 7.8, 7.2 Hz, 2H), 7.38 (t, 7.2 Hz, 1H), 2.87 (t, 4.8Hz, 2H), 2.48 (t, 4.8Hz, 2H);13C NMR (150 MHz, acetone-d6)δ202.8, 150.3, 137.2, 135.7, 129.6, 129.3, 128.2, 31.7, 23.7。
化合物3:C6H6O4,无色晶体,MS (ESI)m/z: 143.0 [M+H]+,1H NMR (600 MHz, DMSO-d6)δ9.07 (s, 1H), 8.03 (s, 1H), 6.34 (s, 1H), 5.68 (s, 1H), 4.29 (s, 2H);13C NMR (150 MHz, DMSO-d6)δ173.9, 168.1,145.7, 139.3, 109.9, 59.5。
化合物4: C7H8O4,无色针状晶体,MS (ESI)m/z: 187.2 [M+H]+,1H NMR (600 MHz, DMSO-d6)δ8.08 (s, 1H), 6.30 (s, 1H), 5.68 (s, 1H), 4.29 (s, 2H), 3.64 (s, 3H);13C NMR (150 MHz, DMSO-d6)δ172.9, 168.1,147.9, 139.1, 109.9, 59.3, 56.1。
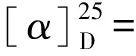
化合物6:C12H10N4O2,淡黄色无定型粉末。HRESIMSm/z: 243.088 7 [M+H]+,1H NMR (600 MHz, DMSO-d6)δ11.84 (s, 1H), 11.67 (s, 1H), 7.92 (s, 1H), 7.71 (s, 1H), 2.49 (s, 3H), 2.46 (s, 3H);13C NMR (150 MHz, DMSO-d6)δ160.7, 150.1, 146.5, 144.7, 141.6, 138.9, 138.4, 130.2, 128.7, 125.9, 20.2, 19.6。
化合物7: C18H32O4,黄色油状物,MS (ESI)m/z: 313.2 [M+H]+,1H NMR (600 MHz, CDCl3):δ6.51 (dd, 11.3, 15.2 Hz, 1H), 6.05 (dd, 11.2, 11.0, 1H), 5.75 (dd, 15.1, 6.6 Hz, 1H), 5.39 (dd, 9.0, 11.09, 1H), 4.64 (dt, 6.6, 8.8, 1H), 4.19 (dt, 6.6, 6.8 Hz, H-13, 1H), 2.34 (t. 7.6 Hz, 2H), 1.64 (m, 2H), 1.62 (m, 1H), 1.56 (m, 1H), 1.52 (m, 1H), 1.49 (m, 1H), 1.37 (m, 6H). 1.31 (m, 6H), 0.89 (t, 7.2, 3H).13C NMR (125 MHz, CDCl3):δ165.8, 138.1, 134.1, 129.3, 125.1, 72.7, 67.7, 37.2, 37.0, 33.6, 31.7, 28.7, 28.6, 25.0, 24.8, 24.4, 22.6, 14.0。
化合物8:为无色针状晶体。1H NMR(600 MHz, DMSO-d6)δ5.24(dd, 15.0, 7.2 Hz, 1H), 5.18(dd, 15.0, 8.4 Hz, 1H), 5.09(d, 2.4 Hz, 1H), 4.50(d, 5.4 Hz, 1H), 4.23(d, 5.4 Hz, 1H), 3.77(m, 1H), 3.59(s, 1H), 3.38(brs, 1H), 2.04~1.84(m, 6H), 1.84~1.76(m, 1H), 1.69~1.63(m, 2H), 1.62~1.22(m, 11H), 0.99(d, 6.0 Hz, 3H), 0.91(s, 3H), 0.88(d, 6.6 Hz, 3H), 0.82(d, 7.2 Hz, 3H), 0.80(d, 7.2 Hz, 3H), 0.54 (s, 3H);13C NMR (150 MHz, DMSO-d6)δ139.61 135.42, 131.43, 119.37, 74.42, 72.23, 65.88, 55.32, 54.19, 43.03, 42.24, 42.03, 40.17, 40.02, 38.91, 36.62, 32.43, 31.24, 27.73, 22.58, 21.29, 21.04, 19.72, 19.43, 17.74, 17.29, 12.03。
