钒渣钠化焙烧熟料浸出液除磷工艺研究
2019-12-12董玉明朱光锦裴丽丽刘宏辉闫蓓蕾徐红彬
董玉明 ,朱光锦 ,裴丽丽 ,刘宏辉 ,闫蓓蕾 ,徐红彬 ,张 懿
(1.中国科学院绿色过程与工程重点实验室,北京100190;2.中国科学院过程工程研究所湿法冶金清洁生产技术国家工程实验室;3.中国科学院大学;4.攀钢集团研究院有限公司)
钒是一种战略储备资源,钒产品85%以上用作钢铁添加剂[1]。中国是钒资源大国,据美国地质勘探局(USGS)统计显示,2017年中国钒产量占世界钒产量的54%。钒渣是中国工业提钒的主要原料,目前钒渣提钒主要采用钠化焙烧—水浸—净化—沉多钒酸铵—煅烧制备五氧化二钒工艺路线。浸出过程中杂质磷部分进入液相,磷与钒容易结合生成磷钒杂多酸 H7[P(V2O6)6]以及其他磷酸盐沉淀,影响多钒酸铵的结晶过程和产品质量[2],以钒作为添加剂的不同牌号钢材对磷含量都有相应的要求[3],因此钠化焙烧浸出液除磷是工业生产钒产品的关键步骤。
含钒溶液除磷的方法主要是化学沉淀法,通常采用钙盐、镁盐和铝盐等除磷试剂。钒工业生产普遍采用钙盐和镁盐作为除磷剂,常用的钙盐为CaCl2[4],控制合适的 CaCl2加入量和除磷 pH 具有较好的除磷效果,存在的问题是CaCl2加入量过多容易造成钒的损失,同时体系中还引入了Cl-;常用的镁盐为MgCl2,由于钒酸镁[包括 Mg(VO3)2、MgV2O7、Mg3(VO4)2]溶解度很大[4-5],所以 MgCl2的优势是钒损失少,存在的问题是钒溶液中有Cl-和Mg2+的残留。Al2(SO4)3是钒工业生产的常规除硅试剂,也可以作为除磷剂用于除磷[6],合适的加入量和pH范围内同样具有较好的除磷效果,但是仍然存在钒溶液中Al3+残留以及钒损失的问题。
笔者以钒渣钠化焙烧熟料浸出液为原料,采用CaSO4·2H2O 作为除磷剂,研究 CaSO4·2H2O 用量、溶液pH、反应温度、反应时间等因素对含钒溶液中磷去除率以及钒损失率的影响,结合沉淀多钒酸铵所需溶液中V2O5与P质量浓度比大于1 000的要求[7],获取合适的除磷工艺条件,为CaSO4·2H2O脱磷以及获得高沉钒率和生产高纯度五氧化二钒提供参考,对工业生产具有一定的实用意义。
1 实验部分
1.1 原料、试剂及仪器
原料:以实验室制得的钒渣钠化焙烧熟料浸出液为原料。钒渣来自中国东北某钒渣生产企业,浸出液pH=9.0。浸出液具体成分见表1。
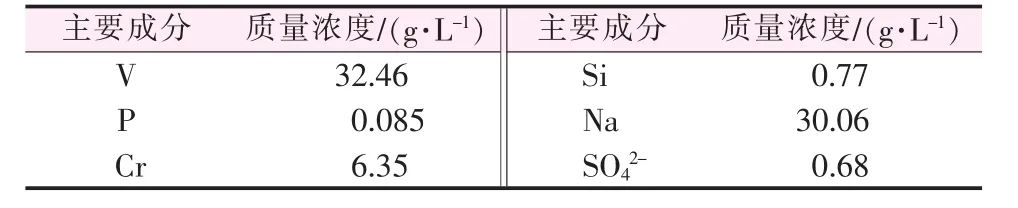
表1 浸出液主要成分
试剂:二水硫酸钙、浓硫酸、氢氧化钠、硫酸铵,均为分析纯。
仪器:DF-101S型集热式恒温加热磁力搅拌器;ML104/02型分析天平;DHP-9012型电热恒温鼓风干燥箱;SHB-Ⅲ型循环水式多用真空泵;SX2-5-12型箱式电阻炉;UV2000/2100型紫外可见分光光度计;Optima 5300DV型电感耦合等离子体原子发射光谱仪;AXIOS型X荧光光谱仪;ICS-5000+离子色谱仪。
1.2 实验原理
钒渣钠化焙烧浸出液中的磷以PO43-、HPO42-、H2PO4-的形式存在[8]。 CaSO4·2H2O 溶解度较小,部分电离出来的Ca2+与磷反应生成更稳定的磷沉淀物,钒溶液中的Ca2+残留量较少。根据溶度积常数计算[9-10],除磷过程可能包括以下反应:
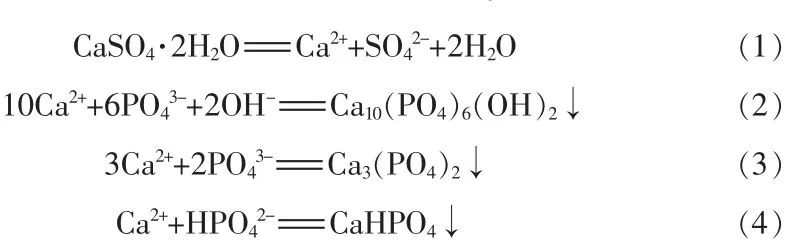
1.3 实验方法
1.3.1 除磷过程
取一定量钒渣钠化焙烧熟料浸出液,加热至一定温度,加入一定量 CaSO4·2H2O(CaSO4·2H2O 用量以CaSO4·2H2O与P物质的量比计),调节溶液pH,搅拌并保温一定时间。反应结束后过滤,分析溶液中V 和 P 的含量,计算磷去除率(ηP除)、钒损失率(ηV损)以及溶液中V2O5与P的质量浓度比(δV2O5/P)。
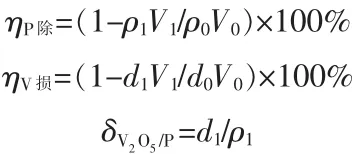
式中:ρ0为原溶液中P质量浓度,g/L;ρ1为除磷后溶液中P质量浓度,g/L;d0为原溶液中V2O5质量浓度,g/L;d1为除磷后溶液中 V2O5质量浓度,g/L;V0为原溶液体积,mL;V1为除磷后溶液体积,mL。
1.3.2 沉钒过程
除磷后的含钒溶液在室温下搅拌并加硫酸调节pH=4~5,加入生成多钒酸铵理论量1.1倍的硫酸铵,加热溶液并继续加硫酸调节pH=2.5,升温到95℃搅拌1 h,过滤、洗涤、干燥,分析滤液中V2O5质量浓度,将多钒酸铵在520℃煅烧得到V2O5。沉钒率(ηV沉)计算公式:
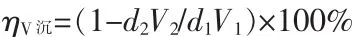
式中:d2为沉钒滤液中 V2O5质量浓度,g/L;V2为沉钒滤液体积,mL。
1.4 分析方法
溶液中硫酸根的测定采用离子色谱法;溶液以及产品V2O5中磷的测定采用铋磷钼蓝分光光度法;溶液中其他元素测定采用电感耦合等离子体原子发射光谱法(ICP-AES);产品V2O5中其他元素测定采用X射线荧光光谱法(XRF)。
2 结果与讨论
2.1 工艺条件对 ηP除、ηV损、δV2O5/P的影响
2.1.1 CaSO4·2H2O用量的影响
固定条件:溶液pH=9.0、反应温度为65℃、反应时间为 2 h。 考察 CaSO4·2H2O 用量对 ηP除、ηV损、δV2O5/P的影响,结果见图1。从图1a看出,随着CaSO4·2H2O 用量增加除磷率先是增大,当n(CaSO4·2H2O)/n(P)达到5.3以后除磷率增大趋势减慢;随着CaSO4·2H2O用量增加钒损失率逐渐增大,当n(CaSO4·2H2O)/n(P)达到10.5以后钒损失率趋于稳定。在加入 CaSO4·2H2O后,溶液中的 P与 CaSO4·2H2O电离的Ca2+反应生成磷酸钙沉淀,由于CaSO4·2H2O在水中是微溶的,因此CaSO4·2H2O除磷反应属于溶解-沉淀过程。CaSO4·2H2O在65℃水溶液中达到溶解平衡需要 5.3 h[11],实验中 CaSO4·2H2O 还未溶解饱和时生成的磷酸钙便将其包裹,阻止其进一步溶解。当CaSO4·2H2O用量较少时,溶液中溶解的Ca2+量较少,磷酸钙沉淀量少,除磷率也较低,随着CaSO4·2H2O用量增加,促进了反应(1)的平衡向右移动,溶液中Ca2+浓度逐渐增加,因此除磷率也逐渐增大;当CaSO4·2H2O用量达到一定值时,溶液中Ca2+浓度较高,生成的磷酸钙量较多导致CaSO4·2H2O包裹严重,再继续增加CaSO4·2H2O用量,Ca2+浓度增加较慢,因此除磷率增大趋势减慢。而钒的损失主要是因为钒与部分Ca2+生成钒酸钙沉淀,同理当Ca2+浓度逐渐增加时钒的损失率也逐渐增大,当Ca2+浓度增加较慢时钒的损失率也趋于稳定。结合图1b除磷后溶液中V2O5与P质量浓度比,可以看出随着CaSO4·2H2O用量增加,V2O5与P质量浓度比逐渐增大,当n(CaSO4·2H2O)/n(P)达到 5.3 以后 V2O5与 P 质量浓度比增大趋势减慢,这种变化趋势与除磷率变化趋势基本一致,两者均呈两段线性关系。随着CaSO4·2H2O 用量增加,n(CaSO4·2H2O)/n(P)达到 5.3 以前两者变化率都较快,n(CaSO4·2H2O)/n(P)达到 5.3以后两者变化率都较慢,n(CaSO4·2H2O)/n(P)达到5.3是分界点,此时V2O5与P质量浓度比为1 814,磷的残余量已经不影响多钒酸铵的结晶过程[7],因此选择n(CaSO4·2H2O)/n(P)为 5.3。
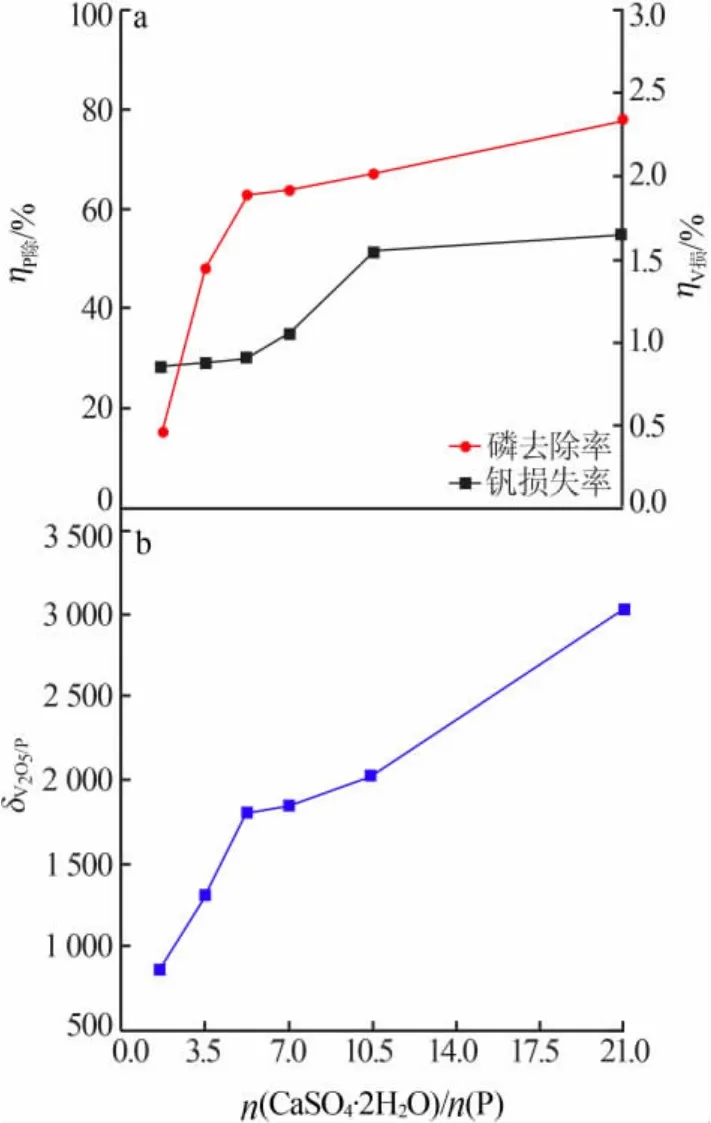
图1 CaSO4·2H2O用量对ηP除(a)、ηV损(a)、δV2O5/P(b)的影响

图2 CaSO4·2H2O 除磷理论、实际消耗量(a);CaCl2除磷理论、实际消耗量(b)
为更好地说明除磷反应的溶解-沉淀过程,利用 Ca10(PO4)6(OH)2溶度积[8-9]计算出不同除磷率时CaSO4·2H2O理论消耗量与实际消耗量,结果见图2a;同时对董婧蒙[12]采用的 CaCl2除磷理论消耗量与实际消耗量进行计算,结果见图2b。图2中的钙盐消耗量为钙盐与除磷原液中磷的物质的量比。从图2a看出,随着除磷率提高,CaSO4·2H2O理论消耗量逐渐增加,但整体增加趋势较小,而实验中CaSO4·2H2O消耗量均大于理论消耗量,可以证明存在磷酸钙沉淀包裹CaSO4·2H2O的现象。CaSO4·2H2O实际消耗量存在两段线性变化趋势,除磷率在63%以前,CaSO4·2H2O消耗量增加趋势小,除磷率达到63%以后,CaSO4·2H2O消耗量增加趋势迅速增大,除磷率达到63%是分界点,此时CaSO4·2H2O与P物质的量比为5.3,可以看出在CaSO4·2H2O与P物质的量比为5.3之前,磷酸钙包裹CaSO4·2H2O现象少,当CaSO4·2H2O与P物质的量比达到5.3以后,磷酸钙包裹CaSO4·2H2O现象严重,继续增大CaSO4·2H2O加入量除磷效率降低,能够解释说明前文中提到的溶解-沉淀过程的变化规律。
由图2b看出,CaCl2实际消耗量只是略大于理论消耗量,CaCl2是可溶盐,包裹现象不明显,在达到相同的除磷率时,CaCl2用量小于CaSO4·2H2O,并且采用CaCl2能够获得更高的除磷率。但是,当CaSO4·2H2O除磷率为 48%时,V2O5与P质量浓度比为1 297,除磷后的溶液能够满足生产多钒酸铵产品的要求,同时考虑钒工业氨氮废水处理产生的中和渣(主要成分是 CaSO4·2H2O)[13]可作为潜在的 CaSO4·2H2O除磷剂来源,加之可溶性CaCl2引入Cl-等问题,因此选择CaSO4·2H2O作为除磷剂。
2.1.2 溶液pH的影响
固定条件:CaSO4·2H2O与P物质的量比为5.3,反应温度为65℃,反应时间2 h。加入硫酸或氢氧化钠调节溶液 pH,考察 pH 对 ηP除、ηV损、δV2O5/P的影响,结果见图3。从图3a看出,随着pH增加,除磷率不断增大,钒损失率呈现先减小后增大的趋势。磷在溶液中有 3种存在形式 HPO42-、H2PO4-和 PO43-,在pH=7.5时磷的存在形式主要是H2PO4-和HPO42-,随着pH增加磷以HPO42-形式存在的比例增大,在pH=10时磷的存在形式主要是HPO42-和PO43-,并且随着pH继续增加磷以PO43-形式存在的比例继续增大[8]。Ca10(PO4)6(OH)2、Ca3(PO4)2、CaHPO4、Ca(H2PO4)2溶度积由大到小的顺序为 Ca(H2PO4)2、CaHPO4、Ca3(PO4)2、Ca10(PO4)6(OH)2[9],随着 pH 增加生成的 Ca10(PO4)6(OH)2、Ca3(PO4)2、CaHPO4量增加,因此磷去除率增大,同时可以看出pH对除磷率影响较大。钒的损失主要由两方面原因造成:第一方面原因是溶液中硅浓度较高,随着pH降低溶液中的硅酸根水解生成硅酸,在低pH条件下硅酸在短时间内聚合形成凝胶,容易吸附夹带造成钒损失[14];第二方面原因是钒在不同pH溶液中的存在形式不同[1-2],pH增加到9.0左右时溶液中钒的存在形式将由V4O124-向V2O74-转化,pH增加到13.0左右时溶液中钒的存在形式由V2O74-向 VO43-转化,而 Ca(VO3)2、Ca2V2O7、Ca3(VO4)2溶度积由大到小的顺序为Ca(VO3)2、Ca2V2O7、Ca3(VO4)2[10],因此在低 pH 条件下硅胶吸附夹带钒是钒损失的主要影响因素,在高pH条件下钒酸钙沉淀是钒损失的主要影响因素。在pH=7.5时硅酸聚合形成的凝胶沉淀量较大,钒损失率较大,随着pH增加,硅酸聚合程度减弱钒损失率减小,当pH增加到9.0 以后 Ca(VO3)2转变成 Ca2V2O7和 Ca3(VO4)2,因此钒的损失率又开始增大。钒渣钠化焙烧熟料浸出液pH=9.0,从除磷率、钒损失率以及成本上考虑采用原液直接除磷较为适宜,从图3b看出,除磷后溶液中V2O5与P质量浓度比变化趋势与除磷率变化趋势基本一致,原液直接除磷时V2O5与P物质的量比为2149,满足沉淀多钒酸铵的要求。
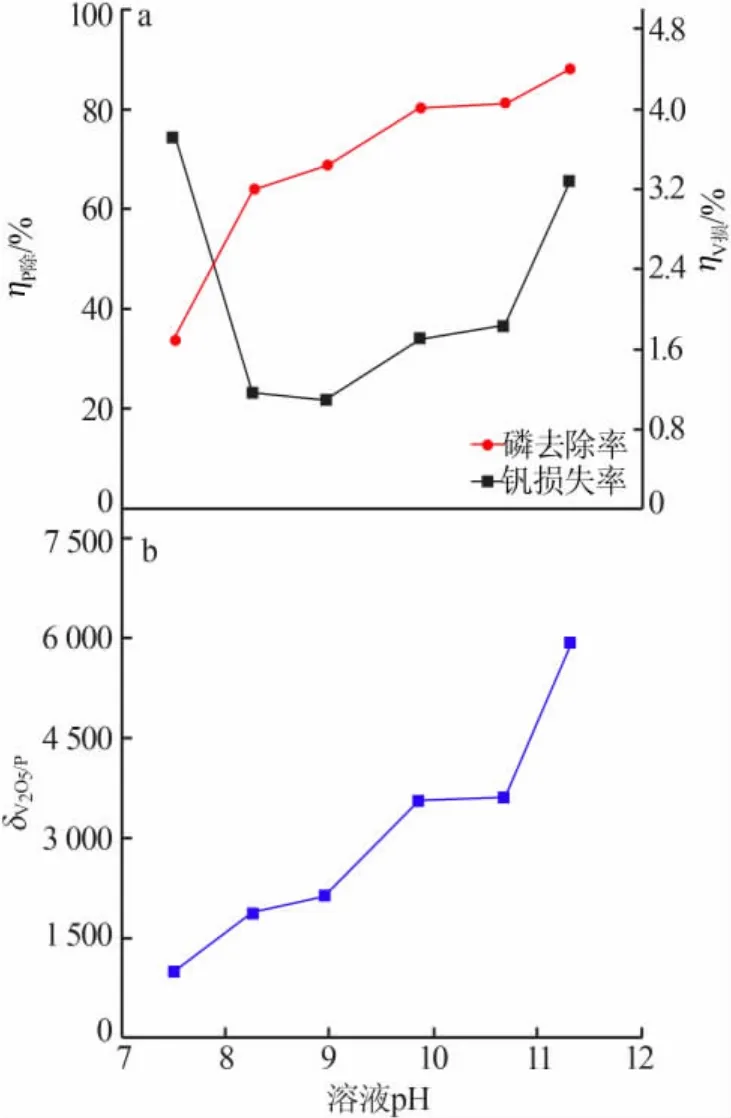
图3 溶液 pH 对 ηP除(a)、ηV损(a)、δV2O5/P(b)的影响
2.1.3 反应时间的影响
固定条件:CaSO4·2H2O与P物质的量比为5.3,溶液pH=9.0,反应温度为65℃。改变反应时间,考察反应时间对 ηP除、ηV损、δV2O5/P的影响,结果见图 4。由图4a看出,反应前15 min磷去除率增大较快,随着反应时间延长磷去除率趋于稳定,同时反应前15 min钒损失率也增大较快,随着反应时间延长钒损失率也趋于稳定。由此可以看出,CaSO4·2H2O除磷反应速度很快,反应15 min时磷去除率达到60%以上、钒损失率在1%左右,为使除磷反应更加充分,选择反应时间为30 min。从图4b看出,除磷后溶液中V2O5与P质量浓度比的变化趋势与除磷率变化趋势基本一致,反应30 min时V2O5与P质量浓度比为1 968,满足沉淀多钒酸铵的要求。
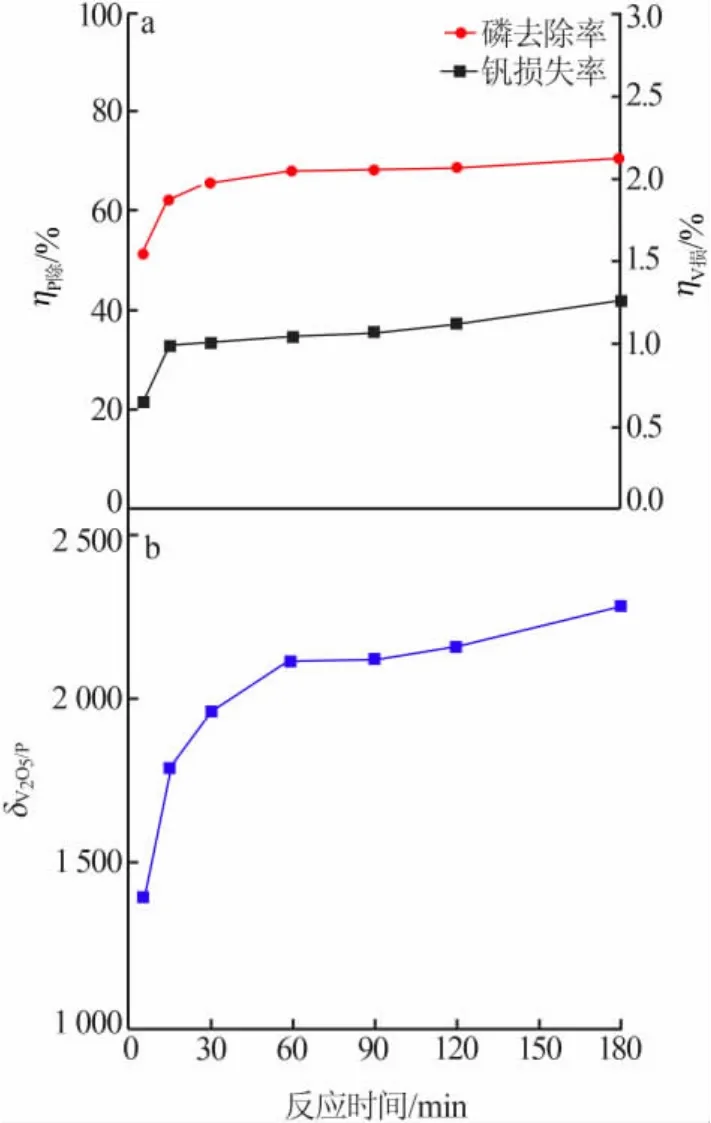
图4 反应时间对 ηP除(a)、ηV损(a)、δV2O5/P(b)的影响
2.1.4 反应温度的影响
固定条件:CaSO4·2H2O与P物质的量比为5.3,溶液pH=9.0,反应时间为30 min。改变反应温度,考察反应温度对 ηP除、ηV损、δV2O5/P的影响,结果见图 5。由图5a看出,反应温度在85℃以前磷去除率变化不大,继续增加反应温度磷去除率略有增大。反应温度在65℃以前钒损失率缓慢增大,继续增加反应温度钒损失率快速增大。分析原因可知,由于CaSO4·2H2O溶解度随温度变化不大,溶液中Ca2+浓度变化不大,因此温度增加磷去除率变化不大。钙与钒生成钒酸钙的反应是吸热反应[15],温度升高有利于钒酸钙的生成,所以高温时增大了钒损失率。从图5b看出,除磷后溶液中V2O5与P质量浓度比变化趋势与除磷率变化趋势基本一致,区别在于温度从85℃升高到95℃时,V2O5与P质量浓度比增大率远大于除磷率增大率,而95℃时钒损失率最大,说明钒损失量远小于除磷量,CaSO4·2H2O除磷过程钒损失量较少。由于温度对磷去除率影响不大,而且温度低时钒损失率小,因此选择反应温度为25℃,此时V2O5与P质量浓度比为2 375,满足沉淀多钒酸铵要求。

图5 反应温度对 ηP除(a)、ηV损(a)、δV2O5/P(b)的影响
2.2 除磷后沉钒效果
以最佳除磷工艺参数即CaSO4·2H2O与P物质的量比为5.3、溶液pH=9.0、反应时间为30 min、反应温度为25℃对表1溶液进行除磷,得到的除磷后溶液组成见表2。
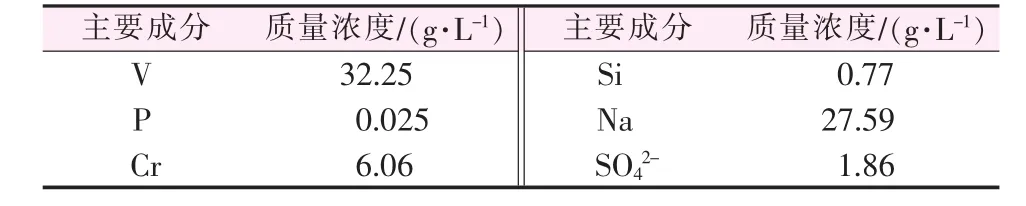
表2 除磷后溶液主要成分
采用表2的溶液结晶多钒酸铵,沉钒率为99.5%。多钒酸铵经水洗、烘干、煅烧得到V2O5,主要成分见表3。由表3看出,V2O5产品质量满足YB/T 5304—2011《五氧化二钒》中99级的质量要求。
3 结论
1)CaSO4·2H2O在碱性条件下除磷过程属于溶解-沉淀反应机制,CaSO4·2H2O可有效去除钒渣钠化焙烧熟料浸出液中的磷,同时钒损失较少、除磷速度快。最佳工艺条件:CaSO4·2H2O与P物质的量比为5.3,溶液pH=9.0,反应时间为30 min,反应温度为25℃。2)除磷后的钒渣钠化焙烧熟料浸出液,经沉钒、洗涤、煅烧得到五氧化二钒,沉钒率大于99%,产品质量满足YB/T 5304—2011《五氧化二钒》中99级的质量要求。
