含锂钾卤水体系降温过程研究
2019-12-12孙泽妍黄雪莉王雪莹
孙泽妍,黄雪莉,王雪莹
(新疆煤炭洁净转化与化工过程重点实验室,新疆大学化学化工学院,新疆乌鲁木齐830046)
中国的锂资源十分丰富,约为700万t,居世界前列,其中65%的锂资源赋存在卤水中[1]。目前钾、锂盐的生产工艺主要以蒸发、浓缩、结晶为主,而盐湖多处于干旱少雨地带,若通过蒸发结晶的方式提取盐类,将造成水的大量损失,从而引起生态破坏等严重问题。若能有效地利用冬季冷能,通过冷冻结晶的方法从盐湖中提取盐类,不仅可以降低生产成本,也可以减少对自然资源的消耗和环境污染。另外,常温下水盐体系复盐种类繁多,使生产过程中的分离工序繁琐;而低温下,部分复盐消失,有利于盐湖生产工艺的简化。因此,研究降温条件下卤水液相组成的变化和析盐规律以及水盐体系低温相平衡很有意义。高世扬等[2]通过对含硼浓缩盐卤水进行冷冻,获得一种含镁的硼酸盐,即六硼酸镁;朱巧丽等[3]研究了-15 ℃下 NaCl·2H2O 饱和时 Na+,K+,Mg2+∥Cl-,SO42--H2O五元体系的相平衡关系,发现在此温度下只存 在 KCl·MgCl·6H2O 一种复盐 ;廖玲等[4]研究了-15 ℃五元体系 Na+,K+∥Cl-,SO42-,NO3--H2O 的相平衡关系,与25℃相图相比,-15℃该体系相图大为简化;张霞等[5]针对新疆硝酸盐型卤水体系,研究了四元体系 Na+∥Cl-,SO42-,NO3--H2O 不同浓度卤水在自然降温和人工降温过程中的液相组成及析盐规律,发现在降温过程中液相组成的变化由盐的结晶速率共同决定;严雪鸿等[6]在张霞的基础上,研究了五元体系 Na+,K+∥Cl-,SO42-,NO3--H2O 在降温过程中离子含量的变化规律,发现位于硫酸盐结晶区的卤水,快速降温可避免复盐的析出;李青海等[7]通过实验得到南翼山油田原始卤水在-18.90℃到-30.90℃的结冰析盐过程;桑世华等[8]对西藏扎布耶盐湖冬季卤水-10℃冷冻后,得到了0℃等温蒸发下的析盐规律。笔者以不同组成特征的含Li+,Na+,K+∥Cl-,SO42-的卤水为研究对象,通过自然降温和人工降温获得其低温相变化规律,不仅为低温下盐湖工艺的开发提供理论指导,也为此五元水盐体系低温下相平衡的研究提供参考。
1 实验部分
1.1 试剂和仪器
试剂:氯化钠、氯化钾、一水硫酸锂、氯化锂,均为分析纯。
仪器:XTL-1型体视显微镜;D8 ADVANCE型X射线衍射仪(XRD);低温恒温搅拌仪;AA6300型原子吸收光谱仪。
1.2 实验方法
1.2.1 实验体系的选择与配制
选取5组具有代表性的盐湖卤水,包括西藏扎布耶盐湖、新疆罗布泊盐湖、青海东西台吉乃尔盐湖,具体数据见表1。前期研究表明,常温下含硫酸盐的卤水结晶规律复杂,低温下较为简单,同时Li+,Na+,K+∥Cl-,SO42--H2O 体系只有 25 ℃的相平衡数据较全。为更全面地考察降温过程中不同浓度组成卤水的变化情况, 采用 25 ℃的 Li+,Na+,K+∥Cl-,SO42--H2O 体系[9-10]。 选择 3 组特征饱和点 C、D、E 进行研究, 其中 C 点是 2Li2SO4·Na2SO4·K2SO4、NaK3(SO4)2和 KCl、NaCl 4 种盐的共饱点,D 点是 Li2SO4·H2O、LiCl·H2O 和 NaCl、KCl4 种盐的共饱点,E 点是 NaCl、Na2SO4、NaK3(SO4)2、2Li2SO4·Na2SO4·K2SO44 种盐的共饱点。C、D、E点的具体组成数据见表1。
按照以下相图指数计算公式计算出表1中所有体系的相图指数,标注出其在相图中的位置(见图 1)。 由于缺乏六元体系 Li+,Na+,K+,Mg2+∥Cl-,SO42--H2O的相图数据,故对于罗布泊、东西台吉乃尔卤水体系,相图指数计算时未计入Mg含量。相图指数计算方法:
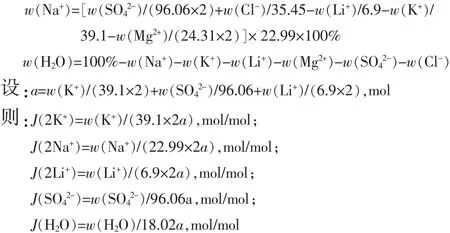
式中:w(离子)和w(H2O)分别为溶液中各离子和水的质量分数,%;J(离子)和J(H2O)分别为溶液中各离子和水的相图指数[mol/mol,以(2K++2Li++SO42+)计]。

表1 实验体系的组成 %
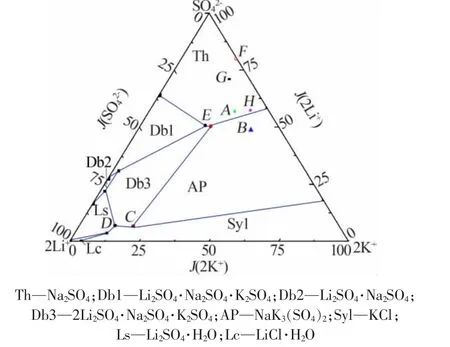
图1 实验体系的设置(均对NaCl饱和)
1.2.2 降温实验
根据表1中各实验体系的组成配制500 g样品溶液,置于室外低温环境(12月份,气温为-8~-16℃,风力≤3级)进行自然降温,每隔15 min搅拌一次,并使用温度计测量温度;或置于-18℃低温恒温搅拌容器中进行人工降温,每隔15 min搅拌一次,降温速度约为0.7℃/s。 当体系温度降至5、0、-5、-10、-15℃左右时,立即取上层清液,测定液相组成,并分离固相,进行固相鉴定。
1.3 化学分析方法[11]
K+用四苯硼钾重量法测定;Cl-用硝酸银容量法测定;SO42-用硫酸钡重量法或比浊法测定;Li+用原子吸收火焰发射光谱法测定;Mg2+用EDTA测定;Na+用差减法计算;固相采用体式显微镜、X射线晶体衍射综合鉴定。
2 结果与讨论
各实验体系自然降温与人工降温过程中液相组成溶解度数据列于表2。按照上述方法,同时计算出相图指数并列于表2。据此绘制出降温过程中液相组成的变化趋势(见图2)以及各离子含量的变化(见图 3)。
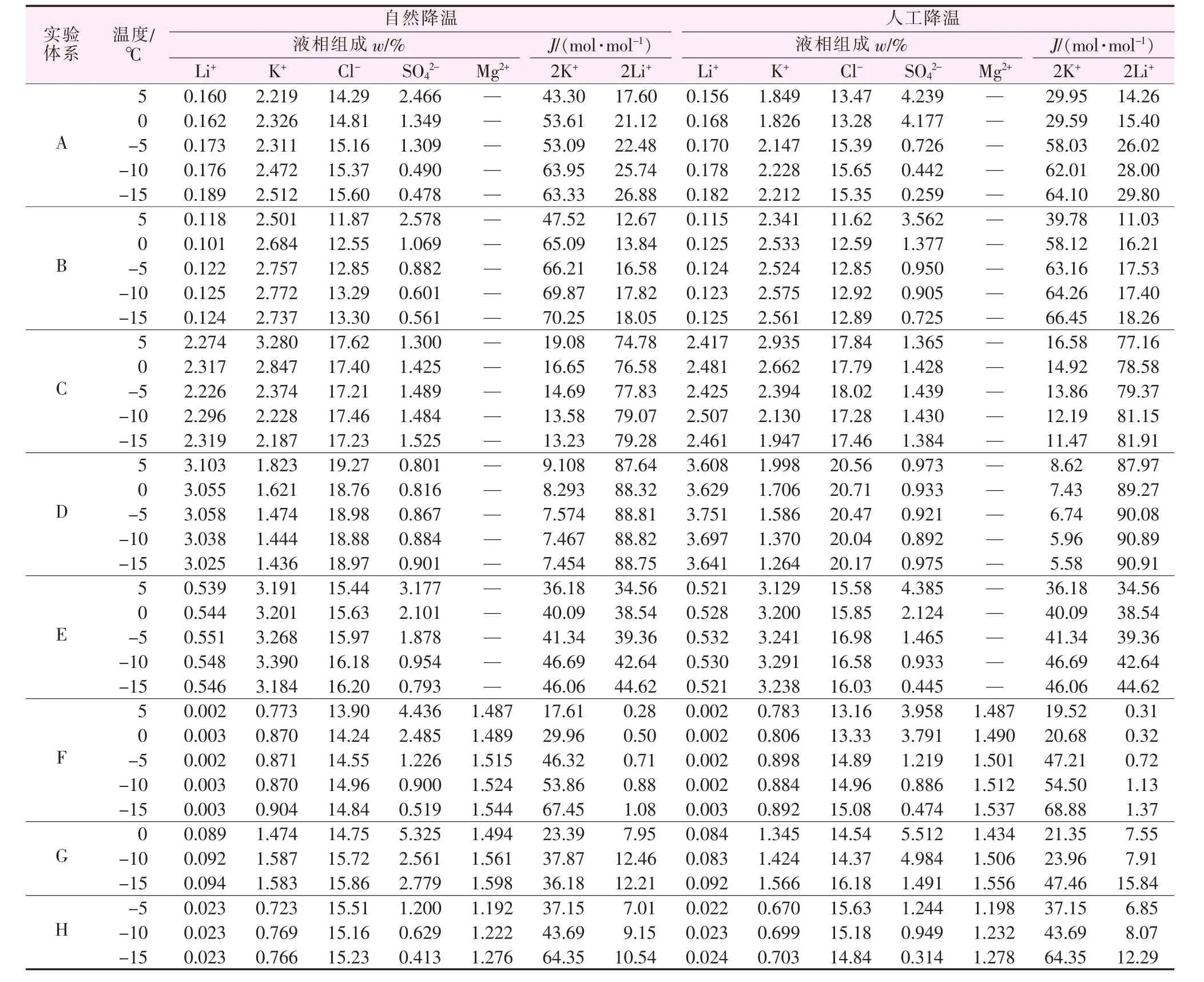
表2 各实验体系自然降温与人工降温过程中液相组成溶解度数据
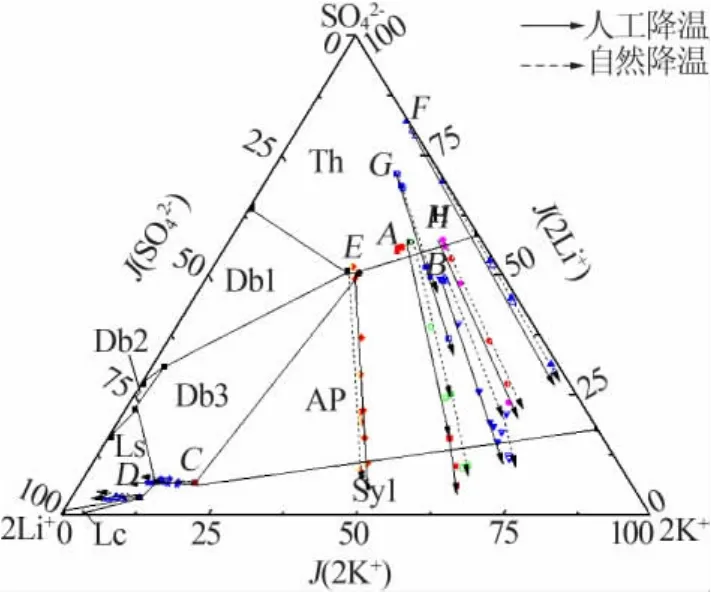
图2 各实验体系自然降温与人工降温过程中液相组成的变化
由以上数据得出结论:1)相同组成的实验体系,自然降温与人工降温的析盐规律基本相同,稍有差别。这是因为,自然降温条件下降温速度缓慢,所以各离子组分变化趋势相对于人工降温变化平缓。
2)对于硫酸盐含量较高的卤水 A、B、E、F、G、H体系,由表2和图3看出,在降温至-15℃的过程中,液相中的 SO42-含量持续减少;图 2 中,A、B、E、F、G、H液相组成变化趋势均为从硫酸根顶点出发的射线,表明硫酸钠析出,考虑到温度较低,硫酸钠应以十水形式析出,通过XRD谱图分析(见图4)以及其他离子含量的少量增加可以证实这一点。另外样品XRD谱图中并未发现固体氯化钠,说明上述体系中的氯化钠并没有完全饱和,或因为氯化钠的溶解度随温度的变化不大没有析出。
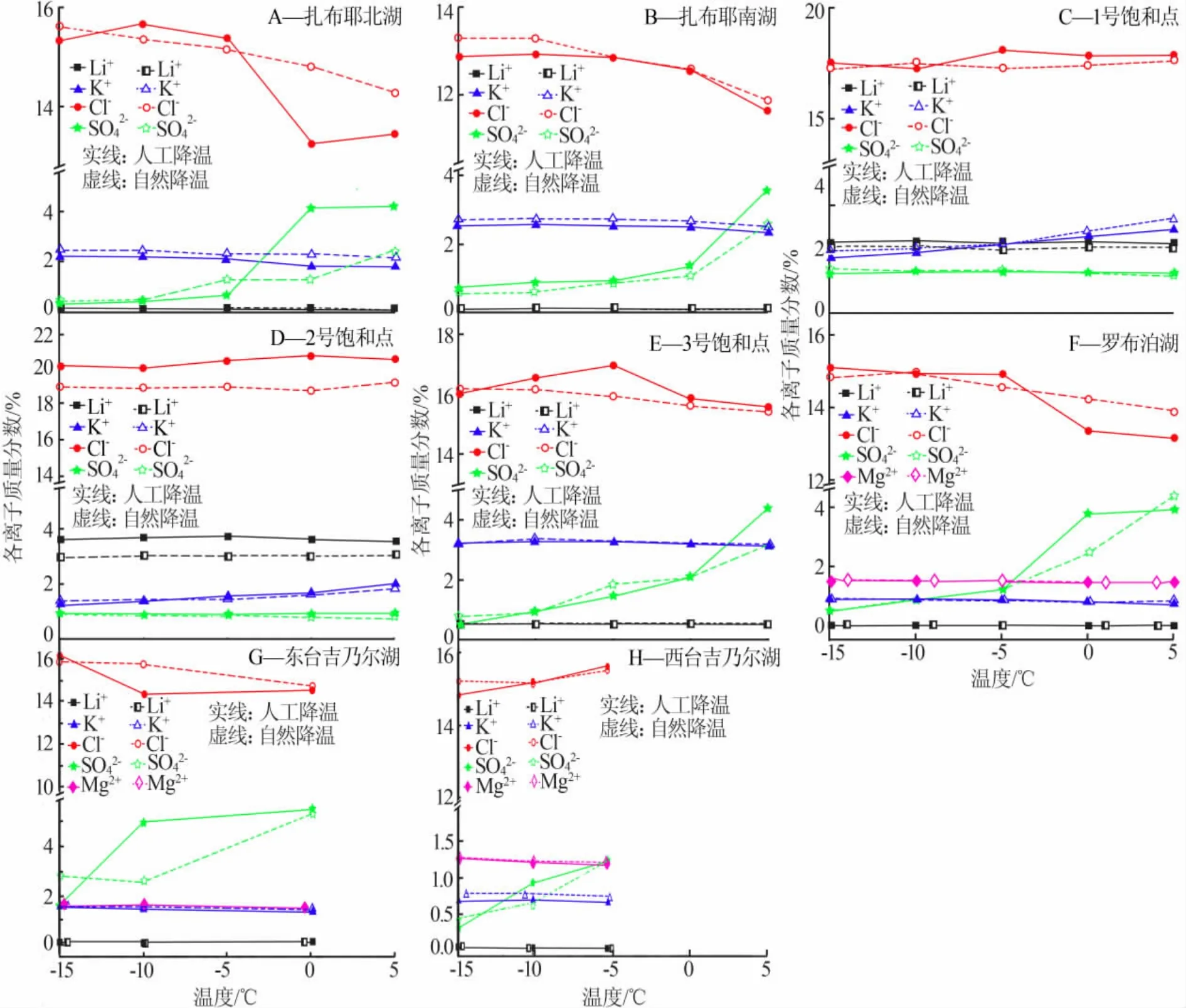
图3 各实验体系自然降温与人工降温过程中液相中各离子含量的变化
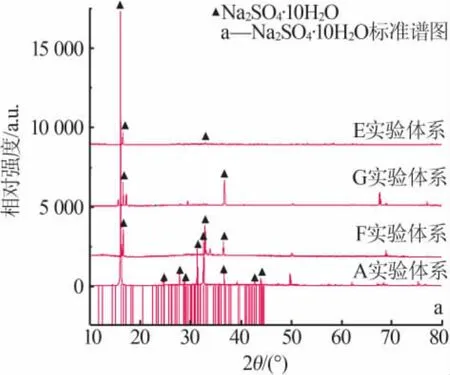
图4 A、E、F、G实验体系-15℃结晶固相XRD谱图
3)从25℃相图看,硫酸盐含量较高的卤水A、B、E、F、G、H 体系液相变化经过钾芒硝结晶区(AP),但是实验中钾芒硝并未析出,由图4也可以看出固相中无含钾晶体析出。文献[4]指出,随着温度的降低,含硫酸盐的水盐体系相图变得简单,硫酸盐型复盐结晶区消失。 因此可以推断, 在 Li+,Na+,K+∥Cl-,SO42--H2O体系中也存在类似的情况,低温下钾芒硝的结晶区缩小或消失。
4)实验体系C与D位于相图中两个四盐共饱点的位置,硫酸盐含量较低。随着温度的降低,溶液中的Cl-与K+含量逐渐减少,Li+与SO42-无明显变化,结合实验数据、相图以及固相鉴定(见图5)可知主要由氯化钾析出导致,由此可以推断25℃的Li+,Na+,K+∥Cl-,SO42--H2O 体系在-15 ℃时 Li2SO4·H2O结晶区会缩小,氯化钾结晶区左移。说明随着温度的降低,位于C、D二者共饱点附近区域的液相中会不断有氯化钾晶体析出,液相组成趋向于氯化锂或硫酸锂的结晶区,利于锂离子的富集。

图5 C、D实验体系-15℃结晶固相XRD谱图
3 结论
对于相同组成的实验体系,自然降温与人工降温的析盐规律基本相同,但是自然降温条件下离子组成变化趋势相对于人工降温变化趋势缓慢;硫酸盐含量较高的卤水,随着温度的下降溶液中的SO42-含量会发生明显下降,主要析出十水硫酸钠,有利于液相中钾、锂离子的富集。对于硫酸盐含量较低的卤水,随着温度的降低有NaCl及KCl析出,此过程中有利于Li+的富集。本工作为低温下盐湖工艺的开发提供理论指导, 也为 Li+,Na+,K+∥Cl-,SO42--H2O 五元水盐体系低温下的相平衡研究提供参考。
