胰体尾切除术中残端闭合与胰肠吻合的疗效对比
2019-12-11白锦峰陈章彬郭志唐王斌滕毅山
白锦峰,陈章彬,郭志唐,王斌,滕毅山
(昆明医科大学第二附属医院 肝胆胰外科三病区,云南 昆明 650101)
胰体尾切除术(distal pancreatectomy,DP)是良性或恶性胰体尾病变的标准术式,尽管很多研究表明术后总体死亡率低于5%,但其并发症发生率却高达24%~56%[1-2]。胰瘘(pancreatic fistula,PF)是DP术后最常见的并发症,可进一步引起腹腔感染、出血及肠梗阻等严重病变,是导致术后死亡的主要因素之一。因此如何处理DP术后胰腺残端与胰瘘等并发症的发生有着密切的联系。本研究通过回顾性分析我科收治的64例行胰体尾切除患者的临床资料,对不同胰腺残端的处理方式进行探讨。
1 资料和方法
1.1 一般资料
病例纳入与排除标准:入院后行增强CT及MRCP、肿瘤标记物等检查明确诊断为胰腺体尾部良恶性疾病,行开腹或腹腔镜下胰体尾切除术,并对其胰腺残端进行闭合或胰肠吻合术者。排除合并严重心、肺、脑疾病及自身免疫病患者;排除腹腔多次手术患者。共收集64例行胰体尾切除患者的临床资料。
根据胰体尾切除后残端处理方式分为残端闭合组与胰肠吻合组。闭合组(n=30):术前诊断慢性胰腺炎6例、胰腺囊肿4例,胰管结石2例,胰腺癌15例,胰腺内分泌瘤3例。胰肠吻合组(n=34):术前诊断慢性胰腺炎9例、胰腺囊肿5例,胰管结石1例,胰腺癌14例,胰腺内分泌瘤4例,胰腺淋巴瘤1例。对比分析两组患者资料,差异无统计学意义(P>0.05),见表1。

表1 两组患者一般资料比较
1.2 手术方法
胰腺残端闭合组:术中充分游离胰腺体尾部,选取相应的切割闭合器对远端胰腺进行离断,之后再使用Prolene线对胰腺近端进行交锁褥式缝合(见图1~2)。胰肠吻合组:术中充分游离胰腺体尾部,使用钝性分离或电刀电凝切断胰腺组织,在距离屈氏韧带15~20 cm处离断空肠,将空肠远端移至胰腺残端处,使用Prolene线行端端套入式吻合,尽可能将胰腺残端与空肠壁贴近,覆盖胰腺残端表面,不留死腔。再将近端空肠与距胰肠吻合口30~40 cm处行空肠端侧吻合,如图3。

图1 切割闭合器离断胰腺
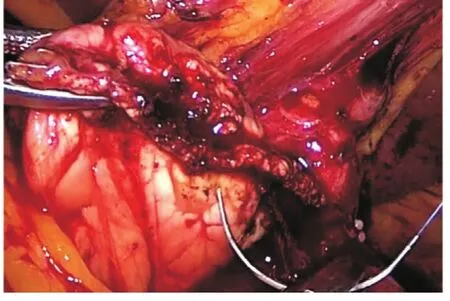
图2 Prolene线对胰腺近端进行止血缝合

图3 胰腺空肠端端吻合
1.3 术后处理及观察
两组患者均在胰腺闭合残端或胰肠吻合口放置腹腔引流管,术后予以奥曲肽、质子泵抑制剂,短期抗生素预防感染等治疗。
观察并记录两组手术时间、术中出血量、术后胰瘘、出血等并发症、住院时间及总住院费用等。其中通过引流液测定术后3 d、5 d、7 d胰腺断面积液淀粉酶,并结合患者临床表现来判断是否存在胰瘘,一旦发现胰瘘,则立即通过腹腔引流管进行生理盐水负压吸引冲洗胰腺断面2~3 d,减轻胰液对周围组织的进一步腐蚀,促进胰腺断面愈合。
国际胰瘘学组(ISGPF)对于胰瘘的定义为:术后3 d积液淀粉酶超过正常血淀粉酶水平3倍以上或大于300 IU/L[3],可视为胰瘘,且根据其对患者的影响分为三个等级:A级(无影响)、B级(一般影响)和C级(严重影响)。
1.4 统计学分析
利用SPSS 21.0软件对两组患者手术时间、术中出血量、术后胰瘘率、住院时间、住院总费用等数据进行分析。其中计量资料采用(±s)表示,进行t检验;计数资料采用例(%)表示,进行χ2检验,P<0.05表示差异有统计学意义。
2 结果
比较两组数据:胰肠吻合组术后胰瘘发生率明显低于残端闭合组(P<0.05);比较两组胰瘘分级、术中出血量、术后出血等并发症,差异无统计学意义(P>0.05);另对于手术时间、总住院天数、住院总费用的比较,胰肠吻合组均大于残端闭合组(P<0.05),见表2。

表2 两组术中及术后相关指标比较
闭合组:11例患者术后发生胰瘘,胰瘘率为36.7%,其中A级胰瘘8例,予以胃肠减压、延长持续腹腔引流时间后均平稳出院;B级胰瘘3例,予以静脉持续微量泵入生长抑素、全胃肠外营养(TPN)支持治疗及使用生理盐水腹腔持续负压冲洗治疗后,成功治疗2例,另1例由于腹腔引流管阻塞,于B超引导下行经皮穿刺引流后带管出院,1个月后返院拔除引流管,并未诱发其余严重并发症。
胰肠吻合组:5例患者术后发生胰瘘,胰瘘率为14.7%,其中A级胰瘘3例,延长持续腹腔引流时间后均好转;B级胰瘘2例,同样予以持续微量泵入生长抑素、TPN支持治疗及生理盐水腹腔持续负压冲洗治疗后均好转。
3 讨论
胰体尾切除术(DP)目前较常用于胰腺外伤、体尾部良恶性肿瘤及内科保守治疗效果不明显的胰腺炎等多种疾病,其在胰腺手术方面是一种死亡率与并发症相对较少的术式[4]。随着临床水平与手术技术的不断发展,胰体尾切除术也变得越来越成熟。但术后胰瘘仍然是胰体尾切除术后最为常见的并发症,发生率波动于10%~50%[5]。DP术后胰瘘的发生跟胰腺残端吻合技术、胰腺质地、胰管直径等很多因素有着密切的联系。其中残端处理方式的优劣在很大程度上决定着术后并发症是否产生。目前,DP术后胰腺残端的处理方式主要包括残端离断技术和残端闭合技术。其中使用切割闭合器并手工加强缝合残端与胰肠吻合方式在临床上较为常见,本文通过回顾性分析64例DP术中分别使用该两种残端处理方式患者的临床资料,对其手术效果及相关效益进行讨论。
有研究报道,DP术中来自切割表面的胰腺小分支的胰液外渗通常是术后发生胰瘘的潜在因素,胰腺远端切除后胰腺-空肠端端吻合能有效控制切割面的渗漏[6-7],从而能有效减少术后胰瘘的发生。本文研究中,胰肠吻合组与残端闭合组相比具有更低的胰瘘率(14.7%vs36.7%),且差异有统计学意义(P<0.05)。34例胰肠吻合组发生胰瘘的5名患者胰腺质地均较软,而胰腺质地硬者均无胰瘘发生,这可能是由于慢性胰腺炎等导致胰腺组织纤维化,胰管不同程度的扩张,使术中对于硬胰腺残端的处理变得相对简单,从而降低了胰瘘的风险,也与Bassi等[8]、Hwang等[9]认为软胰腺是DP术后胰瘘的危险独立因素的观点相符。相对于胰腺残端闭合来说,胰肠吻合的手术难度相对较大,缝合结扎过紧容易撕裂胰腺组织,切断胰腺小分支造成胰瘘,若缝合间隔过大,胰液则可从针尖距间溢出,造成严重后果,因此对于外科医师的手术技术更加严格。但该术式的优点在于可以通过空肠将胰腺残端包裹住,使术中胰腺残端未闭合的小分支分泌的胰液全部流入肠道中,从而可有效减少相关的并发症。
本研究中可看出残端闭合组术后胰瘘发生率相对较高,其中包括软胰腺7例,硬胰腺4例,可能由于术后胰腺残端组织断裂坏死或血流紊乱所引起。有研究报道,对于胰腺较硬或者较厚的患者,切割闭合器往往不能实现残端的完全压缩或封闭[10],并且在闭合器对胰腺体尾部进行切割闭合后,常无法准确定位到残端主胰管位置将其结扎,因此加用手工对胰腺残端进行加强缝合,以关闭残留的胰管小分支。但该术式的缺点在于联合封闭缝合极易造成残端胰腺组织坏死,从而造成胰瘘。该组胰瘘患者因漏出胰液并未经小肠液等进一步激活,多为单纯性胰瘘,其中8例通过胃肠减压、延长持续腹腔引流时间等方式,腹腔内网膜等组织很快将其包裹,形成稳定的包裹性积液,胰瘘逐渐好转;另外3例予以静脉持续微量泵入生长抑素、全胃肠外营养(TPN)支持治疗及使用生理盐水腹腔持续负压冲洗治疗后,成功治愈。有部分学者认为胰腺残端闭合后应用大网膜、镰状韧带、胃或空肠浆膜包裹可在一定程度上降低胰瘘的发生率[11-12]。另外,在B/C级胰瘘方面,两组比较差异并不明显。
在术后出血方面,闭合组中有1例患者术后出现腹腔少量出血,考虑腹膜间隙微小血管渗血,经使用止血药物等保守治疗后好转;胰肠吻合组中有1例患者术后1周出现腹腔大量出血,急诊行介入血管造影栓塞术发现其为肠系膜上动脉胰腺动脉分支血管破裂出血,经积极治疗后得以控制,考虑由于胰瘘后胰液腐蚀血管造成血管破裂引起;另1例可能为脾窝附近微血管出血,予以输血、止血药物等保守治疗后好转。虽然两组术后出血方面统计学差异不明显,但胰肠吻合组漏出胰液中的胰酶与小肠液混合后进一步激活,其强腐蚀性更容易损伤周围血管与组织,胰瘘的危险度相对更大。另外,对于两组手术时间、总住院天数、住院总费用的比较,胰肠吻合组均大于残端闭合组,且差异有统计学意义(P<0.05)。究其原因,胰肠吻合组术中行肠道更变,手术时间相对延长,术后早期肠内营养摄入、胃肠功能恢复对于闭合组来说相对较晚,住院天数较长,故而增加了住院总费用。最后,本文也有一些不足之处,比如样本量较少,不同医师手术存在一定差异造成偏倚等,需要多中心、大样本统计进一步研究。
