肝硬化及肝硬化合并糖尿病患者肠道微生态研究
2019-12-09凌海燕陈冻伢
凌海燕 陈冻伢

[摘要] 目的 探讨肝硬化及肝硬化合并糖尿病患者肠道微生态状况。 方法 选择2016年1月~2018年6月在医院诊断治疗的肝硬化患者60例为研究对象,其中肝硬化30例,肝硬化合并糖尿病30例,另选择健康体检者30例为对照组。比较三组粪便pH值与细菌比浊度,肠道类杆菌、双歧杆菌、梭状芽孢菌、大肠杆菌、肠球菌、真杆菌-球形梭菌水平,比较不同Child-Pugh分级患者类杆菌、双歧杆菌、梭状芽孢菌、大肠杆菌、肠球菌、真杆菌-球形梭菌水平。 结果 肝硬化合并糖尿病组pH值显著高于肝硬化组与对照组,差异有统计学意义(P<0.05);肝硬化组显著高于对照组,差异有统计学意义(P<0.05)。肝硬化合并糖尿病组类桿菌、双歧杆菌、梭状芽孢菌、大肠杆菌、肠球菌、真杆菌-球形梭菌水平显著低于肝硬化组与对照组,差异有统计学意义(P<0.05);肝硬化组显著低于对照组,差异有统计学意义(P<0.05)。肝硬化组与肝硬化糖尿病组不同Child-Pugh分级患者6种细菌计数水平比较,差异无统计学意义(P>0.05)。 结论 肝硬化与肝硬化合并糖尿病患者肠道微生态异常,尤其以合并糖尿病的患者变化更明显。
[关键词] 肝硬化;糖尿病;肠道微生态;肝硬化合并糖尿病
[中图分类号] R575.2;R587.1 [文献标识码] A [文章编号] 1673-9701(2019)28-0012-04
[Abstract] Objective To explore the intestinal microecology of patients with liver cirrhosis and cirrhosis complicated with diabetes. Methods Sixty patients with cirrhosis diagnosed and treated in our hospital from January 2016 to June 2018 were enrolled, including 30 patients with cirrhosis and 30 patients with cirrhosis and diabetes. Another 30 healthy subjects were selected as the control group. The pH values of feces and the turbidity of the bacteria were compared, as well as the levels of Enterobacter, Bifidobacterium, Clostridium, Escherichia coli, Enterococcus, and Eubacterium-Clostridium globi. The levels of Bacteroides, Bifidobacterium, Clostridium, Escherichia coli, Enterococcus, and Eubacterium-Clostridium globi were compared between different Child-Pugh grades. Results The pH value of cirrhosis and diabetes group was significantly higher than those of the cirrhosis group and control group(P<0.05), and that of the cirrhosis group was significantly higher than that of the control group, the differences were statistically significant(P<0.05). The levels of Enterobacter, Bifidobacterium, Clostridium, Escherichia coli, Enterococcus, and Eubacterium-Clostridium globi were significantly lower in the cirrhosis and diabetes group than those in the cirrhosis group and control group, and those of the cirrhosis group were significantly lower than that of the control group, the differences were statistically significant(P<0.05). There was no significant difference in the levels of six bacterial counts between the cirrhosis group and the cirrhosis and diabetes group(P>0.05). Conclusion The intestinal micro-ecology of patients with cirrhosis and cirrhosis plus diabetes is abnormal, especially in patients combined with diabetes.
[Key words] Cirrhosis; Diabetes; Intestinal microecology; Cirrhosis with diabetes
肝硬化是常见的慢性进行性肝病,由一种或多种病因长期或反复作用形成的弥漫性肝损害,晚期出现上消化道出血、肝性脑病、继发感染等并发症。1987年世界卫生组织提供的数字显示肝硬化人群平均发病率大约17.1/10万,在我国肝硬化发病率占同期住院患者总数的1%左右,以肝炎病毒感染后肝硬化最多见。有研究显示肝硬化患者肠道微生态发生变化,肠道中6种细菌数量以及构成比发生变化[1]。肠道微生态环境变化可导致肠腔pH值水平升高,增加肝性脑病等严重并发症的发生[2]。有研究显示,肠道微生态与2型糖尿病的发生及发展也有密切关系[3]。本研究分析肝硬化以及肝硬化合并糖尿病患者肠道微生态状况,现报道如下。
1 资料与方法
1.1 一般資料
选择2016年1月~2018年6月在医院诊断治疗的肝硬化患者60例为研究对象,其中肝硬化30例,肝硬化合并糖尿病30例。纳入标本[4]:肝硬化诊断明确,合并2型糖尿病或未合并2型糖尿病,年龄≥18周岁,性别不限,依从性好,对本次研究知情同意。排除标准[4]:患有心血管、呼吸等其他系统器质性病变,恶性肿瘤,2周内应用抗生素、益生菌、激素等影响肠道微生态药物。肝硬化组30例,其中男18例,女12例,年龄39~77岁,平均(53.1±6.2)岁;慢性乙型肝炎肝硬化21例,酒精性肝硬化6例,自身免疫性肝硬化2例,慢性丙型肝炎肝硬化1例。肝硬化并糖尿病者30例,其中男16例,女14例,年龄40~77岁,平均(52.8±6.8)岁;慢性乙型肝炎20例,酒精性肝硬化5例,自身免疫性肝硬化3例,慢性丙型肝炎肝硬化2例。另选择健康体检者30例为对照组,其中男15例,女15例,年龄35~75岁,平均(53.0±5.9)岁。三组一般资料比较,差异无统计学意义(P>0.05)。
1.2检测方法
收集新鲜粪便,置于无菌盒,-80℃冻存待测。采用精密度酸度计(北京新骉仪器)测定粪便的pH值。取粪便0.5 g,加入4.5 mL等渗盐水中,震荡混匀5 min,1000转/min离心2 min,取上清0.2 mL,加入等渗盐水至2 mL,采用比浊仪测定比浊度。取粪便0.5 g,加过滤处理过的磷酸盐缓冲液(普诺赛生物)4.5 mL。漩涡震荡混匀,1000转/min离心2 min,取上清1 mL,加入4%多聚甲醛溶液(北京雷根生物技术有限公司)3 mL中固定,4℃过夜,分装,固定处理,溶菌酶稀释缓冲液消化10 min,0.1%焦炭酸二乙酯水溶液清洗3次,自然干燥,将浓度为1.0 μg/mL的探针100 μL均匀加之涂片表面,50℃恒温箱杂交12 h,漂洗缓冲液50℃漂洗30 min,超纯水快速漂净,自然干燥。LCSM观察,计数每个视野中细菌荧光信号,计数细菌数。
1.3 观察指标
比较三组粪便pH值及细菌比浊度、肠道类杆菌、双歧杆菌、梭状芽孢菌、大肠杆菌、肠球菌、真杆菌-球形梭菌水平;肝硬化合并糖尿病组以及肝硬化组不同Child-Pugh分级患者6种细菌计数水平。Child-Pugh分级[5]:将患者一般状况、腹水、血清胆红素、血清白蛋白浓度及凝血酶原时间的不同状态分为三个层次,分别计1、2和3分,并将5个指标计分进行相加,总和最低分为5分,最高分为15分;A级:5~6分;B级:7~9分;C级:≥10分。
1.4 统计学方法
采用SPSS15.0统计学软件对数据进行分析,计数资料采用χ2检验,计量资料采用均数±标准差(x±s)表示,采用t检验或F检验。P<0.05为差异有统计学意义。
2 结果
2.1 三组粪便pH值与细菌比浊度比较
见表1。肝硬化合并糖尿病组pH值显著高于肝硬化组与对照组,差异有统计学意义(P<0.05);肝硬化组显著高于对照组,差异有统计学意义(P<0.05)。三组细菌比浊度比较,差异无统计学意义(P>0.05)。
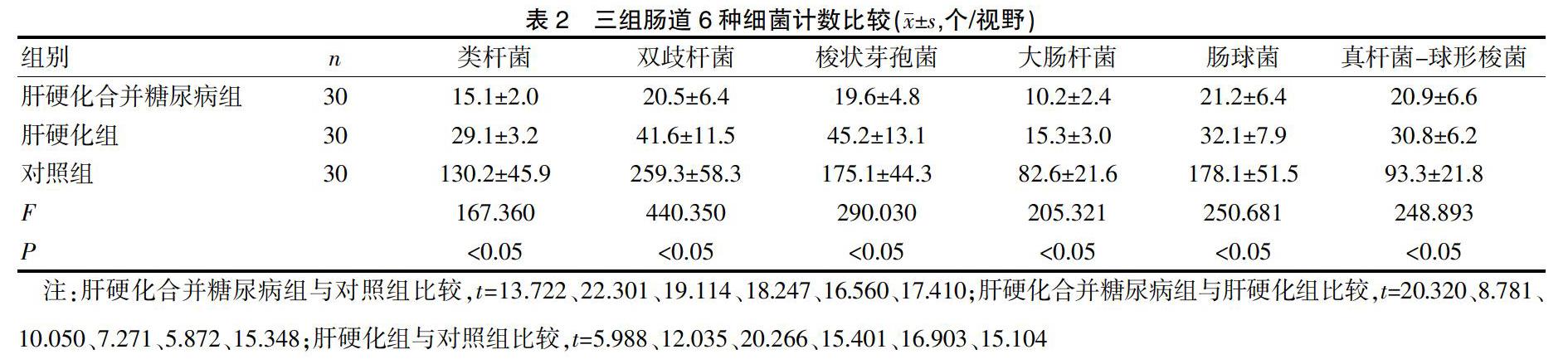
2.2 三组肠道6种细菌计数比较
见表2。肝硬化合并糖尿病组类杆菌、双歧杆菌、梭状芽孢菌、大肠杆菌、肠球菌、真杆菌-球形梭菌水平显著低于肝硬化组与对照组,差异有统计学意义(P<0.05);肝硬化组类杆菌、双歧杆菌、梭状芽孢菌、大肠杆菌、肠球菌、真杆菌-球形梭菌水平显著低于对照组,差异有统计学意义(P<0.05)。
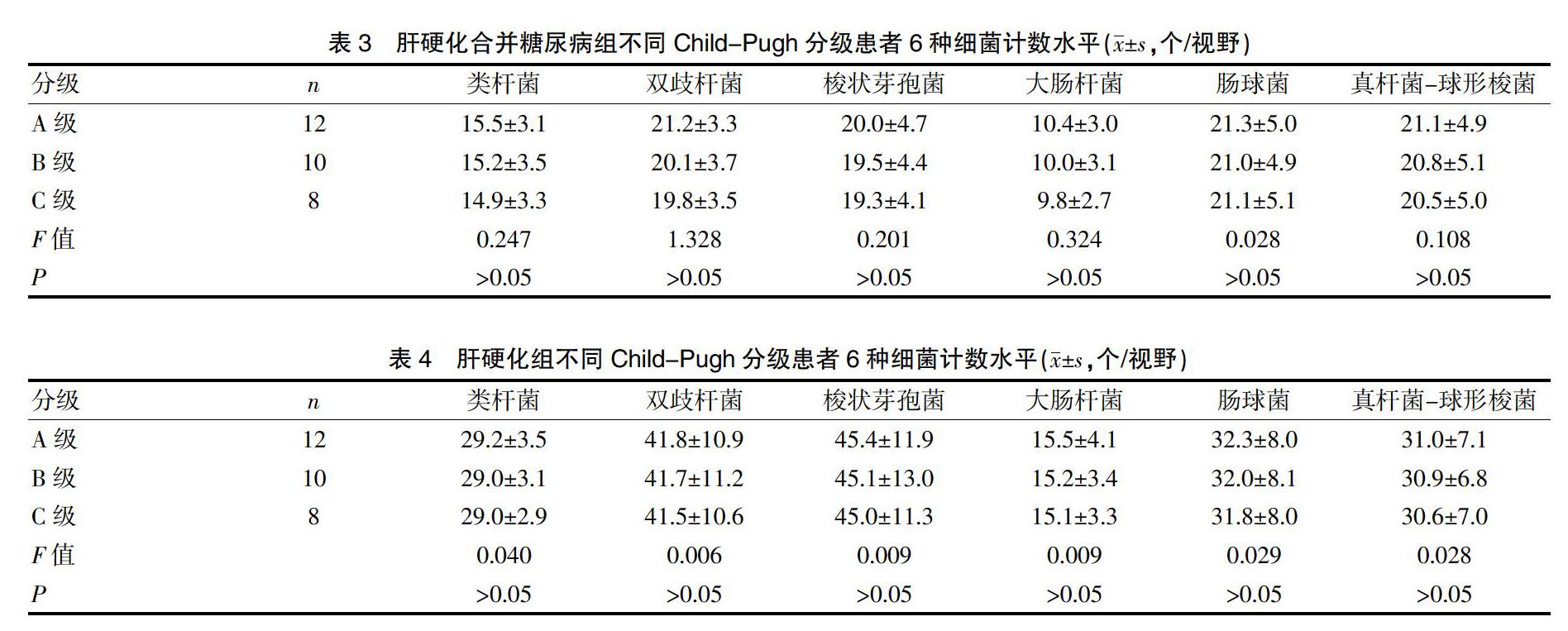
2.3 肝硬化合并糖尿病组不同Child-Pugh分级患者6种细菌计数水平
见表3。肝硬化合并糖尿病组不同Child-Pugh分级患者6种细菌计数水平比较,差异无统计学意义(P>0.05)。
2.4 肝硬化组不同 Child-Pugh分级患者6种细菌计数水平
见表4。肝硬化组不同Child-Pugh分级患者6种细菌计数水平比较,差异无统计学意义(P>0.05)。
3讨论
肠道微生态包括肠道固有菌群、肠上皮细胞、肠道黏膜免疫系统。人体肠道内寄生着10万亿个细菌,它们能影响体重和消化能力、抵御感染和自体免疫疾病的患病风险,还能控制人体对癌症治疗药物的反应。肠道正常菌群能合成多种人体生长发育必需的维生素,如B族维生素(维生素B1、B2、B6、B12)、维生素K、烟酸、泛酸等,还能利用蛋白质残渣合成必需氨基酸,如天冬门氨酸、苯丙氨酸、缬氨酸和苏氨酸等,并参与糖类和蛋白质的代谢,同时还能促进铁、镁、锌等矿物元素的吸收。这些营养物质对人类的健康有着重要作用,一旦缺少会引起多种疾病。完整的肠上皮细胞与细胞间紧密连接是肠道第一道防线。肠道黏膜免疫系统包括Peyers斑、黏膜固有层和上皮内的免疫位点。人类与微生物之间的动态平衡称为微生态平衡,影响其微生态平衡的因素有外环境因素,也有宿主因素。外环境主要是通过改变宿主的生理功能产生的,如有益菌菌群,通过产生细菌素、抗生素和其代谢产物及争夺营养、争夺空间以阻止过路菌群入侵,保持自身的稳定性。肠道微生态平衡时,可以保持宿主的正常生理功能,如营养、免疫、消化等。生态失调可因慢性病、癌症、手术、辐射感染、抗生素不合理应用等引起。肠道有庞大、复杂的微生态系统,也是人体最大的贮菌库与内毒素池。
肝脏与肠道菌群通过门静脉及淋巴管在解剖上有密切的联系,同时在生理功能上建立不可分割的相互关联[6,7]。肠道菌群提供VitK等促进肝凝血因子合成、提高肝脏枯否氏细胞数量及功能,肝脏通过分泌sIgA、胆汁酸等维持肠道菌群生态平衡[8,9]。肝硬化时肠道微生态失衡,肠杆菌、葡萄球菌以及梭菌显著增加,双歧杆菌、乳酸杆菌等有益厌氧菌减少,导致肠道微生态失衡,与肝硬化的病因无关[10,11]。有学者认为这些变化与肝硬化Child-Pugh分级的严重程度有关。在本次研究中,不同的Child-Pugh分级患者类杆菌、双歧杆菌、梭状芽孢菌、大肠杆菌、肠球菌、真杆菌-球形梭菌水平没有显著差异,可能与纳入样本量少有关,期待今后的研究中加大样本量,进一步研究。肝硬化患者胆汁分泌减少或成分改变,低蛋白血症,门脉高压,免疫力下降,加上抗生素、制酸剂的不合理应用,这些均会对患者的肠道微生态产生严重影响[12,13]。肠道菌群失调在肝硬化并发症例如细菌感染、肝性脑病、内毒素血症的发生、发展过程中发挥重要的作用[14]。70%~80%为革兰阴性杆菌以大肠埃希菌为主,是自发性腹膜炎、尿路感染、肺炎的主要病原菌。细菌易位是细菌与细菌产物从肠腔进入肠系膜淋巴结和其他肠外器官与部位,是肝硬化患者发生自发性细菌性腹膜炎与内毒素血症的关键步骤。宿主免疫功能下降,革兰阴性菌过度生长,肠黏膜屏障受损宿主免疫防御机制受损占主导地位,大量研究表明肠道细菌易位与自发性腹膜炎的发生发展密切关系[15]。对自发性腹膜炎的流行病学调查显示,有超过23%的肝硬化腹水患者发生自发性腹膜炎,社区获得性自发性腹膜炎以革兰阴性菌为主,医院获得性以革兰阳性菌为主,70%发生在Child C级患者。
氨中毒学说和假神经递质学说是目前公认的肝性脑病的发病机制。肠道菌群失调导致有益菌产生的短链脂肪酸减少,pH值升高,当肠道处于碱性环境时,肠道吸收氨增加,同时有害菌过度生长,胺、氨等肠源性毒物浓度升高,均可诱发肝性脑病的发生[16-18]。在本次研究中,肝硬化患者以及肝硬化合并糖尿病患者肠道pH值显著高于对照组,并且肝硬化合并糖尿病患者升高更为明显,这也提示患者存在肠道微生态平衡紊乱,并且增加发生肝性脑病的风险。肠道是机体最大的内毒素池,正常情况下到达肝脏低水平的内毒素对于提高机体的免疫功能是有益的。肝脏枯否细胞数量与肝功能下降,内毒素清除能力下降,肠道细菌过度生长,通常为革兰阴性肠杆菌,肠壁屏障功能受损,通透性增加,这些均可增加肠源性内毒素血症。肝硬化与内毒素血症形成恶性循环,菌群失调,大量内毒素入血导致内毒素血症,而后者诱导一系列细胞因子并产生级联反应,导致肝功能持续性损害,导致肝功能进一步恶化。
在本次研究中,检测肠道类杆菌、双歧杆菌、梭状芽孢菌、大肠杆菌、肠球菌、真杆菌-球形梭菌六种细菌。类杆菌是革兰阴性多形性杆菌,专性厌氧,正常寄居于人和动物的肠道、口腔、上呼吸道和生殖道,比肠内的大肠杆菌多100~1000倍,在临床标本中,为阑尾炎和败血症的常见菌。双歧杆菌是一种革兰阳性、不运动、细胞呈杆状、一端有时呈分叉状、严格厌氧的细菌属,广泛存在于人和动物的消化道、阴道和口腔等环境中。双歧杆菌作为一种生理性有益菌,对人体健康具有生物屏障、营养作用、抗肿瘤作用、免疫增强作用、改善胃肠道功能、抗衰老等多种重要的生理功能。双歧杆菌和乳酸菌等有益细菌则能抑制人体有害细菌的生长,抵抗病原菌的感染,合成人体需要的维生素,促进人体对矿物质的吸收,产生醋酸、丙酸、丁酸和乳酸等有机酸刺激肠道蠕动,促进排便,防止便秘以及抑制肠道腐败作用、净化肠道环境、分解致癌物质、刺激人体免疫系统,从而提高抗病能力等方面有着重要作用。双歧杆菌具有调节肠道菌群的作用。梭状芽孢菌也是肠道常见菌,大多的梭状芽孢菌能够与机体保持共生关系,产生各种酶降解不能被机体消化的多糖和寡糖,这些化合物被降解所产生的终产物包括乙酸、丙酸以及丁酸,能调节肠道pH值。大肠杆菌是革兰阴性短杆菌,是人和动物肠道中的正常栖居菌。在正常情况下大肠杆菌能竞争性抵御致病菌的进攻,同时还能帮助合成维生素K2,与人体是互利共生的关系。肠球菌为革兰阳性(G+)球菌,广泛分布于自然环境及人和动物消化道内。在本次研究中,肝硬化患者肠道类杆菌、双歧杆菌、梭状芽孢菌、大肠杆菌、肠球菌、真杆菌-球形梭菌均显著下降,提示患者存在明显的肠道菌群失调,尤其是合并糖尿病的患者,下降更显著。糖尿病是肝硬化的常见并发症之一,是体内胰岛素活性绝对或者相对不足,或者人体组织对胰岛素敏感性下降所引起的代谢性疾病,两者均为慢性疾病,肝病导致糖代谢紊乱,糖尿病使肝糖原减少,两者互相影响。既往研究显示[19],2型糖尿病患者肠道中会出现一定的菌群失调,而肠道菌群失调也可能是2型糖尿病的发病机制之一。在刘保文[20]的研究中,肝硬化患者与肝硬化合并糖尿病患者的肠道菌群结构有很大的相似性,表现在菌群门纲目科属五大水平中的组成成分大致相同,同时也存在各自的差异性,差异性表现在门纲目科属五大水平中菌群所占比例,其中发现肝硬化合并糖尿病患者肠道中的致病菌所占比例更多,菌群失调情况严重,不同病因患者菌群不存在差异,肝硬化患者肠道菌群中紫单胞菌科与Child-Puch评分呈负相关,韦荣氏球菌呈正相关。在本次研究中,肝硬化患者Child-Puch分级与所检测的几种菌均无显著相关性。
综上所述,肠道是人体最大的贮菌库与内毒素池,肝硬化患者出现明显的肠道微生态失衡,尤其是合并糖尿病的肝硬化患者,这可能增加肝硬化相关并发症的发生。
[参考文献]
[1] 吴旭、吴云峰,毛朝亮,等.肝硬化患者肠道微生态的变化[J].世界华人消化杂志,2012,20(26):2491-2495.
[2] 吴旭,吴晓,卢群,等.肝硬化患者肠道微生态的初步研究[J].中華肝脏病杂志,2012,20(11):817-821.
[3] 汪菲,曾强,李春霖.肠道菌群在肥胖与糖尿病干预中的作用研究进展[J].海南医学院学报,2017,26(13):1877-1880.
[4] 袁杰利.肠道微生态与健康[M].沈阳:辽宁科学技术出版社,2012:215.
[5] 贾继东,李兰娟.慢性乙型肝炎防治指南(2010年版)[J].中华肝脏病杂志,2011,19(1):13-24.
[6] 周艺敏,王健,肠道菌群在肝硬化中的作用[J].实用临床医学(江西),2016,17(1):89-91.
[7] 肖丹,贾业贵.双歧三联活菌辅助治疗对肝硬化患者肠道菌群、血浆内毒素及肠黏膜屏障功能的影响[J].药物流行病学杂志,2016,25(6):339-341.
[8] 王慧,李静,李锦绣,等.双歧杆菌四联活菌片对肝硬化患者肠道菌群、血浆内毒素及肝功能的影响[J].临床医学,2017,37(2):76-78.
[9] 黄晓宇,李刚平,寇继光,等.肝硬化患者肠道菌群失调与Child-Pugh分级的关系[J].临床肝胆病杂志,2015, 31(3):392-395.
[10] 赵欣,赵彩彦.肠道菌群失调在慢性肝病发病中的作用研究进展[J].实用肝脏病杂志,2014,17(1):106-108.
[11] 石勇明,周祖模,陈林.肝硬化患者益生菌干预效果及肠道菌群变化分析[J].中国微生态学杂志,2016,28(3):297-301.
[12] 王恒庆,乳果糖及促肠动力药对失代偿肝硬化肠源性肠道菌群失调及内毒素的影响[J].安徽医学,2014,35(7):967-968.
[13] 龙克娇,刘保文,卢敏,等.乙肝肝硬化与乙肝肝硬化合并糖尿病患者肠道菌群结构初步探讨[J].世界华人消化杂志,2018,(16):986-992.
[14] 周慧芳,万江丽. 肝硬化患者治疗前后肠道菌群的分析比较[J].中国继续医学教育,2018,10(23):116-118.
[15] 郑婷婷,蒋珊珊,方钟燎,等.慢性乙型肝炎、肝硬化和肝衰竭患者肠道菌群变化研究[J].实用肝脏病杂志,2018,21(6):899-902.
[16] 余姝丽.肝硬化患者肠道菌群分析[J].解放军预防医学杂志,2017,35(7):816-817.
[17] 郭栗良子,王立生. 肝硬化患者肠道菌群失衡的研究现状[J].中国微生态学杂志,2018,30(1):104-108,113.
[18] 徐洪军.肝硬化患者肠道菌群变化的分析[J].中国药物经济学,2014,9(8):117-118.
[19] 江杨洋,王旭东.生态病因学:肠道菌群失调与2型糖尿病[J].医学综述,2014,20(20):3757-3759.
[20] 刘保文.肝硬化及肝硬化合并糖尿病患者腸道微生态研究[D].天津医科大学,2017.
(收稿日期:2018-12-27)
