两种不同内膜准备方案对多囊卵巢综合征患者妊娠结局的影响
2019-12-06柏海燕
孙 婷,潘 丹,柏海燕
(西北妇女儿童医院生殖中心,陕西 西安 710003)
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是一种育龄期妇女常见的生殖、内分泌及代谢紊乱性疾病,我国的患病率为5.6%,高发年龄为20~35岁[1]。该病的主要临床表现包括肥胖、高雄激素和无排卵,并具有较高的不孕发生率[2-3]。近40年来随着辅助生殖技术(assisted reproductive technology,ART)在世界范围内的不断发展,越来越多的PCOS患者接受体外受精-胚胎移植(in vitro fertilization - embryo transfer,IVF-ET)治疗。由于PCOS患者本身的卵巢高反应性,导致卵巢过度刺激(ovarian hyper-stimulation syndrome,OHSS)的风险升高,文献报道PCOS患者在IVF-ET治疗中OHSS的发生率高达到20%~30%[4],从而因为预防卵巢过度刺激倾向等原因进行全胚冷冻。因此,在后续的冻融胚胎移植(frozen-thawed embryo transfer,FET)中,选择最佳的内膜准备方案也成为了能否提高PCOS患者妊娠结局的重要因素。PCOS患者由于无排卵,一般采用激素替代治疗(hormone replacement therapy,HRT)或促性腺激素释放激素激动剂降调节后激素替代周期治疗(GnRH-a&HRT)。本研究通过比较GnRH-a&HRT与HRT两种内膜准备方案FET治疗的妊娠结局,以期望对今后PCOS患者FET内膜准备方案的选择提供一些可行性建议。
1资料与方法
1.1一般资料
回顾性分析2016年1月至2018年8月在西北妇女儿童医院生殖中心生殖中心进行FET治疗的1 187名PCOS患者,共1 356周期。根据子宫内膜准备方案将所有患者分为GnRH-a&HRT组680例和HRT组584例。
1.2纳入标准及排除标准
1.2.1纳入标准
按照2003年鹿特丹标准[5]新鲜周期诊断为PCOS,新鲜周期取消移植、前次周期失败或前次周期活产打算再次移植且有冻胚者。知情同意,自愿参与。
1.2.2排除标准
(1)夫妻任何一方染色体异常;(2)合并卵巢囊肿、输卵管积水、子宫内膜异位症、子宫腺肌病、子宫肌瘤、子宫畸形(单角子宫、纵隔子宫等)等器质性病变患者;(3)宫腔粘连;(4)行植入前遗传学诊断(preimplantation genetic diagnosis,PGD)/植入前遗传学筛查(preimplantation genetic screening,PGS)。
1.3方法
1.3.1内膜准备方案
GnRH-a&HRT:月经第2-3天常规B超检查,肌肉注射长效醋酸曲谱瑞林(达菲林)3.75mg;30天后开始口服戊酸雌二醇2~6 mg/d(1mg/片,补佳乐)或雌二醇凝胶(2~4卡尺/日,爱思妥),连续10~14d,期间B超监测内膜厚度,当内膜厚度≥8mm时,给与口服地屈孕酮20mg/d,并给与黄体酮60mg/d转化内膜,应用黄体酮4~6 d后行冻融胚胎移植,移植后继续使用黄体支持药物。HRT:月经第5天常规B超检查,开始口服戊酸雌二醇2~6mg/d或雌二醇凝胶,连续10~14d,期间B超监测内膜厚度,当内膜厚度≥8mm时,给与口服地屈孕酮20mg/d,并给与黄体酮60mg/d转化内膜,应用黄体酮4~6d后行冻融胚胎移植,移植后继续使用黄体支持药物。卵裂期胚胎于移植前18h复苏,囊胚期胚胎于移植前3h复苏。
1.3.2妊娠的判断
移植后14天测血β-人绒毛膜促性腺激素(human chorionic gonadotropin,β-HCG)≥50mIU/mL为生化妊娠,继续黄体支持,移植后28天超声检测宫内见孕囊者为临床妊娠。异位妊娠为超声或手术或病理检查证实孕囊位于宫腔外者。
1.4统计学方法
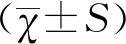
2结果
2.1两组一般情况比较
两组患者的年龄、体重指数(body mass index,BMI)、移植胚胎个数均无显著性差异(P>0.05)。GnRH-a&HRT组黄体酮转化日内膜厚度显著高于较HRT组(P<0.01),见表1。
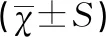
表1 两组一般情况比较
2.2两组临床妊娠结局比较
GnRH-a&HRT组680周期,其中生化妊娠537例,临床妊娠506例,活产401例,流产98例,异位妊娠2例,3例胎儿异常引产,分娩死胎2例;HRT组584周期,其中生化妊娠452例,临床妊娠427例,活产328例,流产92例,异位妊娠6例,分娩死胎1例。两组在生化妊娠率、临床妊娠率、活产率、流产率、异位妊娠率均无统计学意义(均P>0.05),GnRH-a&HRT组异位妊娠率较低,但差异无统计学意义(P>0.05),见表2。
表2 两组妊娠结局比较 [n/N(%)]
Table 2 Comparison of pregnancy outcomes between the two groups n/N(%)
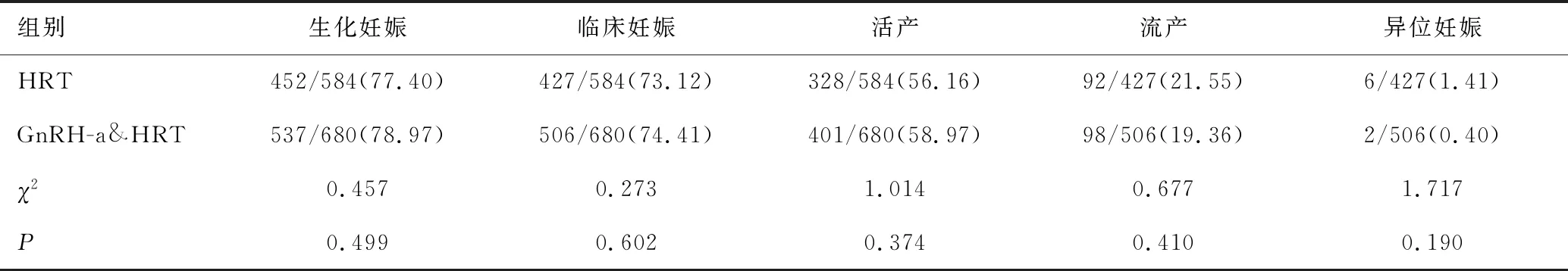
表2 两组妊娠结局比较 [n/N(%)]
组别生化妊娠临床妊娠活产流产异位妊娠HRT452/584(77.40)427/584(73.12)328/584(56.16)92/427(21.55)6/427(1.41)GnRH-a&HRT537/680(78.97)506/680(74.41)401/680(58.97)98/506(19.36)2/506(0.40)χ20.4570.2731.0140.6771.717P0.4990.6020.3740.4100.190
2.3 <35岁及≥35岁时两组患者的妊娠结局比较
<35岁患者的生化妊娠率、临床妊娠率、活产率、流产率及异位妊娠发生率两组比较均无显著性差异(P>0.05),异位妊娠发生率方面,GnRH-a&HRT组较HRT组下降;≥35岁PCOS患者,两组的生化妊娠率、临床妊娠率、活产率及流产率比较无统计学差异(P>0.05),但GnRH-a&HRT组较HRT组流产降低(25.93% vs.36.36%),活产率升高(53.66% vs.40.00%),见表3。
表3<35岁及≥35岁患者的妊娠结局比较n/N(%)
Table 3 Comparison of pregnancy outcomes in patients<35y and≥35y between the two groupsn/N(%)
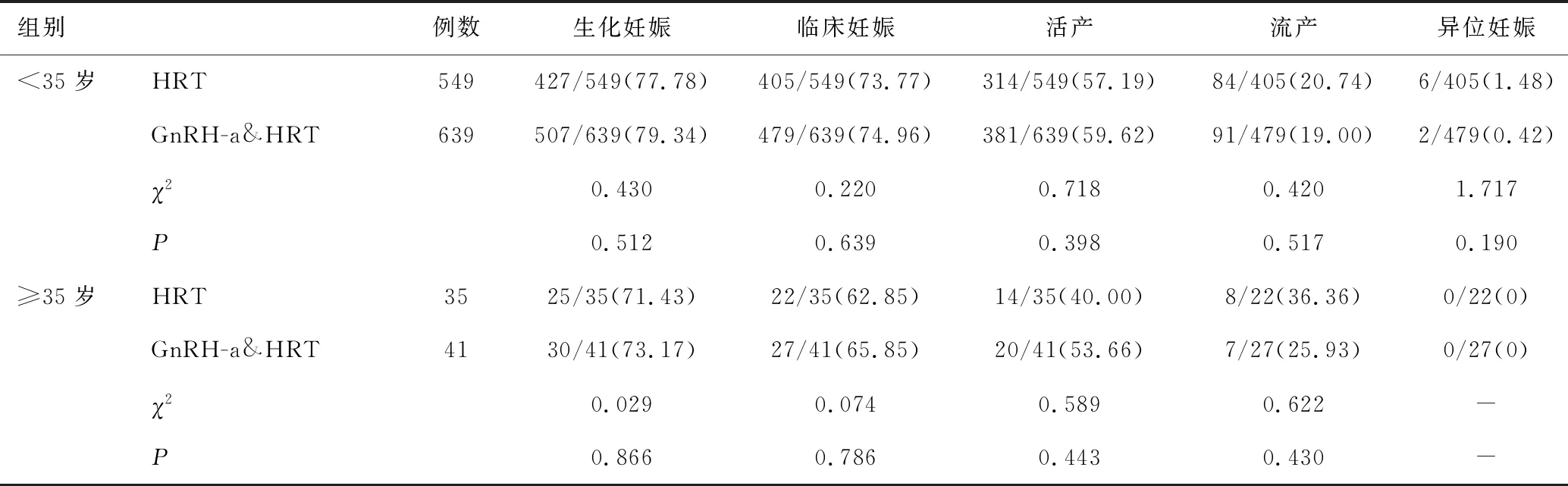
组别例数生化妊娠临床妊娠活产流产异位妊娠<35岁HRT549427/549(77.78)405/549(73.77)314/549(57.19)84/405(20.74)6/405(1.48)GnRH-a&HRT639507/639(79.34)479/639(74.96)381/639(59.62)91/479(19.00)2/479(0.42)χ20.4300.2200.7180.4201.717P0.5120.6390.3980.5170.190≥35岁HRT3525/35(71.43)22/35(62.85)14/35(40.00)8/22(36.36)0/22(0)GnRH-a&HRT4130/41(73.17)27/41(65.85)20/41(53.66)7/27(25.93)0/27(0)χ20.0290.0740.5890.622-P0.8660.7860.4430.430-
3讨论
3.1 PCOS患者的内分泌特点及治疗策略
PCOS患者的主要临床表现为无排卵或稀发排卵,其内分泌特征主要包括血清雄激素水平升高、黄体生成素(luteinizing hormone,LH)水平升高及促卵泡激素(follicle-stimulating hormone,FSH)/ LH比值呈倒置状态[6]。PCOS患者的治疗主要包括控制饮食和运动锻炼,减轻体重,抗雄激素治疗及改善胰岛素抵抗等。对于有生育要求的PCOS患者,可选择药物诱发排卵,且大多数可获得自然受孕,但当改善生活方式和药物治疗失败时,ART技术已经成为PCOS患者的三线治疗。
3.2 PCOS患者的内膜准备方案比较
近年来多项研究表明,GnRH-a&HRT周期可以改善PCOS患者FET的妊娠结局,GnRH-a通过改善子宫内膜的容受性,避免自发排卵,降低周期取消率,增加临床妊娠率[7]。有多个研究对比了GnRH-a&HRT和HRT方案进行FET,发现GnRH-a&HRT方案的胚胎着床率和临床妊娠率显著高于HRT方案[8]。孙晓晓等近期的研究发现首次FET失败的PCOS患者行卵裂期胚胎移植时,GnRH-a&HRT有改善其临床妊娠率、胚胎种植率的趋势,但结果无统计学差异[9]。江成龙等于2015年研究发现GnRH-a&HRT与HRT两者在流产率、多胎率、异位妊娠率和分娩率无统计学差异。
我们的研究结果表明,PCOS患者应用GnRH-a&HRT与HRT方案的临床妊娠率、流产率、活产率结果类似,GnRH-a&HRT方案的临床妊娠率及活产率较HRT略升高,流产率略下降,异位妊娠的发生风险降低,差异无统计学意义。PCOS患者的LH水平大多较高,从而增加了抗苗勒氏管激素与雄激素的分泌,而过高的雄激素水平可以与子宫内膜雌激素受体竞争性结合,影响子宫内膜的分泌与增生,损害子宫内膜的容受性[10-12]。PCOS患者应用GnRH-a预处理可以有效降低LH水平,因此应用GnRH-a可以通过改善高LH水平,从而减少对内膜容受性的不利影响。另外,洪宇等2012年的研究发现GnRH-a能够增加内膜胞饮突数量,增加内膜整合素av3的表达,整合素av3通过介导滋养层细胞与子宫内膜上皮细胞之间的相互作用,参与囊胚黏附,使胚胎植入子宫内膜,即GnRH-a通过增加胚胎黏附,促进胚胎植入,从而减少异位妊娠的发生。
我们还发现GnRH-a&HRT方案的转化日内膜厚度显著高于HRT方案,推测可能是由于长效GnRH-a的降调节作用,使得内膜表面雌激素受体表达增加,对于外源性雌激素的反应增强,雌激素受体的表达增加及反应性增强,促进了子宫内膜生长。2017年的一项研究发现与HRT方案比较,GnRH-a&HRT方案的ET日内膜厚度无差异,但内膜分型更好[13]。
3.3 年龄对PCOS患者选择内膜准备方案的影响
我们将PCOS患者分为<35岁及≥35岁,分别比较GnRH-a&HRT和HRT方案在不同年龄PCOS患者的妊娠结局。结果表明两种内膜准备方案在<35岁的PCOS患者中的生化妊娠率、临床妊娠率、流产率、活产率均类似。但在≥35岁PCOS患者,虽然生化妊娠率及临床妊娠率类似,但与HRT比较GnRH-a&HRT的流产率更低,活产率更高。高龄PCOS患者随着年龄增加,内分泌及代谢异常逐渐加重,且卵子质量下降,使其在辅助生殖治疗表现更为复杂[14]。GnRH-a通过降低LH水平,提高血浆性激素结合蛋白水平从而有效降低游离雄激素,改善患者的内分泌紊乱状态,从而使得流产风险及异位妊娠风险降低[15]。目前已知的和流产相关的因素众多,已证明与免疫因素相关。对于免疫异常的患者,在FET中应用GnRH-a,能够部分逆转Th2类细胞因子,从而促进Th1/Th2比例平衡,由此促进母胎免疫耐受,避免种植失败及妊娠丢失。已有多项研究表明对于反复种植失败的患者,GnRH-a&HRT方案可以提高胚胎种植率,临床妊娠率及持续妊娠率[16]。
综上所述,对于接受FET治疗的PCOS患者,降调节后激素替代治疗和激素替代治疗两种内膜准备方案具有类似的临床妊娠率及活产率,但对于高龄的PCOS患者,前者具有更高的活产率及更低的流产率。因此,对于首次移植的PCOS患者,这两种内膜准备方案都是不错的选择,但长效GnRH-a价格较高且治疗周期时间较长,可能一定程度上加重了患者的经济负担;而对于既往曾经移植失败或高龄PCOS患者,降调节后激素替代治疗方案可能是更为合适的方案。
本项研究的局限性在于采用的是回顾性分析,因而仍需大样本的前瞻随机对照研究以进一步比较不同内膜准备方案对PCOS患者FET的影响。
