BDE-47、BDE-99、BDE-153和BDE-209对蛋白核小球藻、大型溞和大菱鲆的急性毒性效应*
2019-12-06迟潇夏斌朱琳陈碧鹃孙雪梅赵信国唐学玺曲克明
迟潇夏斌朱琳陈碧鹃孙雪梅赵信国唐学玺曲克明
BDE-47、BDE-99、BDE-153和BDE-209对蛋白核小球藻、大型溞和大菱鲆的急性毒性效应*
迟 潇1,2夏 斌2,3朱 琳2,3陈碧鹃2,3①孙雪梅2,3赵信国2唐学玺1曲克明2
(1. 中国海洋大学海洋生命学院 青岛 266003;2. 中国水产科学研究院黄海水产研究所 农业农村部海洋渔业资源可持续发展重点实验室 山东省渔业资源与生态环境重点实验室 青岛 266071;3. 青岛海洋科学与技术试点国家实验室海洋生态与环境科学功能实验室 青岛 266237)
本研究选取4种多溴联苯醚(PBDEs)同系物(BDE-47、BDE-99、BDE-153和BDE-209)对蛋白核小球藻()、大型溞()和大菱鲆()进行急性毒性实验。结果显示,4种PBDE同系物对蛋白核小球藻的96 h EC50为1.39 (BDE-47)、1.76 (BDE-99)、3.23 (BDE-153)和378.62 μg/L (BDE-209),安全浓度为0.10 (BDE-47)、0.18(BDE-99)、0.27 (BDE-153)和8.68 μg/L (BDE-209);对大型溞的96 h LC50为0.24 (BDE-47)、1.42 (BDE-99)、1.49( BDE-153)和63.93 μg/L (BDE-209),安全浓度为0.03 (BDE-47)、0.82 (BDE-99)、0.94 (BDE-153)和BDE-209 (5.09 μg/L);对大菱鲆的96 h LC50为5.46(BDE-47)、6.07 (BDE-99)、7.35(BDE-153)和118.78 μg/L (BDE-209),安全浓度为2.02 (BDE-47)、2.01 (BDE-99)、2.17 (BDE-153)和58.62 μg/L (BDE-209)。多溴联苯醚同系物毒性随着溴原子取代数的增加而减小(BDE-47>BDE-99>BDE-153> BDE-209)。虽然目前海水中PBDEs处于安全浓度,但由于PBDEs的结构稳定性和环境持久性,其对环境的影响不容忽视。
多溴联苯醚;蛋白核小球藻;大型溞;大菱鲆;急性毒性
多溴联苯醚(Polybrominated diphenyl ethers, PBDEs)是一大类常用的溴代阻燃剂(Brominated flame retardants, BFRs),曾在全世界大量生产和使用,被广泛用于电脑、电视机等家用电器以及纺织品等产品中(Hooper, 2000)。根据溴原子在苯环上的个数和位置不同,PBDEs的同系物共有209种同系物(刘汉霞等, 2005)。由于PBDEs代谢物的结构与多氯联苯、二氯二苯、三氯乙烷和甲状腺素等相似,它与多氯联苯可能有相似的毒性效应(Wang, 2015)。PBDEs并不是共价结合的高分子聚合物,因此,在各种产品使用、废弃、填埋、老化和降解等过程中,容易从产品表面挥发脱离,释放到环境中(Wang, 2007; Hooper, 2000),并随着食物链(网)在生物体内累积(She, 2007)。虽然许多国家已经禁止使用多溴联苯醚,但近年来的研究结果显示,PBDEs及其衍生物在世界各地的各类环境样品或生物体中均有检出,且浓度呈逐年增长趋势(Huang, 2013)。PBDEs在生物体中可发生生物累积,会对食物链中的高营养级产生一定的毒性效应(姜爽, 2011)。目前,了解PBDEs的生物毒性主要包括免疫毒性、内分泌干扰作用、生殖和神经发育毒性以及致癌性等(Darnerud, 2005)。近几年,PBDEs作为一种新型的全球性环境污染物,越来越受到国内外的关注(周明莹等, 2014)。
海洋微藻是海洋生物食物链(网)的基础,进入微藻细胞内的PBDEs可以通过海洋食物链向高营养级生物体内转移,最终进入人体产生危害。同时,PBDEs的毒性效应对藻细胞的生长繁殖产生影响,导致食物链中高等生物的营养不足,破坏海洋生态系统的平衡(李卓娜等, 2009),且微藻本身具有易培养、繁殖快、毒性特征明显等特点,能在短时间内得到污染物对其种群及世代的毒性响应的相关数据(张丽, 2015)。蛋白核小球藻()是1种广泛分布的单细胞藻类,具有易培养、繁殖快、毒性特征明显等特点,是实验室常用的藻类。大型溞()作为一种重要的水生浮游生物,以藻类为食,同时是鱼类的饵料之一,是水生生态系统中物质循环和能量流动的重要环节(彭颖等, 2012),污染物对大型溞的毒性能够反映其对水生态系统影响的程度,且大型溞具有生活周期短、生长快、生殖量高、易培养和对水环境胁迫敏感等特点,是进行水生毒理学的理想生物。近年来,在大量水生物种体内检测到PBDEs及其衍生物残留,其中包括海洋和淡水鱼类、鸟类及白鲸、环斑海豹、北极熊等海洋哺乳类生物(McKinney, 2006; Routti, 2009; Zhang, 2010)。其中,鱼类是海洋生态系统的重要传递者,是PBDEs通过食物链进入人类的主要途径之一(Voorspoels, 2007),且研究发现,近年来PBDEs在鱼类组织中的含量呈现增长趋势,因此,对鱼类体内PBDEs检测应引起广泛重视(赵静, 2015)。大菱鲆()作为重要的海洋经济鱼类,在我国北方沿海省市大面积养殖,且其仔稚鱼具有对环境胁迫敏感、活动量小、耗氧低的特点(玮乔等, 2014)。因此,本研究选择蛋白核小球藻、大型溞和大菱鲆仔稚鱼作为PBDEs急性毒性的实验生物。
本文研究了2,2’,4,4’-四溴联苯醚(BDE-47)、2,2’,4,4’,5-五溴联苯醚(BDE-99)、2,2’,4,4’,5,5’-六溴联苯醚(BDE-153)、2,2’3,3’4,4’5,5’6,6-十溴联苯醚(BDE-209)对蛋白核小球藻、大型溞和大菱鲆仔稚鱼的急性毒性效应,获得4种PBDEs对蛋白核小球藻的半效应浓度(EC50)和安全浓度(SC)以及4种PBDEs对大型溞和大菱鲆仔稚鱼半致死浓度(LC50)和安全浓度,比较不同溴代数PBDEs同系物对生物的毒性效应,为PBDEs的海洋环境风险评估提供依据。
1 材料与方法
1.1 材料与仪器
1.1.1 实验生物及培养 蛋白核小球藻:由中国水产科学研究院黄海水产研究所藻种室提供。培养方法:海水取自青岛沿海,黑暗沉淀后经0.45 μm滤膜过滤,煮沸消毒,冷却后用于配制f/2培养液(陈明耀, 1995),温度为(20±0.2)℃,光强为4500 lx,光暗比为12 h∶12 h,每天定时人工摇动3次,并且随机调换三角瓶的位置使实验藻液光照均匀。
大型溞:实验所选用大型溞为实验室培养的健康孤雌生殖3代以上的幼溞,在实验前24 h选取怀卵的健康母溞放入实验液进行培养,实验前6 h将母溞挑出,在繁殖的幼溞中挑选健康的个体用于实验。培养方法:温度为(23±1)℃,光强为3500 lx,光暗比为16 h∶8 h。喂食小球藻,并定期更换培养液。
大菱鲆:购于莱州市金益源水产公司,体长为(3.0±0.5) cm,体重为(0.4±0.1) g。驯养方法:实验前在体积为48 m³的鱼缸内暂养3~5 d,密度为4尾/m³,采用流水式换水。每天换水1次。每天早上适量投喂饲料1次。
1.1.2 试剂 PBDEs:BDE-47、BDE-99、BDE-153和BDE-209均购于AccuStandard公司(纯度GC/MS)。由于PBDEs微溶于水,以二甲基亚砜(DMSO,色谱纯,国药集团化学试剂有限公司)为溶剂,配制每种PBDEs的母液,4℃下保存备用。蛋白核小球藻毒性实验前,用f/2培养基依次稀释成所需浓度的实验溶液,各溶液实验浓度见表1。
1.1.3 仪器 OLYMPUS BX51正置荧光显微镜、智能二氧化碳光照培养箱(GZP-450)、M-50抽滤器抽滤(滤膜直径为5 cm,孔径为0.45 μm)、自动电热压力蒸汽灭菌锅(Zealway G154D)、电热恒温鼓风干燥箱(DHG-9146A)。
1.2 实验方法
PBDEs对小球藻的急性毒性实验方法:取18只500 ml的具塞三角瓶,分成6组,每组3个平行,各加入含有不同浓度BDE-47的f/2培养液150 ml。分别根据BDE-47、BDE-99、BDE-153和BDE-209对小球藻的毒性预实验得出浓度范围,在此范围内按照等对数间距设置6个浓度组。其中,零浓度处理中只含有0.01 μg/ml DMSO的培养液,预实验结果证明,该浓度的DMSO对海洋微藻生长无抑制效应,具体浓度梯度见表1。将初始浓度为2×106个/ml且处于指数生长期的蛋白核小球藻接种到三角瓶的培养液中。每天定时人工摇动,并且随机调换三角瓶的位置,使实验藻液受光均匀。分别在24、48、72和96 h采集藻液,在显微镜下用血球计数板计数,计算藻细胞密度(个/ml)。
PBDEs对大型溞的急性毒性实验方法:实验容器为100 ml的烧杯,根据BDE-47、BDE-99、BDE-153和BDE-209对大型溞的毒性预实验得出浓度范围,在此范围内按照等对数间距设置6个浓度组,每组 3个平行,其具体浓度梯度见表1。挑选规格均匀的大型溞作为实验对象,每组放入幼溞10只。实验期间不喂食。实验开始后,于24、48、72和96 h记录其死亡数,并清除死亡个体。死亡判定:在解剖镜下观察,以心脏停止跳动确定为死亡。
PBDEs对大菱鲆的急性毒性实验方法:实验容器为1 L的烧杯,根据BDE-47、BDE-99、BDE-153和BDE-209对大菱鲆的毒性预实验得出浓度范围,在此范围内按照等对数间距设置6个浓度组,每组 3个平行,具体浓度梯度见表1。挑选规格均匀的大菱鲆作为实验对象,每组放入实验动物10尾。实验期间不投饵,24 h不间断微量充气。采用半静水式换水补药方法,每隔24 h换水1次,重新投药。实验开始后,于24、48、72和96 h记录其死亡数并清除死亡个体。死亡判定:死亡的大菱鲆鱼体弯曲,体色变淡,鳃盖张开(曲克明等, 2007)。
表1 急性毒性实验中4种PBDEs同系物的浓度梯度
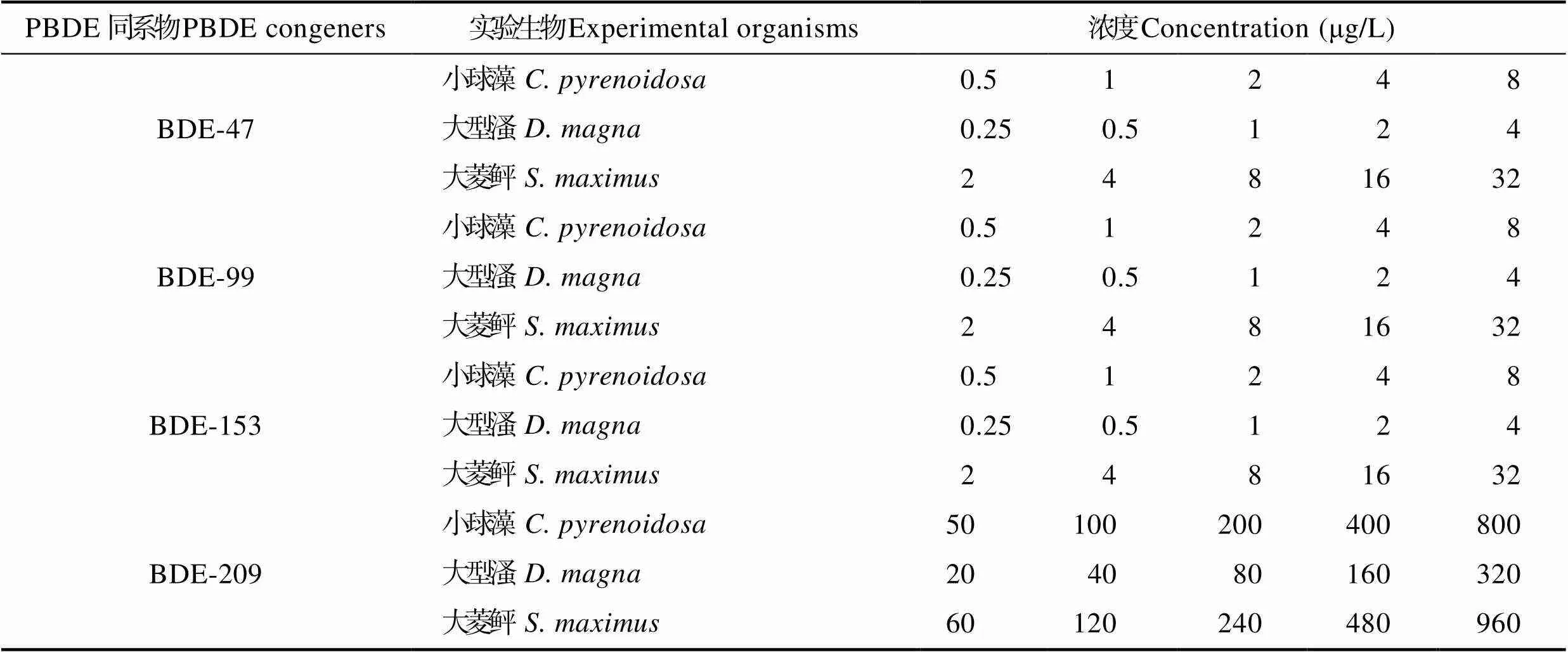
Tab.1 Concentration gradients of four PBDEs congeners in the acute toxicity test
1.3 数据分析
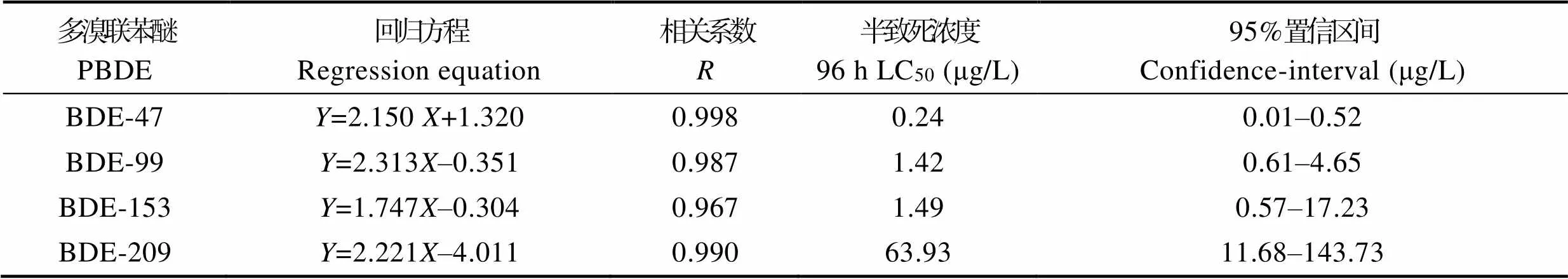
采用Excel 2010软件对数据进行处理,计算各实验均值及标准偏差。采用概率单位法,利用SPSS 19.0得出受试生物死亡百分率的概率单位与实验浓度对数的回归方程及半数抑制浓度(EC50)和半致死浓度(LC50)及95%置信区间。
安全浓度(SC)采用特伦堡(Turubell)的安全浓度计算公式(陈宇锋, 2016):
SC=48 h LC50×0.3/(24 h LC50/48 h LC50)2
2 结果与讨论
2.1 多溴联苯醚对蛋白核小球藻的急性毒性
如图1所示,在多溴联苯醚对蛋白核小球藻的毒性实验中,随着浓度的提高,各实验组蛋白核小球藻的死亡率上升,二者呈正相关关系。在相同浓度下,蛋白核小球藻的抑制率随时间的增加而增加。在BDE-47高浓度组(4~8 μg/L)、BDE-99高浓度组(4~8 μg/L)、BDE-153高浓度组(8 μg/L)和BDE-209高浓度组(800 μg/L),短时间内(24 h)对小球藻的抑制率达到40%以上;在BDE-47低浓度组(0.5~2 μg/L)、BDE-99低浓度组(0.5~2 μg/L)、BDE-153低浓度组(0.5~2 μg/L)和BDE-209低浓度组(50~200 μg/L),对小球藻的抑制率随时间的增加逐渐增大,96 h内抑制率分别达60%、40%、40%和20%,且暴露时间越长,抑制率越高,二者呈正相关。

图1 不同浓度的BDE-47、BDE-99、BDE-153、BDE-209对蛋白核小球藻的抑制率
表2为不同溴联苯醚对蛋白核小球藻的96 h抑制率概率单位的回归方程,在此基础上进行了回归方程的相关系数和回归系数的显著性检验,计算出BDE-47、BDE-99、BDE-153和BDE-209对蛋白核小球藻的96 h EC50依次为1.39、1.76、3.23和378.62 μg/L。根据Turubell的安全浓度计算公式,计算出BDE-47、BDE-99、BDE-153和BDE-209对蛋白核小球藻的安全浓度分别为0.10、0.18、0.27和8.68 μg/L。
4种同系物对蛋白核小球藻的毒性强度依次为BDE-47>BDE-99>BDE-153>BDE-209。结果显示,随着Br原子取代数量的增加,毒性逐渐减小。Connell等(1988)研究表明,污染物对蛋白核小球藻的急性毒性效应取决于此类化学物质进入藻细胞的难易程度(或生物可利用性),且PBDEs的辛醇水分配系数(Octanol-water partition coefficient, logow)与疏水性化学物质的生物富集因子(BAF)之间存在抛物线关系,当logow>6.5时,生物对化学物质的吸收程度因超疏水化合物的空间位阻而降低。本研究所选用的BDE-47、BDE-99和BDE-153的logow值分别为6.81、7.32和7.90,而BDE-209的logow值(9.98)高于前 3种同系物,相应的空间位阻最大,较大的空间位阻阻碍了PBDEs的摄入、富集、代谢和传递,造成毒性下降(Haraguchi, 2009; Burreau, 1997; Boon, 2002)。堵锡华(2007)研究证明,与PBDEs性质相似的多氯联苯(PCBs)空间位阻也随着分子中Cl原子的取代数增加而逐渐加大。本研究中,BDE-209的EC50比其他3种同系物要高出2~3个数量级,对应的生物毒性也较小,可能是由于Br原子取代数量较多,空间位阻较大,进而造成毒性较低。
根据《新化学物质危害评估准则(HJ/T154-2004)》中的评判标准(极高毒性物质:EC50<1 mg/L;高毒性物质:1 mg/L 综合其他相关研究成果可知,海洋微藻对环境中的PBDEs相当敏感。Kallqvist等(2006)通过研究发现,BDE-47对中肋骨条藻()的48 h EC50为70 μg/L,表明BDE-47对其有明显的抑制作用。李卓娜等(2009)通过BDE-47对4种微藻的急性毒性实验,得出BDE-47对小球藻、牟氏角毛藻()、中肋骨条藻、赤潮异弯藻 ()的96 h EC50分别为0.79、1.52、1.99和2.25 μg/L,根据《新化学物质危害评估准则(HJ/T154-2004)》中的评判标准,判断其对2种微藻的毒性属于极高毒性。胡恒等(2015)研究了BDE-47对亚心型扁藻()的96 h EC50为113.66 μg/L,对盐氏杜生藻()的96 h EC50为119.93 μg/L,根据《新化学物质危害评估准则(HJ/ T154-2004)》中的评判标准,判断其对4种微藻的毒性属极高毒性。姜爽(2011)研究了2种PBDEs同系物BDE-47、BDE-209对4种微藻的毒性效应,BDE-47对青岛大扁藻()、米氏凯伦藻()、赤潮异弯藻、金藻()的96 h EC50为2、0.25、0.046、0.016 mg/L,BDE-209对4种微藻的96 h EC50为30.29、18.1、1.8、0.79 mg/L,发现4种微藻对2种PBDEs同系物的胁迫存在较为明显的差异。通过以上研究发现,PBDEs同系物对不同种类微藻的毒性效应不同,说明不同藻类的不同形态如细胞壁及细胞外胶被等(姜爽, 2011),以及不同的生物特性都可能对多溴联苯醚的毒性效应产生影响。如不同于小球藻裸露的细胞体,青岛大扁藻的原生质体外有细胞壁保护,因此有较强的抗逆性。因此,需广泛研究多溴联苯醚对浮游类生物的毒性作用。 表2 多溴联苯醚对蛋白核小球藻的96 h急性毒性实验结果 Tab.2 Acute toxicity test results of PBDEs on C. pyrenoidosafor 96 h 如图2所示,在多溴联苯醚对大型溞的毒性实验中,随着浓度的升高,各实验组大型溞的死亡率随之上升,二者呈正相关。由图2可知,BDE-47对大型溞的影响尤为明显,在BDE-47浓度组,短时间内(24 h)大型溞的抑制率达到40%左右。 表3为不同溴联苯醚对大型溞的96 h 致死率概率单位的回归方程,在此基础上进行了回归方程的相关系数和回归系数的显著性检验,据此计算出BDE-47、BDE-99、BDE-153和BDE-209对大型溞的96 h LC50依次为0.24、1.42、1.49和63.93 μg/L。并根据Turubell的安全浓度计算公式,计算出BDE-47、BDE-99、BDE-153和BDE-209对大型溞的安全浓度分别为0.03、0.82、0.94和5.07 μg/L。 图2 不同浓度的BDE-47、BDE-99、BDE-153、BDE-209对大型溞的致死率 表3 多溴联苯醚对大型溞的96 h急性毒性实验结果 Tab.3 Acute toxicity test results of PBDEs on D. magna for 96 h 4种同系物对大型溞的毒性强度依次为BDE-47> BDE-99>BDE-153>BDE-209。根据《新化学物质危害评估准则(HJ/T154-2004)》中的评判标准,提出的评判标准,分析4种多溴联苯醚对大型溞的96 h EC50分别0.24、1.42、1.49和63.93 μg/L,可以判断BDE-47、BDE-99、BDE-153和BDE-209对大型溞均属于极高毒性物质(EC50<1 mg/L)。 综合其他相关研究的成果,浮游动物对环境中的PBDEs也较为敏感。Breithlltz等(2003)测得BDE-47对美丽猛水蚤()的96 h LC50为72 μg/L;徐风风(2013)通过研究BDE-47对太平洋真宽水蚤()和日本虎斑猛水蚤()的96 h LC50为47.85 μg/L;张璟(2013)测得BDE-47对褶皱臂尾轮虫()的24 h LC50为7.92 mg/L,而BDE-209对其的24 h LC50则没有被检测出。通过以上相关研究结果结合本研究结果,说明不同种类水生浮游生物(例如不同桡足类)对同种PBDEs同系物的敏感性差异较大;同种水生浮游生物对不同种PBDEs同系物的敏感度也不同。但不同PBDEs同系物对水生浮游生物的急性毒性实验也较为缺乏。因此,需广泛研究多溴联苯醚对浮游类生物的毒性作用。 如图3所示,在多溴联苯醚对大菱鲆的毒性实验中,随着浓度的提高,各实验组大菱鲆的死亡率随之上升,二者呈正相关。在BDE-47的高浓度组(16~ 32 μg/L)、BDE-99的高浓度组(16~32 μg/L)和BDE-153的高浓度组(16~32 μg/L),短时间内(24 h)大菱鲆的死亡率均达到100%;在BDE-47、BDE-99和BDE-15中,低浓度组2 μg/L以下时死亡率不变,2~4 μg/L死亡缓慢,中浓度组4~16 μg/L死亡率急剧上升,高浓度组16 μg/L及其以上全部死亡。在BDE-47低浓度组(2~4 μg/L)、BDE-99低浓度组(2~ 4 μg/L)、BDE-153低浓度组(2~4 μg/L)、BDE-209低浓度组(60~240 μg/L),大菱鲆的死亡率逐渐升高,96 h内死亡率均达到20%左右,且暴露时间越长,死亡率越高,二者呈正相关。 图3 不同浓度的BDE-47、BDE-99、BDE-153、BDE-209对大菱鲆的致死率 表4为不同多溴联苯醚对大菱鲆的抑制率概率单位的回归方程,在此基础上进行了回归方程的相关系数和回归系数的显著性检验,据此计算出BDE-47、BDE-99、BDE-153和BDE-209对大菱鲆的96 h EC50依次为5.46、6.07、7.35和118.78 μg/L。并根据Turubell的安全浓度计算公式,计算出BDE-47、BDE-99、BDE-153和BDE-209对大菱鲆的安全浓度分别为2.02、2.01、2.17和58.62 μg/L。 4种同系物对大菱鲆的毒性强度依次为BDE-47> BDE-99>BDE-153>BDE-209。结果表明,高溴代同系物(BDE-209)比低溴代同系物(BDE-47、BDE-99和BDE-153)的EC50要高出2~3个数量级,说明其中也存在辛醇水分配系数与不良效应之间的正相关关系。Kallqvist等(2006)研究显示,PBDEs的log Kow与斑马鱼胚胎对其的吸收存在负相关,即生物可利用性越高的同系物的发育毒性也越强。 根据《新化学物质危害评估准则(HJ/T154-2004)》中的评判标准,分析4种多溴联苯醚对大菱鲆的96 h EC50分别为5.46、6.07、7.35和118.78 μg/L,可以判断BDE-47、BDE-99、BDE-153和BDE-209都属于极高毒性物质(EC50<1 mg/L)。 表4 多溴联苯醚对大菱鲆的96 h急性毒性实验结果 Tab.4 Acute toxicity test results of PBDEs on S. maximusfor 96 h 综合其他相关研究成果,鱼类对环境中的PBDEs也较为敏感。范灿鹏等(2011)研究了BDE-47对剑尾鱼()的96 h EC50为2.75 mg/L,根据国家环保局《水生生物监测手册》中的评判标准,BDE-47对剑尾鱼具有高毒性;张雨鸣(2014)通过研究BDE-47对红鳍东方鲀()的急性毒性,测得BDE-47对其的24、48、96 h EC50分别为70.01、18.83、9.44 mg/L,根据国家环保局《水生生物监测手册》中的评判标准,BDE-47对红鳍东方鲀具有高毒性。通过以上相关研究结果结合本研究结果,说明不同种类水生生物(例如鱼类)对同种PBDEs同系物的敏感性差异较大,且不同PBDEs同系物对水生生物的急性毒性实验也较为缺乏。因此,应进行更为广泛的PBDEs对鱼类的毒性效应。 PBDEs作为一种新型阻燃剂,并不是共价结合的高分子聚合物,没有化学键的束缚,因此容易发生挥发脱离,释放到环境中,其在水体、大气、底泥和生物体中都存在(Ueno, 2004)。由于人类活动释放到大气中的PBDEs,以及含有PBDEs的污水,都通过大气沉降和地表径流汇集到水体中。通过调查,不同地区水体内的PBDEs含量不同。例如,胶州湾养殖区水体中PBDEs含量范围为ND~630.8 pg/L,其中,低溴代PBDEs(BDE-47等)为主要污染物(周明莹等, 2010);香港附近海域水体中PBDEs的含量约为311~1187 pg/L(Breitholtz, 2003)。北美安大略湖表面水体发现PBDEs的含量约为4~13 pg/L,其中,BDE-47和BDE-99共占了总量的90%以上;荷兰近海岸水体中的BDE-47、BDE-99、BDE-153和BDE-209含量分别为1、0.5、0.1和0.1~4 pg/L (姜爽, 2011)。由以上调查结果可知,目前,海水中PBDEs的环境浓度大约为5 pg/L (Stapleton, 2003)。4种同系物对蛋白核小球藻、大型溞、大菱鲆的96 h EC50(LC50)处于μg/L的级别,远高于实际海洋环境中PBDEs的含量。因此,实际海洋环境中PBDEs的含量不会对小球藻、大型溞和大菱鲆等海洋生物产生急性致死效应。数据显示,目前使用率较高的PBDEs是高溴代的BDE-209,结合实验数据来看,其对3种生物的EC50(LC50)比其他3种同系物小2~3个数量级,虽然其危害较小,但高溴代的BDE-209释放到环境介质中,会通过化学降解、光降解、生物降解等方式脱溴成为低溴联苯醚BDE-47、BDE-99等,会增加对环境的危害(Sun, 2008)。且就PBDEs的化学特性而言,由于随着PBDEs中溴原子数量的增加,其蒸气压会呈线性下降,因此,低溴代同系物多处于气相当中,有较强的远距离迁移能力。综上所述,虽然使用率较高的高溴代同系物如BDE-209等毒性较小,但其产生的长久影响不容忽视。 综上所述,随着PBDEs同系物的浓度升高,PBDEs对蛋白核小球藻、大型溞和大菱鲆的急性毒性效应均逐渐增大,且毒性效应随Br原子取代数的增加而减小。4种同系物对生物的急性毒性强度由高及低依次为BDE-47>BDE-99>BDE-153>BDE-209。由于PBDEs具有一定的结构稳定性和环境持久性,其在水环境中积累并可能通过食物链(网)向高营养级传递,进而造成生物放大和更大毒害效应。因此,PBDEs的环境与健康风险不容忽视,需要继续开展环境浓度PBDEs长期暴露对海洋生物的毒性效应及其在海洋食物链上的营养传递研究。 NASICON 型固体电解质材料的结构通式:Na1+xZr2Si2-xPxO12(0≤x≤3),Yue等[46]提出通过Si取代p,同时在此引入Na以使NASICON型固体电解质材料达到平衡。当x=2时,电导率达到最优值,从而比较纯的NASICON的室温离子电导率约为 67 mS·m-1,除了具有较高的离子电导率之外,NASICON型固体电解质具有较低的热膨胀性。 Boon JP, Lewis WE, Tjoen-A-Choy MR,. Levels of polybrominated diphenyl ether (PBDE) flame retardants in animals representing different trophic levels of the North Sea food web. Environmental Science and Technology, 2002, 36(19): 4025–4032 Breitholtz M, Wollenberger L. Effects of three PBDEs on development, reproduction and population growth rate of the harpacticoid copepod. Aquatic Toxicology, 2003, 64(1): 85–96 Burreau S, Axelman J, Broman D,. Dietary uptake in pike () of some polychlorinated biphenyls, polychlorinated naphthalenes and polybrominated diphenyl ethers administered in natural diet. Environmental Toxicology and Chemistry, 1997, 16(12): 2508–2513 Chen MY. Biological food culture (specialized for marine aquaculture). Beijing: China Agriculture Press, 1995 [陈明耀. 生物饵料培养(海水养殖专业用). 北京: 中国农业出版社, 1995] Chen YF. Acute toxicity of fenvalerate and ethofenprox on. Journal of Fisheries Research, 2016, 38(2): 126–131 [陈宇锋. 氰戊菊酯、醚菊酯对日本囊对虾的急性毒性. 渔业研究, 2016, 38(2): 126–131] Connell DW, Hawker DW. Use of polynomial expressions to describe the bioconcentration of hydrophobic chemicals by fish. Ecotoxicology and Environmental Safety, 1988, 16(3): 242–257 Du XH. QSPR research of thermodynamic properties of polychlorinated biphenyl. Journal of Chemical Industry and Engineering(China), 2007, 58(10): 2432–2436 [堵锡华. 多氯联苯热力学性质的构效关系. 化工学报, 2007, 58(10): 2432–2436] Fan CP, Wang Q, Liu XY,. Toxicity and effect of tetrabromodiphenyl ether upon the antioxidant defense system of swordtail fish(). Acta Scientiae Circumstantiae, 2011, 31(3): 642–648 [范灿鹏, 王奇, 刘昕宇, 等. 四溴联苯醚对剑尾鱼毒性及其抗氧化系统的影响. 环境科学学报, 2011, 31(3): 642–648] Haraguchi K, Hisamichi Y, Endo T. Accumulation and mother- to-calf transfer of anthropogenic and natural organohalogens in killer whales () stranded on the Pacific coast of Japan. Science of the Total Environment, 2009, 407(8): 2853–2859 Hooper K, McDonald TA. The PBDEs: An emerging environmental challenge and another reason for breast-milk monitoring programs. Environmental Health Perspectives, 2000, 108(5): 387–392 Hu H, Yu T, Meng FP. Acute toxicity of five brominated diphenyl ether congeners to marine bait-algae species:and. Marine Environmental Science, 2015, 34(5): 654–660 [胡恒, 于腾, 孟范平, 等. 5种多溴联苯醚同系物对海洋饵料藻(亚心型扁藻和盐生杜氏藻)的急性毒性. 海洋环境科学, 2015, 34(5): 654–660] Huang K, Lin K, Guo J,. Polybrominated diphenyl ethers in birds from Chongming Island, Yangtze Estuary, China: Insight into migratory behavior. Chemosphere, 2013, 91(10): 1416– 1425 Jiang S. The toxic effects of two kinds of polybrominated diphenyl ethers (PBDEs) on four species of marine microalgae. Master´s Thesis of Ocean University of China, 2011 [姜爽. 两种多溴联苯醚对四种海洋微藻的毒性效应研究. 中国海洋大学硕士研究生学位论文, 2011] Kallqvist T, Grung M, Tollefsen KE. Chronic toxicity of 2,4,2',4'-tetrabromodiphenyl ether on the marine algaand the crustacean. Environmental Toxicology and Chemistry, 2006, 25(6): 1657–1662 Li ZN, Meng FP, Zhao SS,. Acute toxic effects of 2,2¢,4,4¢-tetrabromodiphenyl ether (BDE-47) on four marine microalgae. Asian Journal of Ecotoxicology, 2009, 4(3): 435–439 [李卓娜, 孟范平, 赵顺顺, 等. 2,2¢,4,4¢-四溴联苯醚(BDE-47)对4种海洋微藻的急性毒性. 生态毒理学报, 2009, 4(3): 435–439] Liu HX, Zhang QH, Jiang GB,. Polybrominated diphenyl ethers and its related environmental problems. Progress in Chemistry, 2005, 17(3): 554–562 [刘汉霞, 张庆华, 江桂斌, 等. 多溴联苯醚及其环境问题. 化学进展, 2005, 17(3): 554–562] McKinney MA, De Guise S, Martineau D,. Organohalogen contaminants and metabolites in beluga whale () liver from two Canadian populations. Environmental Toxicology and Chemistry, 2006, 25(5): 1246–1257 Peng Y, Fan CP, Liao W,. Toxic effects of 2,2', 4,4'-tetrabrominated diphenyl ether on. Asian Journal of Ecotoxicology, 2012, 7(1): 79–86 [彭颖, 范灿鹏, 廖伟, 等. 2,2',4,4'-四溴联苯醚对大型溞的毒性效应. 生态毒理学报, 2012, 7(1): 79–86] Qu KM, Xu Y, Ma SS,. Acute toxic effects of nitrite and non-ion ammonia on turbot () at different DO levels. Marine Fisheries Research, 2007, 28(4): 83–88 [曲克明, 徐勇, 马绍赛, 等. 不同溶解氧条件下亚硝酸盐和非离子氨对大菱鲆的急性毒性效应. 海洋水产研究, 2007, 28(4): 83–88] Routti H, Letcher RJ, Chu S,. Polybrominated diphenyl ethers and their hydroxylated analogues in ringed seals () from Svalbard and the Baltic Sea. Environmental Science and Technology, 2009, 43(10): 3494–3499 She J, Holden A, Sharp M,. Polybrominated diphenyl ethers (PBDEs) and polychlorinated biphenyls (PCBs) in breast milk from the Pacific Northwest. Chemosphere, 2007, 67(9): S307–S317 Stapleton HM, Baker JE. Comparing polybrominated diphenyl ether and polychlorinated biphenyl bioaccumulation in a food web in Grand Traverse Bay, Lake Michigan. Archives of Environmental Contamination and Toxicology, 2003, 45(2): 227–234 Sun C, Zhao D, Chen C,. TiO2-mediated photocatalytic debromination of decabromodiphenyl ether: Kinetics and intermediates. Environmental Science and Technology, 2009, 43(1): 157–162 Ueno D,KajiwaraN, TanakaH. Global pollution monitoring of polybrominated diphenyl ethers using skipjack tuna as a bioindicator. Environmental Science and Technology, 2004, 38(8): 2312–2316 Voorspoels S, Covaci A, Neels H,. Dietary PBDE intake: A market-basket study in Belgium. Environment International, 2007, 33(1): 93–97 Wang H, Tang X, Sha J,. The reproductive toxicity on the rotiferinduced by BDE-47 and studies on the effective mechanism based on antioxidant defense system changes. Chemosphere, 2015, 135(3): 129–137 Wang Y, Jiang G, Lam PK,. Polybrominated diphenyl etherin the East Asian environment: A critical review. Environment International, 2007, 33(7): 963–973 Wei Q, Song XF, Gao CR,. Effects of stocking density on the growth and physiology of adult turbot and changes in water quality. Progress in Fishery Sciences, 2014, 35(5): 76–82 [玮乔, 宋协法, 高淳仁, 等. 养殖密度对循环水系统中大菱鲆()生长的影响. 渔业科学进展, 2014, 35(5): 76–82] Xu FF. Toxic effects of BDE-47 on two marine Copepods. Master´s Thesis of Ocean University of China, 2013 [徐风风. 四溴联苯醚(BDE-47)对两种海洋桡足类的毒性影响. 中国海洋大学硕士研究生学位论文, 2013] Zhang J. The reproductive and developmental toxicity and mechanism of polybrominated diphenyl ethers in rotifer. Doctoral Dissertation of Ocean University of China, 2013 [张璟. 两种多溴联苯醚对褶皱臂尾轮虫生殖与发育毒性效应及其作用机制的初步研究. 中国海洋大学博士研究生学位论文, 2013] Zhang K, Wan Y, Giesy JP,. Tissue concentrations of polybrominated compounds in Chinese sturgeon (): Origin, hepatic sequestration, and maternal transfer. Environmental Science and Technology, 2010, 44(15): 5781–5786 Zhang L. The toxic effects of BDE-47 on two species of marine microalgae. Master´s Thesis of First Institute of Oceanography, ,State Oceanic Administration, People's Republic of China, 2015 [张丽. 2,2¢,4,4¢-四溴联苯醚(BDE- 47)对两种海洋微藻的毒性效应研究. 国家海洋局第一海洋研究所硕士研究生学位论文, 2015] Zhang YM. Toxicity and effect on anti-oxidant enzymes activity of tetra-bromodiphenyl ether (BDE-47) in marine teleosts. Master´s Thesis of Ocean University of China, 2014 [张雨鸣. 四溴联苯醚(BDE-47)对海洋鱼类毒性和抗氧化酶活性的影响. 中国海洋大学硕士研究生学位论文, 2014] Zhao J. Research progress on the investigation of toxic effects of polybrominated diphenyl ethers on fish. Journal of Shanghai Second Polytechnic University, 2015, 32(3): 177–184 [赵静. 多溴联苯醚对鱼类毒性效应的研究进展. 上海第二工业大学学报, 2015, 32(3): 177–184] Zhou MY, Qu KM, Leng KL,. Rapid determination of polybrominated diphenyl ethers in sediment. Progress in Fishery Sciences, 2014, 35(2): 124–128 [周明莹, 曲克明, 冷凯良, 等. 沉积物中多溴联苯醚快速测定技术. 渔业科学进展, 2014, 35(2): 124–128] Zhou MY, Zhang HZ, Xia B,. Residue levels and distribution character of PBDEs in aquaculture zone of Jiaozhou Bay. Marine Environmental Science, 2010, 29(6): 884–888 [周明莹, 张惠珍, 夏斌, 等. 多溴联苯醚在胶州湾养殖水域含量水平与分布. 海洋环境科学, 2010, 29(6): 884–888] Acute Toxicity of Four Polybrominated Diphenyl Ether Congeners to Marine Organisms:,, and CHI Xiao1,2, XIA Bin2,3, ZHU Lin2,3, CHEN Bijuan2,3①, SUN Xuemei2,3, ZHAO Xinguo2, TANG Xuexi1, QU Keming2 (1. College of Marine Life Sciences, Ocean University of China, Qingdao 266003; 2. Ministry of Agriculture and Rural Affairs, Yellow Sea Fishery Research Institute of Chinese Academy of Fishery Sciences, Key Laboratory of Sustainable Development of Marine Fisheries, Key Laboratory of Fishery Resources and Ecological Environment in Shandong Province, Qingdao 266071; 3. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266237) In this study, we examined the biological toxicity of polybrominated diphenyl ethers, new persistent organic pollutants that can accumulate in organisms and have toxic effects in higher nutritional levels of the food chain. We performed acute toxicity tests using four polybrominated diphenyl ethers (PBDE) congeners, BDE-47, BDE-99, BDE-153, and BDE-209, on three species of marine organism,,, and. The 96 h concentrations for 50% maximal effect (96 h EC50) and 50% lethality (96 h LC50) were calculated for each species. The 96 h LC50and safe concentrations of the four PBDE homologs onwere as follows: BDE-47, 1.39 and 0.10 μg/L; BDE-99, 1.76 and 0.18 μg/L; BDE-153, 3.23 and 0.27 μg/L; and BDE-209, 378.62 and 8.68 μg/L, respectively. The 96 h LC50and safe concentrations of the four PBDE homologs onwere as follows: BDE-47, 0.24 and 0.03 μg/L; BDE-99, 1.42 and 0.82 μg/L; BDE-153, 1.49 and 0.94 μg/L; and BDE-209, 63.93 and 5.09 μg/L, respectively. The 96 h LC50and safe concentrations of the four PBDE homologs onwere as follows: BDE-47, 5.46 and 2.02 μg/L; BDE-99, 6.07 and 2.01 μg/L; BDE-153, 7.35 and 2.17 μg/L; and BDE-209, 118.78 and 58.62 μg/L, respectively. BDE-47 was shown to be particularly toxic to marine organisms, with toxicity decreasing according to the number of Br atoms in the congener molecule in the following order: BDE-47, BDE-99, BDE-153, and BDE-209.The PBDE content of global seawater is currently at the pg/L level, whereas the 96 h EC50and 96 h LC50of the four homologs was at the µg/L level, much higher than the PBDE content of the marine environment. However, owing to the structural stability and environmental persistence of PBDEs, their effects on environmental health cannot be ignored, and further studies will be conducted on their toxicity. Polybrominated diphenyl ethers (PBDEs);;;; Acute toxicity X826 A 2095-9869(2019)06-0088-10 10.19663/j.issn2095-9869.20180606001 http://www.yykxjz.cn/ 迟潇, 夏斌, 朱琳, 陈碧鹃, 孙雪梅, 赵信国, 唐学玺, 曲克明. BDE-47、BDE-99、BDE-153和BDE-209对蛋白核小球藻、大型溞和大菱鲆的急性毒性效应. 渔业科学进展, 2019, 40(6): 88–97 Chi X, Xia B, Zhu L, Chen BJ, Sun XM, Zhao XG, Tang XX, Qu KM. Acute toxicity of four polybrominated diphenyl ether congeners to marine organisms:,, and. Progress in Fishery Sciences, 2019, 40(6): 88–97 * 中国水产科学研究院基本科研业务费(2017HY-ZD0202)和国家自然科学基金委-山东省联合基金项目(U1606404)共同资助[This work was supported by Central Public-Interest Scientific Institution Basal Research Fund,CAFS (2017HY- ZD0202), and the NSFC-Shandong Joint Fund for Marine Ecology and Environmental Sciences (U1606404)]. 迟 潇,E-mail: oucteddy@163.com 陈碧鹃,研究员,E-mail: chenbj@ysfri.ac.cn 2018-06-06, 2018-07-13 CHEN Bijuan, E-mail: chenbj@ysfri.ac.cn (编辑 马璀艳)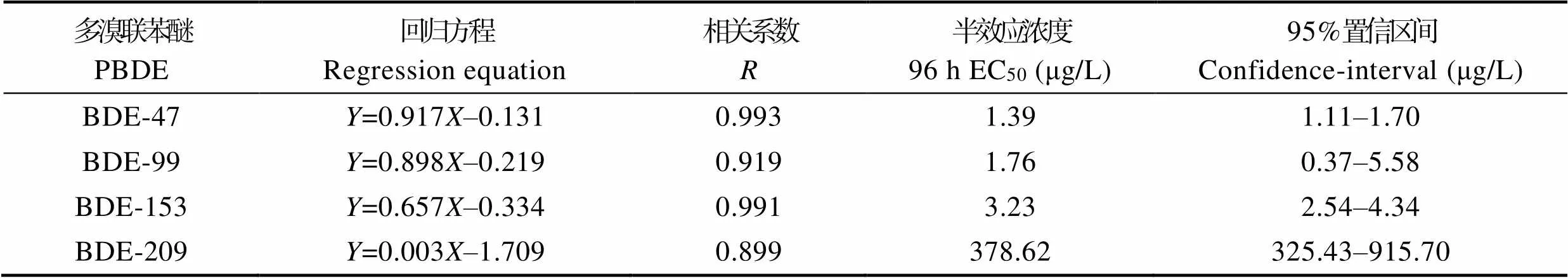
2.2 多溴联苯醚对大型溞的急性毒性

2.3 多溴联苯醚对大菱鲆的急性毒性


2.4 多溴联苯醚的海洋环境风险评估
3 结论
