利用手持技术和分子模型发展化学学科核心素养
2019-12-05苏华虹张道年叶承军吴健华
苏华虹 张道年 叶承军 吴健华
摘要: 以分子间作用力概念学习为例,开展旨在发展学生化学核心素养的教学设计与实施。以“水”为情境载体,设计五个教学活动,引导学生主动参与知识建构。利用手持实验(宏观)表征分子间作用力(微观),通过模型形象地揭示氢键的本质和特征并解释氢键对物质性质的影响。测试结果表明,学生的模型认知水平和微观探析素养有一定程度的提升。
关键词: 分子间作用力; 手持技术; 学科核心素养
文章编号: 1005-6629(2019)11-0049-08 中图分类号: G633.8 文献标识码: B
1 问题的提出
教育部颁布的《普通高中化学课程标准(2017年版)》(以下简称“新课标”)对高中化学教学提出了更高的目标和要求。新课标基于学科本质凝练了化学学科核心素养。为了达成核心素养目标,新课标把创设真实情景、激发兴趣、改变学生的学习方式作为重点。在课程内容中提供了“情景材料建议”和“学习活动建议”[1],引导教师基于真实情景开展教学,强调学生应成为学习的主体,通过学生活动培养和发展学生的化学学科核心素养。
目前,关于“分子间作用力”课例的教学研究,主要着重于以下两方面: 一是厘清“分子间作用力”概念的知识层级结构,在此基础上,结合实例如NaCl的熔点比HCl高、氨气易溶于水等,利用对比、宏微结合等教学策略,采用师生对话的教学方式进行教学设计[2~4];二是实验创新,利用温度传感器测量不同液体挥发时的温度下降速率以比较不同分子的分子间作用力大小[5~7]。而关于如何结合该实验开展课堂教学,并将模型应用于教学,利用模型表征分子间作用力(氢键)的教学设计与实施还未见相关的研究报道。
基于新课标的要求及对已有研究的总结,本文从学生熟悉的水的性质出发,基于真实情境提出问题,利用手持技术和模型解决问题,从宏观和微观两方面表征分子间作用力,以期发展学生化学学科核心素养。
2 教学内容分析
2.1 教材及課标分析
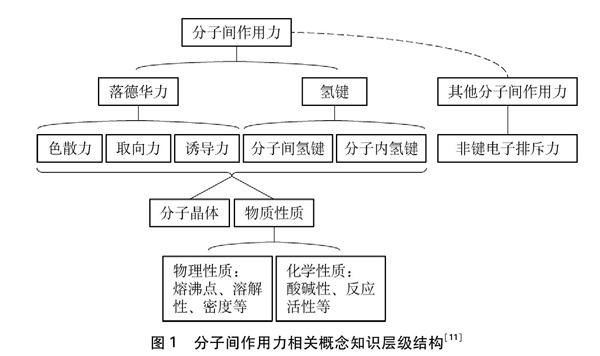
分子间作用力是化学学科的重要概念。范德华力和氢键是常见的两种分子间作用力。目前,化学教育专家一般认为分子间作用力的知识层级结构如图1所示。
三种版本的高中教材(人教版[8]、苏教版[9]、鲁科版[10])均用较大的篇幅介绍 “范德华力和氢键”,但内容的广度和深度以及所选取的素材稍有不同。
对于范德华力,三种版本都介绍了影响范德华力大小的因素。但鲁科版和苏教版还阐明了范德华力的三种来源,说明范德华力的本质是电性作用。对于氢键,内容的深度有所差异。人教版仅介绍氢键形成的条件,另外两版教材利用图示讲解了氢键形成的本质,鲁科版还阐述了氢键的特征: 方向性和饱和性。三版教材都着重介绍了氢键对物质性质的影响以及氢键对生物大分子结构和生理活性的重要意义。综上,不同版本教材内容有所差异,教师应该如何取舍?
新课标对本课题的内容要求如下: (1)知道范德华力和氢键是两种常见的分子间作用力;(2)能说出氢键的特征和实质;(3)能列举含有氢
图1 分子间作用力相关概念知识层级结构[11]
键的物质及其性质特点;(4)能说明分子间作用力(含氢键)对物质熔、沸点等性质的影响;(5)能从分子间作用力(含氢键)的角度对生产、生活、科学研究中的简单案例进行分析,举例说明氢键对于生命的重大意义。新课标强调了氢键的本质、形成条件、特征等,对范德华力的成因、实质、特征没有提出要求,但强调了两种分子间作用力的大小对物质性质的影响及其对真实情景的解释。
2.2 学生学习特征分析
学习本节课之前,学生已有一定的知识储备,如表1所示。
表1 上课前学生的知识储备
学生已有知识知识来源该知识认识水平
液体挥发吸热生活常识感性认识
冰的密度比水小生活常识感性认识
分子间存在作用力(范德华力)必修《化学2》“科学视野”栏目了解范德华力的存在、大小及其对物质熔、沸点的影响
HF、 H2O、 NH3分子间存在氢键必修《化学2》“科学视野”栏目知道这三种分子间存在氢键及氢键对它们熔、沸点的影响,但未从特殊到一般,未学习氢键形成的本质和条件
利用杂化轨道理论判断中心原子的杂化方式和分子立体构型化学选修3《物质结构与性质》第二章第三节能熟练地应用理论判断分子中心原子轨道杂化方式及其立体构型
学生在必修阶段已经了解范德华力和氢键的存在及其对物质熔、沸点的影响,但还未学习氢键的本质、形成条件及其对物质其他性质的影响,这将是本节课学习的重点。学生积累的生活经验及应用杂化轨道理论判断分子立体构型的知识为本节课的开展奠定了知识基础。本节课也将引导学生从微观层面认识液体挥发过程和冰的密度,将感性认识上升到理性认识。
Melanie等利用文字和画图两种方式调查学生对分子间作用力的理解程度[12],发现大部分的学生对分子间作用力概念的理解是模糊的,至少55%的学生将分子间作用力理解为一个分子内的作用力或化学键。因此他建议在教学中,应该注重区分分子间作用力和化学键这两个概念。作者在文中还提及,不同测试方式下学生的表现不同,应采用多样化的的方式如文字描述、画图、访谈等,更加全面和动态地评估学生对分子间作用力这一概念的理解水平。
基于此,确定本节课重点要解决的问题: 一是氢键的形成条件、本质和特征;二是分子间作用大小的比较方法和影响因素;三是分子间作用(含氢键)大小对性质和晶体结构的影响。同时,采用文字描述、画图、模型和实验等手段,多维度表征分子间作用力,将微观上的作用力显现化,帮助学生区分化学键和分子间作用力。
3 教学手段
3.1 手持技术
手持技术是由数据采集器、各类传感器及配套的软件组成的,可用于定量采集数据并能与计算机连接的实验技术系统,它能够实时定量地测量反应过程的多种变化量(如温度、压强、浓度、pH、电导率等)。已有研究表明,手持技术实验,结合“四重表征”教学模式能较好地促进学生对抽象概念、反应原理等知识的认识和理解[13~15]。
3.2 模型
本文采用自制模型和塑料模型。自制模型是指用不同大小、不同颜色的橡皮泥球表示不同的原子,用牙签表示氢键。塑料模型是用不同大小、不同颜色的塑料小球表示不同的原子,用塑料棒表示氢键。
采用不同的模型以达成不同的教学效果。自制模型的橡皮泥小球上没有固定的孔,学生拼接时候要考虑氢键的个数和方向,因此采用自制模型能够评价学生对氢键方向性和饱和性的认识水平。但自制模型较软,拼接空间立体构型如冰晶体的模型容易塌陷,因此宜采用较坚硬的塑料模型拼接冰晶体的模型。
4 核心素养为本的教学流程
基于对教学内容、学生认识和已有研究的分析,设计本节课的教学环节及教学目标如图2所示。
图2 教学流程图
5 教学过程
5.1 情景导入,提出问题
[情景导入]将蘸有水和酒精的棉花球分别拭擦在手背上,感受有何变化?
[学生体验]手背擦过酒精有变凉的感觉。
[教师提问]为什么會变凉?液体挥发吸热的本质原因是什么?
(学生对后一个问题一时答不出)
[教师提示]以水的挥发为例,挥发前后,微观上发生了什么改变?挥发过程需要破坏哪些作用力?
[学生回答]挥发后,液态水分子变成气态水分子,内部的氢氧键没有断裂,挥发过程中破坏的是不同水分子间的作用力。液体挥发需要吸热以克服分子间作用力。
[教师追问]为什么酒精挥发时,吸热更多呢?
[学生]因为乙醇分子间作用力比水小,更容易挥发,有更多的乙醇分子需要吸收热量以克服分子间作用力。
[教师]通过活动,可知分子间存在作用力,且不同分子间的作用力不同。这节课将以水分子为例,探讨分子间究竟存在哪些作用力以及它对物质性质有哪些影响?
5.2 小组拼接模型——认识水分子间氢键的本质及特征
[教师讲解]水分子间的作用力有两种类型——范德华力和氢键。范德华力是分子间普遍存在的一种作用力;通过一段视频来认识水分子间的氢键。
与电负性强的原子(如N、 O、 F)结合的氢原子会带上部分正电荷,能与带部分负电荷的原子(电负性强的原子如N、 O、 F)形成氢键,氢键可表示为(N、 O、 F)X—H…Y(N、 O、 F)。
[布置任务]每个小组根据“知识支持”栏目的提示,利用5个水分子自制模型及牙签(表示氢键),拼接冰晶体中水分子间的氢键。
知识支持
已知冰晶体中,水分子间主要的作用力是氢键,每个水分子可以与周围四个水分子形成氢键[16]。
[展示和评价]学生拼接出的水分子间的氢键模型主要有四种类型,相应分析如表2所示。
表2 学生拼接的水分子间的氢键模型及相应分析
学生汇报时对模型的描述师生共同评价
资料卡片显示,一个水分子与周围四个水分子形成氢键,所以一个水分子应该与其余四个水分子相连氢键不是氧原子与氧原子间的相互作用力不理解氢键的本质
以一个水分子为中心,其氧原子与相邻四个水分子中的氢原子形成氢键能理解氢键的本质但一个氧原子能形成四个氢键吗?
中心水分子中两个氢原子分别与另外两个氧原子形成氢键,中心水分子的氧原子再与两个氢原子分别形成氢键能理解氢键的本质及饱和性但中心水分子形成的四个氢键是在同一平面吗?
续 表
学生汇报时对模型的描述师生共同评价
中心水分子一共形成四个氢键。氢键是一种正负电荷的静电作用力,应该在正负电荷最集中的地方形成,氧原子的孤电子对所在的方向与氢原子形成氢键。水分子中氧原子的杂化方式是sp3杂化,4个杂化轨道组成的构型是四面体形,其中2个杂化轨道各存放一对孤电子对。以一个水分子为中心,其余四个水分子应该在四面体的四个顶角上能理解氢键的本质、饱和性和方向性
[归纳总结]氢键的本质类似于静电作用力,但与静电作用力又有不同——氢键具有方向性和饱和性。
在形成水分子间的氢键时,氧原子的孤电子对所在轨道的轴应该尽可能与另外一个水分子的H—O键在同一直线上,这样两个氧原子间排斥力最小,这就是氢键的方向性。
氧原子只有两对孤电子对,因此一个氧原子只能形成两个氢键;而氢原子因为原子半径小,因此只能形成一个氢键 ,这就是氢键的饱和性。
因此,冰晶体中每个水分子在其两个O—H键及其两个孤电子对方向与四个水分子相互接触形成氢键,形成一个以水分子为中心,其余四个水分子为四面体顶点的四面体结构单元。
[学生]不同分子间能否形成氢键?
[教师]可以。氢键可以存在于不同分子间,如乙醇和水分子间能形成氢键。且还能在分子内形成。例如邻羟基苯甲醛分子的羟基上的氢原子就能与醛基上的氧原子形成氢键。
5.3 大组组装模型——认识水分子间氢键对其性质的影响
[教师]水分子间的氢键使冰和水呈现出许多独特的物理性质。生活经验告诉我们,液态水结成冰,体积增大。为什么?
[布置任务]根据“知识支持”栏目的提示,小组间合作,组装水分子间的四面体骨架,拼接冰晶体模型。
知识支持
已知自然界常见的冰主要是六方晶系的。水分子以四面体为骨架,这些四面体相互连接可以得到六方晶系的冰晶体,每两个四面体间共用一个水分子,每三个四面体间连接形成一个12元环(环上有12个原子)[17]。
[展示和评价]学生拼接出的冰晶体的模型之一如图3所示。
圖3 5个小组合作拼接的冰晶体(局部)模型
[师生总结]在冰的结构中,每个水分子都形成氢键,由于氢键具有方向性和饱和性,由此分子之间有固定的、较大的空隙,形成一个有很多“空洞”的结构。而液体水不是每个水分子均形成氢键,仅部分水分子通过氢键締合,形成一个个分子团簇,团簇之间没有氢键作用,可以靠得比较近。因而冰的密度反而比水小。
5.4 手持技术实验比较分子间作用力大小
[教师提出驱动性问题]通过“擦棉球”活动得知,乙醇的分子间作用力比水的小。为什么?分子间作用力大小与什么因素有关呢?如何比较分子间作用力大小?以正戊烷、正己烷、正庚烷和正丁醇为例。
[学生方案](1) 比较挥发速率;
(2) 将四种液体同时擦在手背上,看看擦哪个更凉;
(3) 用温度计测量液体挥发时的温度下降速率。
[教师点评方案]这四种液体有微毒性,不能将它们擦拭在手上。而液体挥发时温度不断地发生变化,用温度计测量读数不方便。可以实时测量温度变化情况的仪器——温度传感器。
[师生确定实验方案]在四个相同的温度传感器上,蘸取等量的正戊烷、正己烷、正庚烷、正丁醇,分别测量四种液体挥发时的温度下降速率。(实验装置示意图见图4)
图4 实验装置示意图
[学生代表完成实验]将四个温度传感器同时浸入四种液体中,再同时将传感器提起,让液体在传感器的表面上挥发。观察曲线变化情况。
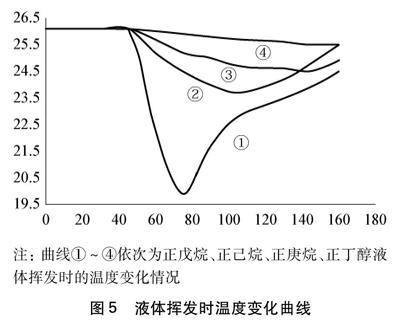
[教师]从曲线上(见图5)得知四种液体挥发温度下降速率分别如何?分子间作用力顺序又如何?
[学生]挥发时温度下降速率: 正戊烷>正己烷>正庚烷>正丁醇;分子间作用力大小: 正戊烷<正己烷<正庚烷<正丁醇。
注: 曲线①~④依次为正戊烷、正己烷、正庚烷、正丁醇液体挥发时的温度变化情况
图5 液体挥发时温度变化曲线
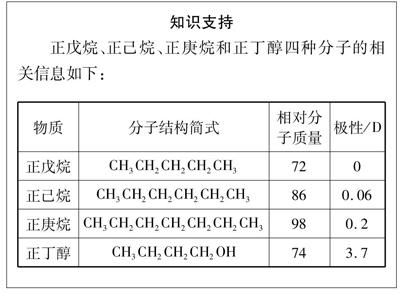
[布置任务]根据“知识支持”栏目的信息,结合实验结果找出分子间作用力大小的影响因素。
知识支持
正戊烷、正己烷、正庚烷和正丁醇四种分子的相关信息如下:
物质分子结构简式相对分子质量极性/D
正戊烷CH3CH2CH2CH2CH3720
正己烷CH3CH2CH2CH2CH2CH3860.06
正庚烷CH3CH2CH2CH2CH2CH2CH3980.2
正丁醇CH3CH2CH2CH2OH743.7
[学生汇报]影响分子间作用力大小的因素: ①结构相似,相对分子质量越大,范德华力越大;②相对分子质量接近,分子极性越大,范德华力越大;③若分子间存在氢键,则分子间作用力明显地增加。
[教师补充]一般而言,氢键作用力稍强于范德华力。但两者都属于分子间作用力,均比化学键小得多,一般分子间作用力比化学键小1~2个数量级。
[解决问题]为什么乙醇的分子间作用力比水的小?
相对分子质量和极性均会影响范德华力的大小。水分子为强极性,其范德华力比乙醇分子间的大。水分子间和乙醇分子间均能形成O…H—O氢键,其作用力大小接近,但1mol水分子平均最多能形成2mol氢键,而1mol乙醇分子平均最多只能形成1mol氢键。因此,水分子间的作用力比乙醇分子间的大。
[教师归纳]
5.5 自主探讨——氢键对生命的重大意义
[教师提出驱动性问题]分子间作用力尤其是氢键是自然界中存在最广泛、最重要的作用力之一。假如没有氢键,世界会发生怎样的变化?
[学生讨论结果](1) 假如没有氢键,H2O的沸点会比H2S低(课后习题查得H2S的沸点为-60℃),地球将不存在液态水;
(2) 没有氢键,冰中水分子间距变小,密度比水大。冬天河湖就会完全结成冰,水中生物会被冻死。
[教师]你能列举其他含有氢键的物质吗?
[学生](1) DNA分子双螺旋结构就是通过碱基对间的氢键结合在一起的;
(2) 蛋白质分子结构也存在着氢键,氢键使其结构稳定。
[教师]如果水分子间没有氢键,生态环境将会发生翻天覆地的变化;复杂的生物大分子也不能稳定地存在。可见,没有氢键就几乎没有生命,氢键对生命有重要的意义。
[课堂小结]通过拼接出水分子间的氢键、冰晶体的微观模型,学习了氢键的本质和特征及其对冰密度的影响;利用手持技术实验比较了微观上的分子间作用力大小,找出了影响分子间作用大小的因素;通过实例,感受到分子间作用力对生活、自然和生命的重要性。结合微观和宏观学习物质性质,是化学学习的核心思维。
6 教学效果与反思
6.1 教学效果
6.1.1 测试工具
利用纸笔测试检验学生“结构决定性质”的模型认识水平和微观辨析核心素养发展水平,问卷设计如图6所示。学生在上课前后分别填写相同的问卷,以作对比研究。
1. 请写出HF、 HCl、 HBr、 HI熔、沸点的大小顺序并解释原因。
2. 请在下列框格中画出并明确地表明三个乙醇分子(CH3CH2OH)间的范德华力和氢键,用相应的文字辅助标识。若你认为乙醇分子间不存在上述的某种作用力,则在下列表格中注明“不存在”。
范德华力
氢键
图6 学生学习效果调查问卷
6.1.2 测试结果及分析
上课前、后均发出45份调查问卷,分别回收
44、 45份调查问卷。
第1题是解释卤素氢化物熔、沸点变化规律,旨在了解学生的迁移应用能力,评价 “结构决定性质”的模型认知水平,相应分析如表3所示。
表3 学生主要答案类型及相关截图(第1题)
学生答案类型及相应代码
“结构决定性质”模型认知水平水平1: 不能将化学事实和理论模型进行合理匹配水平2: 能将化学事实和理论模型进行合理匹配,但对模型的认识片面化水平3: 能运用理论模型解释物质的性质
具体表现认为化学键键能大小或分子稳定性影响物质熔、沸点大小(①)能认识分子间作用力大小影响物质熔、沸点,但忽略了HF分子间的氢键(②)能结合范德华力大小变化规律和氢键准确解释卤化氢熔、沸点变化规律(③)空白(④)
上课前后,选择以上四种答案的学生比例分布图如图7所示。
图7 上课前后学生答案分布图(第1题)
人教版化学2在“科学视野”栏目以主族元素氢化物的熔、沸点为例,介绍了范德华力和氢键对物质熔、沸点的影响。据结果可知,上课前,有47.7%学生认为影响物质熔、沸点的是化学键键能的大小(水平1),仅有两名学生(4.5%)能同时关注到范德华力和氢键对物质熔、沸点的影响(水平3)。本节课后,77.8%学生的认识能达到水平3,但还有一部分学生(8.9%)忽略氢键对物质熔、沸点的影响(水平2)。
第2道是画图题,旨在评价学生微观辨析核心素养发展水平,相应分析如表4所示。
表4 学生主要答案类型及相关截图(第2题)
学生答案类型及相应代码
微观辨析核心素养发展水平水平1: 对微观作用力认识模糊或混淆不同微观作用力水平2: 认识微观作用力的形成本质水平3: 能运用图示准确描述分子间的微观作用力
具体表现将分子内的化学键认为是分子间作用力(①)所画出的图示模棱两可,指向不明(②)无(③)能画出乙醇分子间是氢原子和氧原子形成氢键,但不能理解氢键的形成本质(④)能利用图示准确表示范德华力和氢键(⑤)
上课前后,以上五种答案的学生比例分布图如图8所示。
图8 上课前后学生答案分布图(第2题)
上课前,接近一半的学生混淆了分子内的化学键和分子间作用力(水平1),还有22.7%学生不能判断乙醇分子间存在的作用力(水平1)。这可能是因为必修教材仅介绍了H2O、 HF、 NH3分子间的氢键,但没有从特殊到一般,未介绍氢键的形成本质和条件,因此学生不能迁移应用认识乙醇的分子间作用力。上课后,近2/3的学生能区分分子间作用力和化学键,能用图示准确表示乙醇的分子间作用力(水平3)。
根据测试结果,利用自制模型和球棍模型能降低教学抽象性,有利于学生理解氢键的本质和特征;利用手持实验能帮助学生理解分子间作用力大小对物质性质的影响。学生的“结构决定性质”模型认知水平和微观探析素养有一定程度的提升。
6.2 教学反思
对本节课的设计还有以下几点说明与思考:
(1) 利用手持技术比较液态烷烃的范德华力大小更符合学生的认知思路。已有的研究选用的试剂是醇的同系物,但醇分子间还存在氢键,变量太多会干扰新知识的学习。液态烷烃分子间只存在范德华力,变量单一,更符合学生的认知思路。需注意的是,三种液态烷烃易挥发且有微毒性,因此要在通风橱内取样,测量前样品应装在带胶塞的试管内,测量时让液体在密闭的大试管内挥发,测量完毕后,应放在通风橱内使其挥发除去。
(2) 课前可让学生自习范德华力的成因。本节课根据手持实验,总结了影响分子间作用力大小的因素,但没有解释原因。课堂上有学生提问原因,但因为课标的要求和时间的限制,没有系统地介绍范德华力的成因和三种来源。由此建议将介绍范德华力成因的资料在课前发给学生自主学习,为本节课学习奠定基础。
(3) 本节课仅要求学生拼出以四面体为骨架的冰晶体模型[18]。冰有约20种结构形式,确定合理的冰模型远超出学生的认识范围。因此,仅要求学生组装以四面体为骨架的冰晶体模型。
参考文献:
[1]中华人民共和国教育部制定. 普通高中化学课程标准(2017年版)[S]. 北京: 人民教育出版社, 2018.
[2][11]齐红涛, 赵河林, 王磊. 分子间作用力相关概念及其教学分析[J]. 化学教育, 2014, 35(23): 13~17.
[3]李发顺. 基于课堂实证的分子间作用力对話式课堂构建[J]. 教学月刊·中学版(教学参考), 2018, (3): 22~27.
[4]李发顺. “渐变推理”: 构建分子间作用力的认知模型[J]. 教育研究与评论(中学教育教学), 2018, (12): 81~83.
[5]苏华虹, 钱扬义. 基于“手持技术”实验比较液体有机物分子间作用力大小——以醇类同系物和同分异构体为例[J]. 化学教育(中英文), 2017, 38(15): 49~54.
[6]徐惠. 以数字化探究实验引领“分子间作用力”教学[J]. 化学教育(中英文), 2017, 38(15): 20~23.
[7]周萍, 肖中荣. 基于证据推理增加分子作用力演示实验[J]. 实验教学与仪器, 2018, 35(Z1): 21~23.
[8]宋心琦主编. 普通高中课程标准实验教科书·物质结构与性质(选修3)[M]. 北京: 人民教育出版社, 2009: 47~50.
[9]王祖浩主编. 普通高中课程标准实验教科书·物质结构与性质(选修3)[M]. 南京: 江苏教育出版社, 2004: 49~53.
[10]王磊主编.普通高中课程标准实验教科书·物质结构与性质(选修3)[M]. 济南: 山东科学技术出版社, 2004: 28~35.
[12]Melanie M, Leah C, Sonia M. Student Understanding of Intermolecular Forces: A Multimodal Study [J]. Journal of Chemiscal Education, 2015, (92), 1288~1298
[13]王立新, 钱扬义, 苏华虹, 等. 手持技术数字化实验与化学教学的深度融合: 从“研究案例”到“认知模型”——TQVC概念认知模型的建构[J]. 远程教育杂志, 2018, 36(4): 104~112
[14]林建芬, 盛晓婧, 钱扬义. 化学“四重表征”教学模式的理论建构与实践研究——从15年数字化手持技术实验研究的回顾谈起[J]. 化学教育, 2015, 36(7): 1~6
[15]韦新平. 基于SOLO分类理论的化学“四重表征”教学研究——以“浓度对化学平衡的影响”为例[J]. 化学教学, 2013, (10): 31~33,49
[16][17]华彤文, 王颖霞, 卞江, 等. 普通化学原理(第四版)[M]. 北京: 北京大学出版社, 2013: 304~305
[18]秦善. 结构矿物学[M]. 北京: 北京大学出版社, 2011: 79~80
