羌活醇及异欧前胡素对脂多糖诱导大鼠成纤维样滑膜细胞增殖抑制的影响
2019-12-04杨策高汉云杨素芳王英豪
杨策,高汉云,杨素芳,王英豪
(福建中医药大学药学院,福建 福州 350108)
类风湿性关节炎(rheumatoid arthritis,RA)是一种以关节组织慢性病变为特征的自身免疫性疾病,在其整个病程中滑膜异常增殖反应起到重要的影响作用,目前西医尚无特效治疗方法[1]。RA属中医“痹证”范畴,中医对痹证的治疗有几千年的丰富经验,如羌活临床上擅治上肢痹痛,现代研究亦证实了羌活水提物、醇提物、挥发油提取物于在体研究中具有药理活性[2-4],其活性成分为羌活醇、异欧前胡素等,《中国药典》2015年版中规定羌活醇和异欧前胡素作为羌活质量控制指标,总量不少于0.4%[5],但羌活醇和异欧前胡素的活性研究鲜见报道。而对体外活性研究多以细胞增殖情况及细胞分泌因子或介质展开,如王子成等[6]采用细胞增殖水平来考察药效的研究;张希峣等[7]通过测定细胞因子(肿瘤坏死因子α,TNF-α)分泌量来考察脂多糖诱导对细胞增殖抑制的影响;石廷雨等[8]以一氧化氮(NO)分泌量考察对人主动脉血管内皮细胞损伤。因此,本文就羌活醇及异欧前胡素这两种活性物质对大鼠成纤维样滑膜细胞的增殖抑制作用,对胞体内和上清液中的介质NO水平的测定,以及对TNF-α的表达影响来探究其对大鼠成纤维样滑膜细胞的增殖抑制。现研究报道利用脂多糖(LPS)激活免疫系统诱发滑膜异常增生进行临床药物疗效的确定[9],故本研究是采用LPS作为诱导因子刺激正常大鼠滑膜细胞(FLS),建立胶原诱导性大鼠成纤维样滑膜细胞(fibroblast-like synoviocytes of college induced arthritis,CIA-FLS)[10],探讨羌活醇及异欧前胡素对大鼠成纤维样滑膜细胞增殖的抑制作用,并通过噻唑蓝(MTT)比色法测定模型细胞给药后的半数抑制率(IC50),硝酸还原酶法测定羌活醇和异欧前胡素对大鼠成纤维化滑膜细胞介质NO水平的影响;酶联免疫实验(ELISA)法测定羌活醇和异欧前胡素对大鼠成纤维化滑膜细胞分泌的TNF-α表达的影响,为中药羌活及其活性成分的应用提供实验依据。
1 材料
1.1 细胞 大鼠滑膜细胞购于上海齐氏生物科技有限公司,取材于正常SD大鼠滑膜组织,培养条件为DMEM/F12+10%胎牛血清+1%双抗。
1.2 仪器 十万分电子天平(MS105DU,Mettler Toledo公司);倒置式系统显微镜(TS-100F,日本Olypus公司);Countsar自动细胞计数仪(IC1000,上海睿钰生物科技有限公司);EXL-800酶标仪(N12639-01,塞默飞世尔仪器有限公司);恒温水浴锅(DK-420,上海精宏实验设备有限公司);低速台式离心机(TDZ4A-WS,湖南湘仪实验室仪器有限公司);洁净工作台(SW-CJ-1FD,苏州安泰空气技术有限公司);超声波细胞粉碎仪(JY92-2D,宁波新芝生物科技股份有限公司);低温高速台式离心机(5418R,德国Eppendorf生命科技公司)。
1.3 药品与试剂 羌活醇(批号:728A022,Solarbio公司);异欧前胡素(批号:1229A022,Solarbio公司);醋酸泼尼松龙滴眼液(1%醋酸泼尼松龙,进口药品注册账号:H20130131,5 mL:50 mg);脂多糖(LPS,美国Sigma公司);四甲基偶氮唑盐(MTT,美国Sigma公司);二甲基亚砜(批号:20140904,美国Sigma公司);DMEM/F12基础培养液(批号:AD21573273,Hyclone公司);0.25%胰蛋白酶(批号:J170049,Hyclone公司);磷酸盐缓冲液(批号:AD18108279,Hyclone公司);一氧化氮(NO)测试试剂盒(批号:A012,南京建成生物工程研究所);大鼠TNF-α ELISA试剂盒(批号:KE20001,美国Proteintech公司)。
2 方法
2.1 药物配制 精密称取羌活醇及异欧前胡素各约5.0 mg,加入二甲基亚砜(DMSO)12.5 μL(含量≤1‰总药液量),震荡并超声处理使其融为黏稠状液体,DMEM/F12完全培养液定容到12.5 mL,0.22微孔滤膜过滤,即得羌活醇、异欧前胡素液,浓度均为400 μg·mL-1,4 ℃放置备用。
醋酸泼尼松龙滴眼液含有1%醋酸泼尼松龙,用DMEM/F12培养液稀释浓度至400 μg·mL-1,0.22微孔滤膜过滤,4 ℃放置备用。
2.2 大鼠滑膜细胞(FLS)的培养 FLS细胞培养于含10%灭菌胎牛血清(FBS)及1%双抗的DMEM/F12培养基中,37 ℃、5%CO2的培养环境孵育。2~3 d传代一次,传代方式为一传二。待细胞生长达培养瓶底部80%~90%面积时,弃去培养液,PBS清洗两次后加入0.25%胰蛋白酶消化液1 mL,细胞消化时间约为1 min。1 500 rpm离心5 min。弃去上清液,按1∶2传代培养或1 mL冻存液冻存备用。FLS细胞经传至3~5代最佳。
2.3 大鼠成纤维样滑膜细胞模型(CIA-FLS)的建立 将对数生长期的FLS细胞常规消化离心后,调整细胞悬液浓度为5×104个/mL,以细胞悬液200 μL/孔加入96孔板中,实验组别设置:LPS 药物组(100 μL正常细胞培养基+0.1、1、5、10、50 μg·mL-1LPS溶液)、空白对照组(100 μL正常细胞培养基)。每组6个平行孔。加入不同浓度LPS,于37 ℃、5% CO2培养箱内孵育24 h后,加入100 μL MTT溶液/孔培养基,随后将96孔板置于培养箱内继续孵育4 h,酶标仪570 nm处测各孔OD值。按下式计算细胞抑制率(IR),以IR≤10%为标准来确定LPS的最佳浓度。
IR =(OD空白-OD模型)/OD空白×100%。
2.4 给药及分组 将造模后的CIA-FLS细胞调至5×104个/mL的细胞浓度,以200 μL/孔加入96孔板中,于37 ℃、5% CO2培养箱内孵育24 h后给药。实验组别设置为:阴性组(CIA-FLS细胞)、阳性对照组(CIA-FLS细胞+1%醋酸泼尼松龙制备液)、药物组(CIA-FLS细胞+羌活醇/异欧前胡素25、50、100、200、400 μg·mL-1),每组6个复孔。
2.5 对不同浓度、不同干预时间下CIA-FLS细胞增殖的影响 将CIA-FLS细胞培养至传代,按“2.4”项下分组于96孔板上以200 μL/孔进行铺板,同条件下铺3板。24 h后观察细胞生长状况,细胞数80%~90%即可。吸弃培养液,3板CIA-FLS细胞依次给药每孔均100 μL处理12、36、60 h。避光条件下加入MTT(0.5 μg·mL-1)100 μL/孔。于37 ℃、5% CO2培养箱内孵育4 h后,吸弃上清液后加入二甲基亚砜 100 μL/孔。震荡10 min后,570 nm下检测OD值,结果以6个复孔均数表示。
2.6 硝酸还原酶法测定胞内及细胞液中炎症介质NO水平 将CIA-FLS细胞培养至传代,根据分组(阴性组,羌活醇组,异欧前胡素组)进行1传3传代,培养至80%~90%细胞数即可。羌活醇组和异欧前胡素组给药浓度100 μg·mL-1,给药时间12 h,空白组给予同时间的培养液处理。待12 h后,则吸取培养瓶中上清液离心处理,离心条件2 500 rpm,10 min,取离心后的上清液,备用。培养瓶中细胞磷酸盐缓冲液(PBS)清洗干净,各加入0.5 mL PBS刮取细胞,吸取瓶中PBS进行超声破碎细胞,2 500 rpm,10 min离心处理,取离心后的上清液,备用。
2.7 ELISA法测定CIA-FLS分泌炎症因子TNF-α含量 将CIA-FLS按5×104个/孔接种于96孔板,培养24 h,弃去上清液,依次加入培养液,50 μL·mL-1羌活醇,50 μL·mL-1异欧前胡素,均100 μL于模型组,羌活醇组,异欧前胡素组,每组3个复孔,并设置空白组加入等量的培养液处理,孵育12 h。取细胞培养液离心处理,离心条件2 500 rpm,10 min。吸取上清液,用ELISA试剂盒检测上清液中TNF-α的含量。
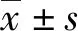
3 结果
3.1 对细胞形态改变的影响 正常大鼠滑膜细胞见图1A,多呈规则短梭状,中间宽,两头细,大小形态均一,梭端由细丝状连接胞间;造模后损伤大鼠滑膜细胞见图1B,多呈长梭状,形态明显大于正常大鼠滑膜细胞,胞体呈纤维样,有少量空泡,增殖能力增强,同时间段下细胞代谢物增多,且有集落性和层叠性生长特征;造模并给羌活醇,培养24 h后的损伤大鼠滑膜细胞见图1C,细胞略皱缩呈长梭状,少数呈短梭状,仍有纤维样及空泡,核呈圆状或椭圆状,细胞量略微减少,观察通透性提高,即细胞层叠性减少;造模并给异欧前胡素,培养24 h后损伤大鼠滑膜细胞见图1D,细胞明显皱缩呈长条状,仍有纤维样及空泡产生,细胞抑制率较羌活醇组更强,少见细胞层叠;造模并给阳性药,培养24 h后损伤大鼠滑膜细胞见图1E,细胞量明显锐减,核显圆状或椭圆状且明显突出,胞间无层叠。
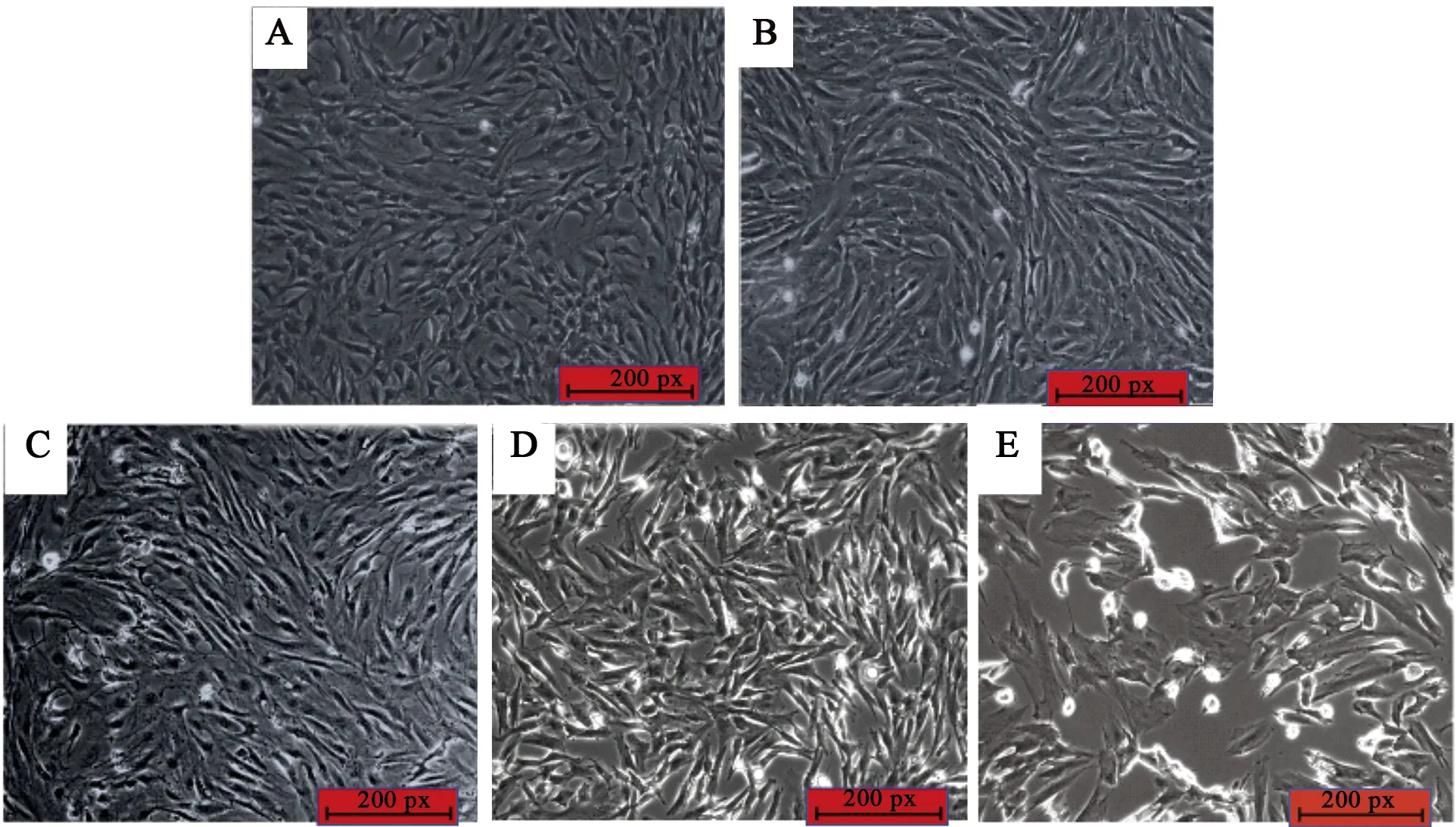
A.正常组细胞;B.模型组细胞;C.造模后的羌活醇组细胞;D.造模后的异欧前胡素组细胞;E.阳性组细胞图1 给药前后大鼠成纤维化滑膜细胞的变化
3.2 LPS诱导大鼠滑膜细胞模型的剂量优选 由表1可知,LPS对正常大鼠滑膜细胞的增殖抑制程度随浓度增加而升高。10 μg·mL-1LPS对正常大鼠滑膜细胞的增殖抑制率为9.71%,接近于10%,损伤的大鼠滑膜细胞呈现薄片并不规则宽大状形态,如图1B所示。即确定该浓度下造模成功,并可进行下一步实验研究。
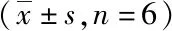
表1 LPS对正常大鼠滑膜细胞增殖的影响
注:与阴性组比较*P<0.05,**P<0.01
3.3 羌活醇对CIA-FLS细胞增殖的影响 如图2所示,同一时间下,随浓度增长羌活醇对CIA-FLS细胞的增殖抑制能力呈正相关关系,且与阴性组比较,差异均有统计学意义(P<0.01)。同一浓度下,随时间增长羌活醇对CIA-FLS细胞的增殖抑制能力越强,12、36、60 h组间两两比较均具有显著性差异(P<0.01或P<0.05),同条件下的给药组均低于阳性药组的抑制力。实验给药12 h未测出羌活醇IC50值,给药36 h时IC50值190 μg·mL-1,给药60 h时IC50值80 μg·mL-1。
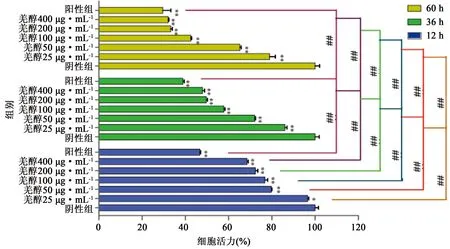
图2 不同浓度及不同时间给药羌活醇对CIA-FLS增殖能力的影响 注:与阴性组比较,*P<0.05,**P<0.01;组间两两比较,#P<0.05,##P<0.01
3.4 异欧前胡素对CIA-FLS细胞增殖的影响 如图3所示,同一时间下,随浓度增长异欧前胡素对CIA-FLS细胞的增殖抑制能力呈正相关关系,且与阴性组比较,差异均具有统计学意义(P<0.01)。同一浓度下,随时间增长异欧前胡素对CIA-FLS细胞的增殖抑制能力越强,12、36、60 h组间两两比较均具有显著性差异(P<0.01或P<0.05),同条件下高浓度异欧前胡素抑制率高于阳性药组。实验给药12 h时测得异欧前胡素IC50值160 μg·mL-1,给药36 h时IC50值120 μg·mL-1,给药60 h时IC50值45 μg·mL-1。
3.5 CIA-FLS胞体及细胞液中NO含量 由表2可知,CIA-FLS细胞模型组在细胞液上清和细胞上清NO的含量均是最高。给药羌活醇或异欧前胡素后,NO的含量在胞液上清及胞内上清均有所下降,且都是异欧前胡素组下降水平更多。在细胞液上清NO含量统计中,与模型组相比,羌活醇下降少,无统计意义,异欧前胡素显著下降,具有统计学意义(P<0.01);在细胞上清NO含量统计中,与模型组相比,羌活醇和异欧前胡素均显著下降,具有统计学意义(P<0.01)。
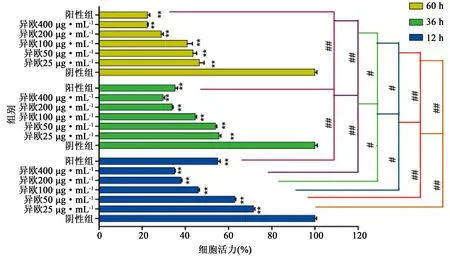
图3 不同浓度及不同时间给药异欧前胡素对CIA-FLS增殖能力的影响 注:组内与阴性组比较,*P<0.05,**P<0.01;组间两两比较,#P<0.05,##P<0.01
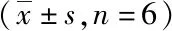
表2 给药羌活醇及异欧前胡素对促炎因子NO含量的影响
注:与模型组比较,*P<0.05,**P<0.01
3.6 CIA-FLS分泌细胞因子TNF-α的含量 由图2所知,CIA-FLS细胞模型组分泌的细胞因子TNF-α水平最多,加药羌活醇和异欧前胡素后,TNF-α水平均有显著性降低(P<0.01),且异欧前胡素组下降幅度远大于羌活醇组。
3.7 羌活醇与异欧前胡素的增殖抑制力比较 羌活醇与异欧前胡素均对CIA-FLS细胞有一定的增殖抑制能力,如图4所示,12、36、60 h时间点下给药不同浓度的异欧前胡素对CIA-FLS细胞的增殖抑制能力明显强于羌活醇(P<0.01或P<0.05)。同条件下,除在60 h给药浓度100、200 μg·mL-1的二者差异无统计学意义外,其他比较结果统计学意义差异(P<0.01或P<0.05)。结果提示异欧前胡素对CIA-FLS细胞的抑制能力明显强于羌活醇。
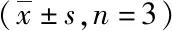
表3 给药羌活醇及异欧前胡素对炎性细胞因子TNF-α含量的影响
注:与模型组比较,*P<0.05,**P<0.01
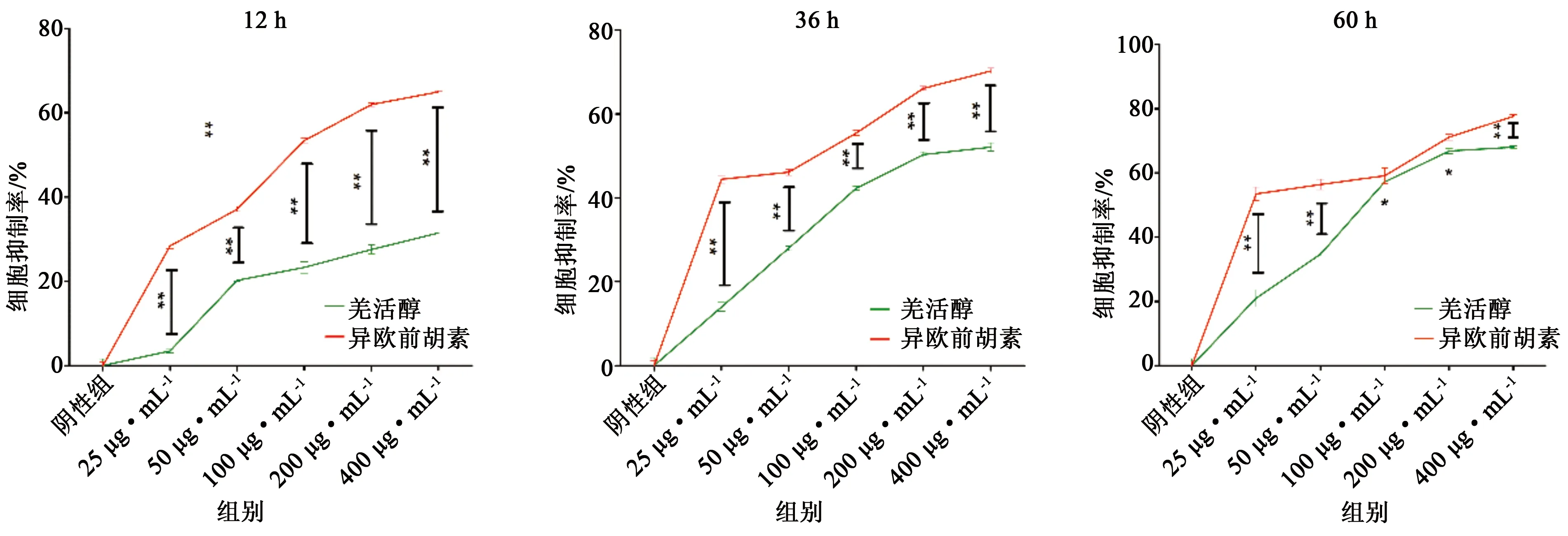
图4 羌活醇与异欧前胡素增殖抑制力比较 注:羌活醇组与异欧前胡素组比较,*P<0.05,**P<0.01
4 讨论
RA是一种慢性、自身免疫性疾病,滑膜异常增生并导致关节畸形和功能障碍。它被列为世界性疑难杂症。而临床上滑膜组织的过度增殖,必然导致关节性肿大,并伴随着疼痛影响到患者的正常生活,久而久之,出现畸形,更有甚者会瘫痪在床。然而,现对于RA型疾病并无特效药。近年来,多有学者表明滑膜成纤维细胞(fibroblast-like synoviocytes)在整个病理变化中起到重要作用。Firestein等[11]认为类风湿性关节炎中滑膜细胞具有转化细胞的特性,在关节病理中,过度生长的滑膜细胞功能改变起着至关重要的作用。还认为RA关节组织滑膜异常增生可能是因为滑膜细胞凋亡机制障碍所引起。在RA中,FLS可通过可溶性因子和细胞表面相互作用,细胞因子或介质(TNF-α、NO等)被激活,随而,大量分泌导致关节畸形[12-14]。
本实验采用羌活中两大活性成分,即羌活醇和异欧前胡素,探讨对大鼠成纤维样滑膜细胞增殖的抑制作用。这两种成分在中国特有属种植物羌活中含量高,也是其主要的药效成分,被广泛应用,一直以来也被国内外学者所青睐。至今,国外研究注重羌活治疗疼痛机制,而国内研究多体现在含量测定、质量标准以及水提液或醇提液的药理作用上,如周毅等[15]对羌活中的挥发油及异欧前胡素进行含量测定,陈智煌等[16]提取羌活挥发油并致炎症小鼠模型观察抗炎、镇痛作用。本实验明确药效物质基础,旨在运用LPS诱导的成纤维样大鼠滑膜细胞,探讨活性成分羌活醇和异欧前胡素对其的增殖抑制作用,研究发现10 μg·mL-1LPS对正常大鼠滑膜细胞的增殖抑制率为9.71%时,倒置电子显微镜下观察细胞形态发生变化,呈现纤维样,具有空泡,个体明显粗大于正常滑膜细胞,并集落性和层叠性生长,即确定造模成功。MTT法检测羌活醇及异欧前胡素对大鼠成纤维化滑膜细胞增殖抑制的影响,实验中设置宽范围的浓度梯度(25、50、100、200、400 μg·mL-1)及时间长度(12、36、60 h),以IC50值为指标点,探讨俩活性成分的增殖抑制力度。结果发现,12 h时,低浓度25 μg·mL-1的羌活醇有明显的差异性(P<0.05),异欧前胡素有极明显的差异性(P<0.01)。且羌活醇和异欧前胡素可剂量依赖性和时间依赖性抑制CIA-FLS细胞过度增殖反应,并干扰细胞异常凋亡状况,恢复细胞凋亡与细胞增殖的平衡机制。36、60 h时,羌活醇IC50在190、80 μg·mL-1;12、36、60 h时,异欧前胡素160、120、45 μg·mL-1。硝酸还原法测NO水平,结果发现,与模型组相比,加药羌活醇(25 μg·mL-1)或异欧前胡素(25 μg·mL-1)均能显著降低NO介质的总体含量,且异欧前胡素组的NO含量更低。ELISA测TNF-α含量,结果发现,与模型组相比,加药羌活醇(25 μg·mL-1)或异欧前胡素(25 μg·mL-1)均能显著降低细胞因子TNF-α含量,且异欧前胡素组的TNF-α含量更低。由此也表明,异欧前胡素抵抗CIA-FLS细胞增殖的能力更强。本实验研究证实了羌活活性成分羌活醇和异欧前胡素对大鼠成纤维样滑膜细胞均有增殖的抑制作用,且异欧前胡素抑制力优于羌活醇,但这两种活性成分通过何种机制来实现其抑制滑膜细胞凋亡异常的作用,还有待于进一步加以阐释。
