猪源抗菌肽PR-39对畜禽常见病原菌的抑菌活性及与抗生素协同杀菌效应研究
2019-12-04吴科榜管庆丰张海文
华 蕊 吴科榜,2 管庆丰,2 张海文,2*
(1.海南大学热带农林学院,海南海口570228;2.海南大学热带动物繁育与营养学实验室,海南海口570228)
为了提高畜禽对饲料的利用及畜禽产品的质量,在饲料中加入抗生素已成为普遍现象。但抗生素的滥用不仅容易造成动物肠道菌群紊乱,降低动物免疫力;同时由于药物残留问题,给畜禽、人类、环境带来严重的危害[1]。近年来,将寡聚糖、益生菌、酶制剂等作为抗生素替代物已成为许多科研人员们的研究热点[2-4]。而抗菌肽由于其具有分子量小、热稳定性等特点及广谱抗菌活性、抗炎、抗肿瘤、能够参与免疫调节等生物学功能[5],也引起了广泛关注。
猪源抗菌肽PR-39 属于cathelicidins 家族,最早是由Agerberth B等从猪小肠中分离纯化得到,分子量为4 719.7 Da,富含脯氨酸和精氨酸[6]。PR-39可能通过非成孔机制杀灭细菌[7-9];Boman 等[7]经实验提出PR-39 的致死作用可能是通过阻止蛋白质合成且诱导DNA 复制所需要的某些蛋白质的降解而实现的;具体的杀菌机制尚未研究清楚。有文献报道,PR-39在抗炎症反应[10]、创伤修复和促进血管再生[11]中发挥重要作用。本实验通过测定猪源抗菌肽PR-39对常见病原菌的抑菌活性,以及其与常用抗生素的协同杀菌效应,研究结果为PR-39的实际应用提供理论基础,同时探究PR-39替代抗生素开发为新型饲料添加剂的可行性。
1 材料与方法
1.1 实验材料
1.1.1 实验菌株
革兰氏阴性菌:大肠杆菌K12,大肠杆菌ATCC 25922,大肠杆菌O157∶H7,猪霍乱沙门氏菌CMCC 50020,鼠伤寒沙门氏菌CMCC 50013,肠炎沙门氏菌CMCC 50041,铜绿假单胞菌ATCC 27853;革兰氏阳性菌包括金黄色葡萄球菌ATCC 25923,表皮葡萄球菌ATCC 12228;供试菌株来自于中国普通微生物菌种保藏管理中心。实验菌株均保存于含20%甘油冷冻管中,置于-80 ℃超低温冰箱中。
1.1.2 主要试剂
猪源抗菌肽PR-39,购自吉尔生化(上海)有限公司;阿莫西林购自江西省科达动物药业有限公司;庆大霉素购自四川德润通生物公司;土霉素购自山西兆益生物有限公司;硫酸链霉素购自江西省科达动物药业有限公司。-80 ℃阴暗处保存。
MH 肉汤培养基:准确称取21 g MH 培养基粉末溶解于1 L 蒸馏水中,在高压蒸汽灭菌锅中经121 ℃高压灭菌20 min后,保存于4 ℃备用。
MH 琼脂平板培养基:准确称取21 g MH 培养基粉末和15 g琼脂粉末溶解于1 L蒸馏水中,在高压蒸汽灭菌锅中经121 ℃高压灭菌20 min后,保存于4 ℃备用。
1.2 菌悬液的制备
将-80 ℃冷冻保存的实验菌株解冻,在MH 琼脂平板上接种划线,置于37 ℃恒温培养箱中培养18~24 h;挑选琼脂平板上的单个菌落接种到3 ml 新鲜MH肉汤培养基中,在37 ℃恒温摇床中以250 r/min转速震荡培养过夜;待菌液混浊后,取30 μl 混浊菌悬液转接到3 ml 新鲜MH 肉汤培养基中,在37 ℃恒温摇床中震荡培养2~5 h,转速为250 r/min,直至分光光度计测定600 nm波长下的OD600为0.5左右,菌悬液即可作为实验用菌液。
1.3 猪源抗菌肽PR-39以及抗生素对常见病原菌抑菌活性的测定
1.3.1 最小抑菌浓度(MIC)和最小杀菌浓度(MBC)的测定
将冷冻保存的PR-39抗菌肽取出,在无菌96孔板上依次稀释为2 560、1 280、640、320、160、80、40、20、10、5、2.5、1.25、0.625 μg/ml 的PR-39 抗菌肽稀释液;庆大霉素配制浓度为20、10、5、2.5、1.25、0.625、0.312 5、0.156 2、0.078 1 μg/ml;土霉素配制浓度为20、10、5、2.5、1.25、0.625、0.312 5、0.156 2、0.078 1 μg/ml;阿莫西林配制浓度为320、160、80、40、20、10、5、2.5、1.25、0.625、0.312 5、0.156 2、0.078 1 μg/ml。
取不同浓度的药物(PR-39 抗菌肽或抗生素)10 μl,与90 μl提前制备好的菌悬液混合。另取100 μl菌悬液作为阳性对照组,取100 μl MH肉汤培养基作为阴性对照组。将96孔板密封于37 ℃恒温培养箱中培养18~24 h;观察96 孔板底部是否有细菌沉淀产生,无肉眼可见细菌沉淀的最小浓度即为该药物的最小抑菌浓度(MIC)。
取各药物MIC 及2 倍MIC、4 倍MIC 浓度的内容物10 μl,滴加至MH 固体培养基上进行涂板(每孔做三次重复),待完全吸收后,将其倒置于37 ℃恒温培养箱中培养18~24 h;观察培养基上是否有菌落生长,无菌落生长的培养基所对应的最小浓度即为该药物的最小杀菌浓度(MBC)。
1.3.2 杀菌速率的测定
取1 ml制备好的菌悬液加入到1.5 ml离心管中,再加入PR-39 抗菌肽(抗生素)原液至其最终浓度为1×MIC,同时设置空白对照(即不加PR-39 抗菌肽),于37 ℃下恒温震荡培养,转速为250 r/min;在0、10、30、50、70、90、120 min时,分别从离心管中取10 μl菌悬液于无菌96 孔板中进行100、1 000、10 000 梯度稀释;混匀并各取15 μl 菌悬液至MH 固体培养基上涂板,待吸收完全后于37 ℃恒温培养箱中倒置培养过夜;挑选菌落数在15~100 个的平板进行菌落计数,计算加入PR-39 抗菌肽(抗生素)时菌悬液的细菌浓度;最终以PR-39 抗菌肽作用时间点为横坐标,每毫升菌悬液中所含细菌数(CFU)为纵坐标,绘制动态杀菌曲线。
1.3.3 猪源抗菌肽PR-39与抗生素的协同杀菌效应
以PR-39 抗菌肽和土霉素联用为例:分别配制2、1、0.5、0.25、0.125、0.062 5 倍MIC 浓度的PR-39 抗菌肽和土霉素。根据6×6棋盘实验,将PR-39横行添加,土霉素纵列添加;在96平板孔中滴加5 μl不同浓度的药物,同时加入90 μl菌悬液。由此,使得每一横行孔中PR-39 的浓度依次为2、1、0.5、0.25、0.125、0.062 5 倍MIC,同时每一横行孔中土霉素浓度不变;每一纵列孔中土霉素的浓度依次为2、1、0.5、0.25、0.125、0.062 5倍MIC,同时每一纵列孔中PR-39的浓度不变。混合均匀以后,37 ℃于培养箱中静置培养18~24 h。做三次重复。
根据部分抑菌浓度指数(fractional inhibitory concentration index, FIC index)判断联合药敏实验的效果。
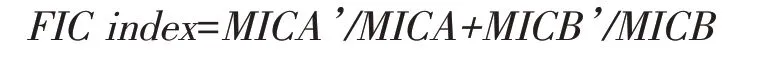
式中:MICA和MICB——分别代表A、B药物单独用药时的MIC值;
MICA’和MICB’——分别代表A、B两药联用时各自的MIC值。
根据以下FIC index 值的范围即可判断PR-39与不同抗生素联合用药的效果。协同效应:FIC index≤0.5 ;相加作用(部分协同):0.5≤FIC index≤1;无关作用:1<FIC index≤2;颉颃作用:FIC index>2。
2 结果
2.1 PR-39 抗菌肽和不同抗生素对病原菌MIC 和MBC的测定(见表1)
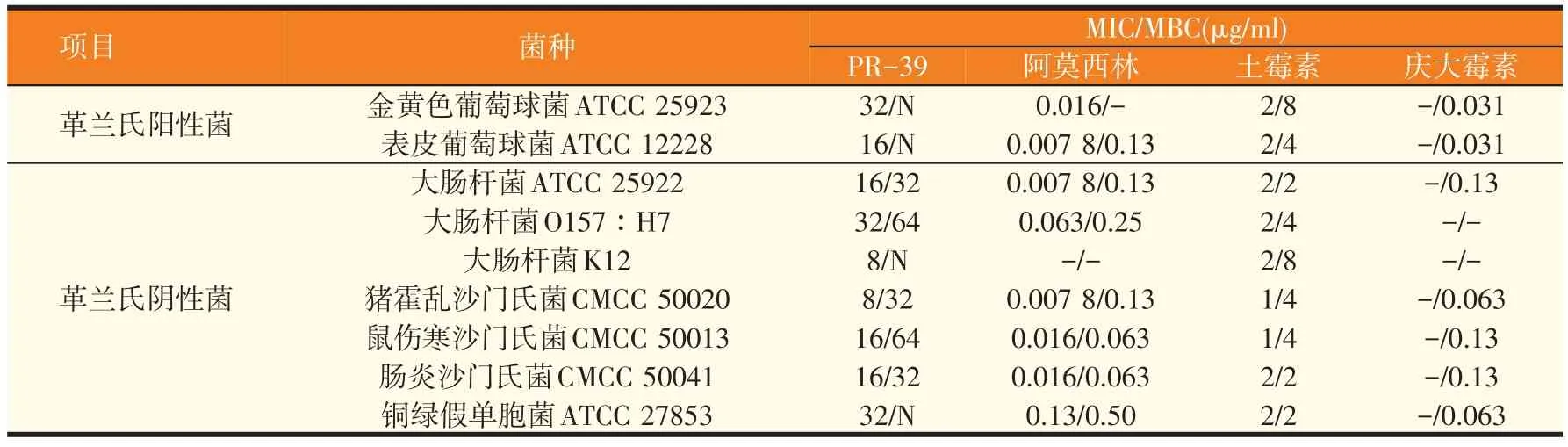
表1 猪源抗菌肽PR-39和抗生素对常见病原菌MIC和MBC的测定结果
从表1可以看出,阿莫西林、土霉素、庆大霉素对常见病原菌的生长均有较好的抑制效果;PR-39抗菌肽的MIC 均在8~32 μg/ml 之间,MBC 大多在32~64 μg/ml,部分菌的MBC 未在药物检测浓度范围内。虽然PR-39抗菌肽对常规致病菌的MIC和MBC高于常见的抗生素,但其对受试的革兰氏阳性菌和革兰氏阴性菌均具有一定的抑菌作用,说明其具有广谱抗菌活性。另外,PR-39 对金黄色葡萄球菌、表皮葡萄球菌这两种革兰氏阳性菌虽然具有一定的抑菌作用,但均未有明显的杀菌现象。因此,提示猪源抗菌肽PR-39的抑菌活性可能主要针对革兰氏阴性菌。
2.2 PR-39抗菌肽和不同抗生素杀菌速率的测定
本实验选取革兰氏阳性菌和革兰氏阴性菌中具有代表性的菌株——金黄色葡萄球菌ATCC 25923和大肠杆菌ATCC 25922,绘制如图1所示的杀菌速率曲线。从图1(A)可以看出,PR-39在120 min内并未有效抑制金黄色葡萄球菌ATCC 25923 的生长,而土霉素和阿莫西林分别在作用10 min 和70 min 后即检测不到金黄色葡萄球菌的菌落形成。图1(B)显示,PR-39 对大肠杆菌作用30 min 即检测不到菌落形成,效果与土霉素相当;阿莫西林的作用较强,只需10 min 左右。结果表明PR-39 对金黄色葡萄球菌ATCC 25923 的抑制作用随时间增加变化不明显著;对大肠杆菌ATCC 25922 的抑菌作用表现出时间依赖性。
2.3 猪源抗菌肽PR-39与抗生素的协同杀菌效应
猪源抗菌肽PR-39 分别与阿莫西林、硫酸链霉素、土霉素对金黄色葡萄球菌ATCC 25923 和大肠杆菌O157∶H7的协同杀菌效应实验结果如表2~表4所示,PR-39 与常用抗生素联合使用均未有颉颃发生。PR-39 与阿莫西林或硫酸链霉素联用时表现为协同作用,FIC指数均小于0.5。PR-39与土霉素联合用药对大肠杆菌O157∶H7 和金黄色葡萄球菌ATCC 25923 均表现为部分协同(相加作用),单独使用时其MIC是其协同作用时的MIC的2~8倍。
3 讨论

图1 PR-39抗菌肽和不同抗生素对金黄色葡萄球菌ATCC 25923(A)和大肠杆菌ATCC 25922(B)的动态杀菌曲线
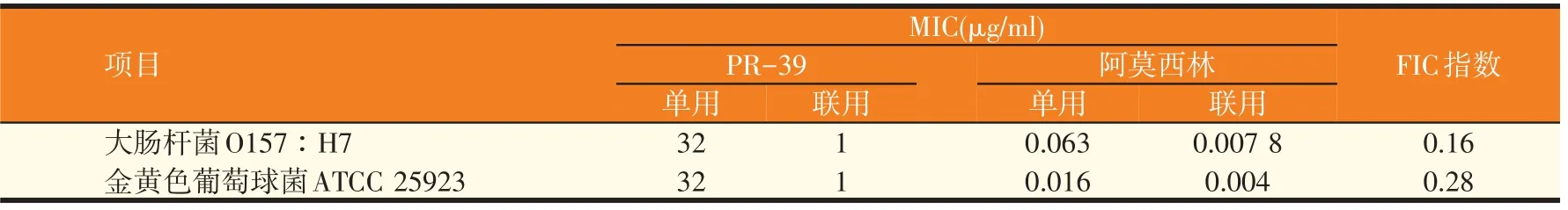
表2 PR-39与阿莫西林的协同杀菌效应
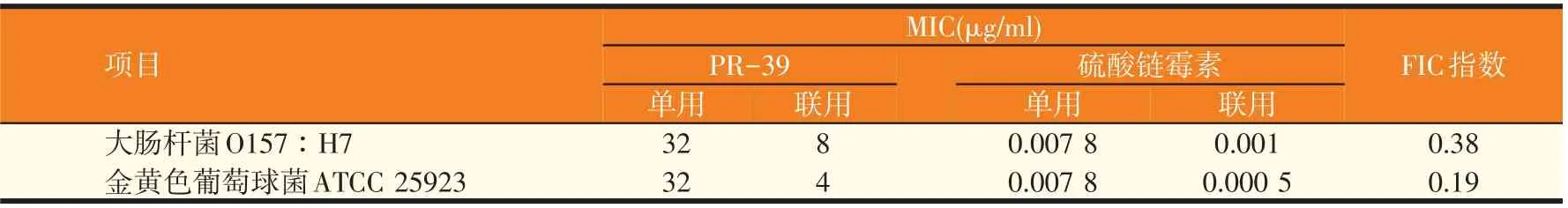
表3 PR-39与硫酸链霉素的协同杀菌效应
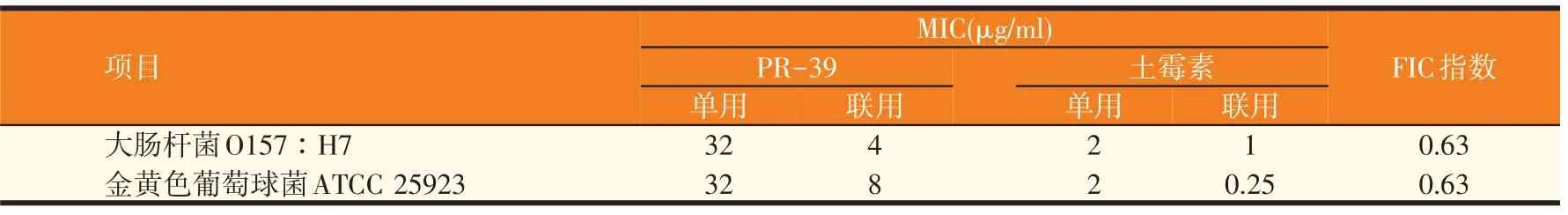
表4 PR-39与土霉素的协同杀菌效应
随着畜牧养殖业的规模化发展,细菌病已经给养殖户造成了重大的经济损失。据不完全统计,我国兽用抗生素比例超过总使用量的50%。抗生素一般通过阻断细菌合成核酸、细胞壁、叶酸、蛋白质等的途径来杀灭细菌,而细菌利用耐药因子产生水解酶或者钝化酶等灭活酶分解抗生素是耐药性产生的原因之一[12]。抗菌肽由于其独特的穿膜机制或者多样化的特异性靶点,不易诱导产生耐药性;作为一种富含脯氨酸和精氨酸的嗜中性粒细胞抗菌肽,PR-39有极大潜力作为抗生素的替代品。
本实验通过微量肉汤稀释法测定了PR-39 对7种革兰氏阴性菌和2 种革兰氏阳性菌的抑菌活性,PR-39 对除铜绿假单胞菌以外的革兰氏阴性菌抑菌效果较好,MIC 范围大都在8~32 μg/ml 之间,MBC 范围则集中在32~64 μg/ml,而对革兰氏阳性菌抑菌效果差,在药物范围内都没有明显杀菌现象。这与Chan 等[13]、Veldhuizen 等[14]的实验结果一致。文献报道与本实验结果均表明,相比对革兰氏阳性菌的效用,PR-39抗菌肽对革兰氏阴性菌具有更好的抑菌效果,其机制尚不清楚。可能是由于PR-39抗菌肽富含脯氨酸和精氨酸,其特殊结构与细菌之间相互作用导致;也可能是细菌自身分泌一些特异性蛋白酶作用于抗菌肽,通过改变抗菌肽的结构从而调控其抑菌活性。关于此类研究也早有文献研究[15],大肠杆菌内寡肽酶B(OpdB)的过表达能够直接影响富含脯氨酸抗菌肽的杀菌活性,体外实验证明OpdB 能有效地切割几种富含脯氨酸的抗菌肽的残基,将其缩短为无活性片段。
天然的PR-39具有广谱的抗菌活性,但对某些细菌的抑菌效果与抗生素对比仍存在差距,因此本实验在测定抑菌活性的基础上,研究了PR-39与抗生素联合用药的效果。适当的联合用药既能丰富PR-39 抗菌谱,同时减少抗生素在动物生产中的使用、减缓细菌耐药性的产生以及降低药物对真核细胞的毒性。关于协同作用已有诸多报道,如刘倚帆等[16]研究发现牛源抗菌肽Lfcin B 与金霉素、Cecroprin A 具有显著协同抑菌作用;王国栋[17]实验证明抗菌肽PG-1 与丁胺卡那霉素、四环素联用对大肠杆菌的抑制有协同或相加作用;李钢等[18]也证明猪防御素和抗生素之间存在协同抑菌作用。本实验中的结果表明PR-39 与阿莫西林、硫酸链霉素、土霉素联用对畜禽常见病原菌的抑制表现为协同或相加作用。土霉素和硫酸链霉素都是通过特异性地与核糖体30S 亚单位结合以抑制蛋白质的合成来达到抑制细菌生长,阿莫西林则是通过与细菌体内的转肽酶结合,使细菌不能利用转肽酶合成糖肽来合成细胞壁而死亡。联合用药表现良好,可能是由于它们结合了各自的杀菌机制,使得能更有效地杀灭细菌。
PR-39与抗生素协同除耐药和药残等问题以外,畜牧养殖业中抗生素的滥用也破坏了畜禽肠道菌群与机体间的动态平衡,肠道菌群的紊乱可导致诸多疾病如自身免疫性、过敏性及细菌疾病等,甚至可通过脑-肠轴引起诸如焦虑、抑郁症等精神疾病[19]。有研究表明PR-39 能缓解细菌感染所致的胃肠屏障功能受损,保护动物胃肠健康[20]。
4 结论
综上所述,PR-39对畜禽常见病原菌有一定的抑制作用,并和三种抗生素之间存在协同杀菌效应,这体现出PR-39 替代抗生素开发成新型饲料添加剂的极大潜力。今后可在本实验基础上,重点研究PR-39的杀菌机制以及联用不同抗生素的相关机理,为抗菌肽在新配方饲料方案中的使用奠定更加完善的实验基础。
