一株产吲哚乙酸耐盐促生菌的分离、鉴定及发酵条件优化
2019-12-04贾西贝王琦琦褚贵新孙燕飞
贾西贝,王琦琦,李 杨,褚贵新,孙燕飞*
(1.石河子大学 生命科学学院,新疆 石河子 832003;2.绍兴文理学院 环境科学与工程系,浙江 绍兴 312000)
随着现代农业的大力发展,在农田中滥用农药、化肥等行为频繁出现,导致土壤质量下降、食品安全性存在隐患。与此同时,人们开始广泛关注具有以环保、安全、作用持久等诸多优点的植物根际促生菌(plant growth-promoting rhizobacteria,PGPR)。因此,大量的促生菌被运用到科研中,并进一步深入到对促生菌生理效应、作用机制的研究以及相关产品的开发和应用。
吲哚乙酸(indole acetic acid,IAA)是普遍存在于植物体内的生长调节剂,其对植物生长有显著的影响[1]。有相关实验表明,IAA在植物体内参与许多生理生化的调节和控制,如细胞的伸长生长、形成层细胞的分裂、维管组织的分化等[2]。此外,IAA能通过对土壤内重金属的吸收和富集,使重金属对植物的毒害减小,从而起到保护植物的作用[3-5]。目前研究发现多种PGPR菌株可以产生IAA,包括芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas)、土壤杆菌属(Agrobacterium)等[6-8]。它们可以通过固氮、溶磷、分泌植物激素等方式,使植物的抗逆性提高,从而促进植物快速生长以及农作物产量增加[9-10]。目前,对具有分泌IAA能力的PGPR的研究已成为热门领域,可以通过对菌株发酵条件优化或者增施PGPR菌肥来提高目标代谢产物[11-12]。张振等[13]从植物根际土壤中筛选出的耐盐节杆菌能分泌IAA,经过一系列单因素试验,得到了最佳发酵条件,在最优的条件下,该菌株产IAA能力可达92.31 mg/L。徐伟慧等[14]研究了不同西瓜PGPR分泌IAA的能力,其中一株菌的IAA产量高达117.3 mg/L。也有研究表明,PGPR的促生效果会受到土壤类型的影响,李哲[15]将标记菌株接种在未灭菌的土壤中,发现其存活能力较好,推测原因可能是土壤中其他生物的分泌物质对其生长产生了有利的作用。但还有一些文献报道,很多根际促生菌在灭菌土壤中的存活能力要大于未灭菌土壤,由此可见,选择适合本地环境的PGPR十分重要[16-17]。
本实验室从碱蓬(Suaeda salsa)根际土壤中分离出一株产IAA菌株,利用单因素及响应面分析法对菌株进行发酵培养条件及培养基成分的优化,旨在提高IAA产量,为后续生物促生菌肥的研究奠定了一定的理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 土壤样品及处理
选取新疆维吾尔自治区石河子市周边土壤盐渍化较为严重的区域,采集该区域(兵团八师147团)内生长情况良好的碱蓬根际土壤,将其立即过2 mm的筛网,封装土样于无菌自封袋中,液氮冷冻保存。
1.1.2 化学试剂
Salkowski显色剂:0.5 mol/L FeCl3与35%HClO4体积比按1∶50配制;吲哚乙酸(IAA)(分析纯):美国Sigma公司;L-色氨酸(分析纯):成都市科龙化工试剂厂。
1.1.3 培养基
牛肉膏蛋白胨培养基(斜面培养基):蛋白胨10.0 g/L,NaCl 50.0 g/L,牛肉膏3.0 g/L,琼脂20.0 g/L,pH 7.4。121 ℃灭菌20 min。
1/2MS培养基:大量元素50 mL,钙盐50 mL,微量元素10 mL,铁盐10 mL,有机溶液10 mL,琼脂8 g,蔗糖30 g,pH值6.8,定容至1 L。121 ℃灭菌20 min。
LB液体培养基:酵母提取物5.0 g/L,胰蛋白胨10.0 g/L,NaCl 10.0 g/L,pH 7.0。121 ℃灭菌20 min。
种子培养基、基础发酵培养基采用LB液体培养基。
1.2 仪器与设备
X3R高速冷冻离心机FroFleX聚合酶链式反应(poly merase chain reaction,PCR)仪:赛默飞世尔科技(中国)有限公司;RS-232精密电子天平:上海恒平科学仪器有限公司;759S紫外可见分光光度计:上海棱光技术有限公司;ZWY-211B摇床:上海智城分析仪器制造有限公司;SW-CJ-1F超净工作台:苏州净化设备有限公司。
1.3 方法
1.3.1 菌株的分离
在装液量为100 mL/250 mL牛肉膏蛋白胨培养基中加入5 g碱蓬根际土样,28 ℃、180 r/min摇床富集培养1 d。对此菌液进行10-2、10-3、10-4、10-5梯度稀释,取其稀释液各100 μL,采用稀释涂布平板法涂布于牛肉膏蛋白胨培养基中,28 ℃条件下培养48 h,获得单菌落,转接于斜面培养基后培养48 h,4 ℃冰箱保存。
1.3.2 产IAA菌株的筛选及含量测定[18-19]
定性初筛:将分离纯化后的菌株接种于质量浓度为100 mg/LL-色氨酸的LB液体培养基中,37 ℃、200 r/min条件下摇床培养24 h,取50 μL菌悬液滴于白色陶瓷板上,同时加入等量Salkowski显色液进行显色反应。以加入50 μL IAA(50 mg/L)的标准液作为阳性对照。白色陶瓷板于室温、避光条件下放置30 min后观察,颜色变红者表示能够产IAA。
吲哚乙酸标准曲线的制作:配制质量浓度分别为0、10μg/mL、20μg/mL、30μg/mL、40μg/mL、50μg/mL、60μg/mL的IAA标准溶液,并按照1∶1体积比与Salkowski显色剂混合,室温避光30 min,分别在波长530 nm条件下测定其吸光度值,以蒸馏水按照1∶1体积比与Salkowski显色剂混合液为空白对照,以IAA标准溶液质量浓度(x)为横坐标,OD530nm值(y)为纵坐标绘制IAA标准曲线,得到标准曲线回归方程为y=0.01x-0.073 7,相关系数为R2=0.993 1。
IAA含量测定:筛选菌株接种于LB液体培养基中,37℃、200 r/min条件下摇床培养24 h后取出,4 000 r/min离心15 min,取上清液4 mL与等体积Salkowski显色剂混合,25 ℃避光反应30 min,测定OD530nm值。根据IAA标准曲线回归方程计算菌液中IAA含量。
1.3.3 菌株的鉴定
挑取IAA产量最高的菌株单菌落于牛肉膏蛋白胨培养液中,培养至对数期后,使用十六烷基三甲基溴化铵法(hexadecyltrimethy ammonium bromide,CTAB)法提取基因组总DNA[15]。用细菌通用引物27F(5'-AGAGTTTGATCCTGGTCAG-3')和1492R(5'-GGTTACCTTACGACTT-3')对菌株16S rRNA基因进行PCR扩增,PCR反应体系(25 μL):DNA模板1 μL,2×TaqPCR MasterMix 10 μL,5 μmol/L引物27F 1 μL,5 μmol/L 1492R 1 μL,ddH2O 12 μL。PCR反应条件为:94 ℃、5 min;94 ℃、45 s,55 ℃、45 s,72 ℃、1 min,共30个循环;72 ℃、10 min。PCR产物经过1%琼脂糖凝胶电泳检测,由生工生物工程(上海)股份有限公司进行测序,将16S rRNA基因序列上传至美国国家生物技术信息中心(national center of biotechnology information,NCBI)数据库获得登录号,并将其序列于NCBI中进行比对,使用MEGA 6.0,用邻接法(neighbour joining,NJ)构建系统发育树,进行系统发育树分析。
1.3.4 拟南芥平板试验
为了探究短小芽孢杆菌BG-5的促生效果,在1/2MS平板培养基中央用灭菌打孔器打直径为1 cm的孔,将2 mL牛肉膏蛋白胨培养基注入孔内,移取表面消毒后的种子,种于距中心约2.5 cm的位置,每个平板种8粒,16 h黑暗,8 h光照,18 ℃光照培养箱培养5 d,待拟南芥发芽长出些许嫩叶后,挑取筛选得到的BG-5菌株,接种于中央的牛肉膏蛋白胨培养基上,以接种无菌水为对照组(CK)。拟南芥生长30 d后,观察其生长情况。
1.3.5 菌株种子液的制备、发酵培养及生长曲线的测定
种子液的制备:于活化斜面挑取一环筛选得到的高产IAA的菌株BG-5接种至装液量为30 mL/250 mL种子培养基中,37 ℃、200 r/min摇床培养9 h,得种子液;发酵培养:在无菌环境中,取种子液1 mL至装液量为30 mL/250 mL发酵培养基中,37 ℃、200 r/min摇床培养24 h。
生长曲线的测定:取活化斜面后的菌株BG-5一环接种至装液量为30 mL/250 mL种子培养基中,37 ℃、200 r/min摇床培养。每2 h取一次样,测定发酵液在波长600 nm条件下的OD600nm值,并绘制菌株的生长曲线。
1.3.6 发酵培养基成分优化
(1)单因素试验
碳源及其添加量的确定[20]:以5 g/L的葡萄糖、麦芽糖、蔗糖、玉米粉、山梨醇、酵母提取物为碳源,碳源添加量梯度分别为3 g/L、5 g/L、7 g/L、10 g/L、15 g/L,考察不同碳源及碳源添加量对IAA含量的影响。
氮源及其添加量的确定:以10g/L的尿素、KNO3、NH4NO3、NH4Cl、胰蛋白胨为氮源,氮源添加量梯度分别为5g/L、7 g/L、10 g/L、15 g/L、20 g/L,考察不同氮源及氮源添加量对IAA含量的影响。
金属离子及其添加量的确定:以10 g/L的NaCl、CaCl2、ZnSO4、MgSO4·7H2O、FeSO4、MnSO4为金属离子,筛选金属离子含量梯度分别为5 g/L、7 g/L、10 g/L、15 g/L、20 g/L,考察不同金属离子及添加量对IAA含量的影响。
(2)响应面分析试验
采用单因素试验选取培养基成分的浓度范围,并根据响应面分析法中的Box-Behnken试验方案进行设计,以酵母提取物添加量(A)、胰蛋白胨添加量(B)和MgSO4·7H2O添加量(C)为自变量,以IAA产量(Y)为响应值,优化发酵培养基配方,并进行验证。
1.3.7 摇瓶发酵条件优化
在装液量分别为10 mL/250 mL、30 mL/250 mL、50 mL/250 mL、70 mL/250 mL、100 mL/250 mL,初始pH值分别为5.0、6.0、7.0、8.0、9.0及发酵温度分别为24 ℃、28 ℃、32 ℃、37 ℃、42 ℃条件下,优化后的发酵培养基中发酵培养,分别考察装液量、初始pH值及发酵温度对IAA含量的影响。
2 结果与分析
2.1 菌株的分离和筛选
一共筛出5株菌株进行定性初筛,并对产生IAA的菌株进行定量检测,结果见表1。由表1可知,有2株产生IAA,结合IAA的产量测定,选取一株产IAA能力较好的菌株进行后续实验,并根据采集地及采集部位将其编号为BG-5。
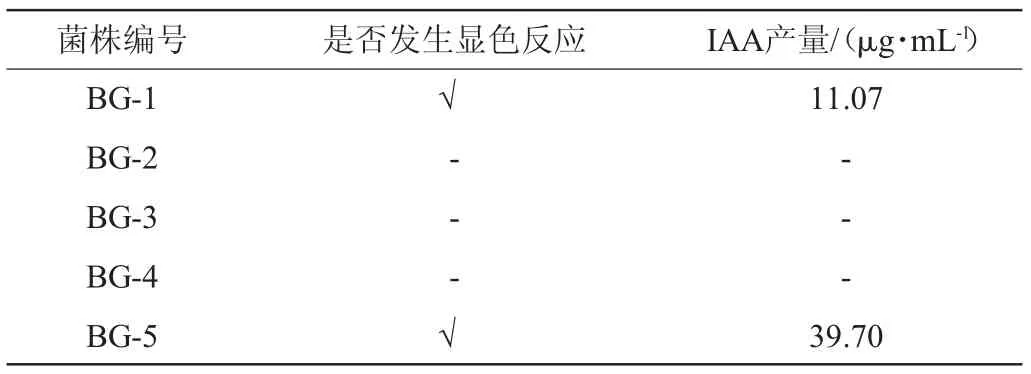
表1 菌株筛选结果Table 1 Screening results of strains
2.2 菌株的鉴定
根据16S rDNA测序与NCBI数据库基本局部比对搜索工具(basic local alignment search tool,BLAST)比对的结果,对产IAA菌株BG-5与参比菌株构建系统发育树分析结果如图1所示,菌株BG-5与Bacillus zhangzhouensisstrain D10302(GenBank核酸登录号为MK070088.1)的同源性高达93%,故将菌株BG-5鉴定为短小芽孢杆菌(Bacillus pumilus),将核酸序列上传至NCBI数据库,其登录号为MK016484。

图1 菌株BG-5基于16S rRNA基因序列构建的系统发育树Fig.1 Phylogenetic tree of strain BG-5 based on 16S rRNA gene sequences
2.3 拟南芥平板试验
结果如图2所示,与不接菌株的对照(左边平皿)相比,拟南芥的叶表面积有所增加,表明短小芽孢杆菌(Bacillus pumilus)BG-5可以产生某种物质能够促进拟南芥生长。

图2 菌株BG-5对拟南芥生长的促生效果Fig.2 Growth-promoting effect of strain BG-5 on Arabidopsis thalina
2.4 菌株BG-5的生长曲线
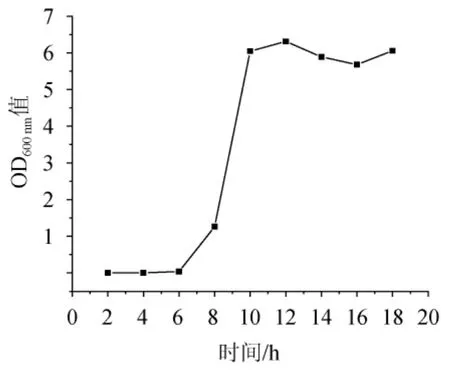
图3 短小芽孢杆菌BG-5的生长曲线Fig.3 Growth curve of Bacillus pumilus BG-5
对菌株BG-5进行生长曲线的绘制,结果见图3。由图3可知,2~6 h为菌株BG-5的延迟期,从第8小时开始该菌株进入对数生长期,其后菌体生长迅速,菌体浓度快速升高;12~18 h菌体生长速度逐渐减小至平缓。因此,选择培养8~10 h的菌体作为种子液。
2.5 培养基组分及含量对短小芽孢杆菌BG-5产吲哚乙酸的影响
通过对不同培养基组分及含量的筛选,结果见图4。由图4a1可知,在培养基中不加碳源,短小芽孢杆菌BG-5的吲哚乙酸产量最少,但该菌株对于酵母提取物、玉米粉和蔗糖的利用较有效,其中酵母提取物作为碳源时产吲哚乙酸量最高,达到44.17 μg/mL。因此,选择酵母提取物作为最佳碳源。由图4a2可知,随着酵母提取物添加量的增加,IAA的产量先增加后减小,当其酵母提取物添加量为7 g/L时,IAA产量达到最大,为85.37 μg/mL。因此,选择最适酵母提取物添加量为7 g/L。
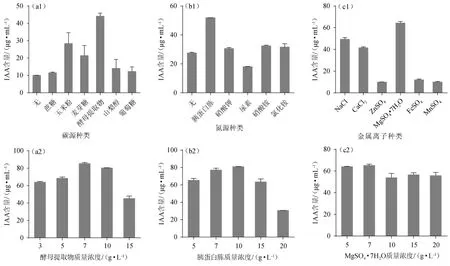
图4 不同培养基组分及添加量对菌株BG-5产吲哚乙酸的影响Fig.4 Effect of different medium component and addition on indoleacetic acid yield by strain BG-5
由图4b1可知,胰蛋白胨为氮源所产的IAA量最高,其IAA产量达到最高,为51.97 μg/mL。因此,选择胰蛋白胨作为最佳碳源。由图4b2可知,随着胰蛋白胨添加量的增加,IAA的产量也随之增加,当胰蛋白胨添加量为10 g/L时,IAA产量最大,达81.02 μg/mL,进一步增加胰蛋白胨添加量,IAA产量减小,原因为高浓度的胰蛋白胨导致碳氮比降低,不利于产物积累。因此,选择胰蛋白胨最适添加量为10 g/L。
由图4c1可知,在发酵培养基中分别添加10 g/L Mg2+、Na+、Ca2+时,IAA产量较高;其中当加入Mg2+时产IAA最高,高达64.37 μg/mL。因此,选择Mg2+作为最佳金属离子。由图4c2可知,随着七水硫酸镁添加量的增加,IAA产量先增加后减少,当其添加量为7 g/L时,IAA产量达到最大,为65.17μg/mL。因此,选择最适七水硫酸镁的添加量为7 g/L。
2.6 响应面分析试验结果
以单因素试验为基础,对菌株BG-5产IAA发酵培养基进行响应面分析。响应面试验设计与结果见表2,方差分析结果见表3,各因素间的交互作用对短小芽孢杆菌BG-5产吲哚乙酸的影响结果见图5。
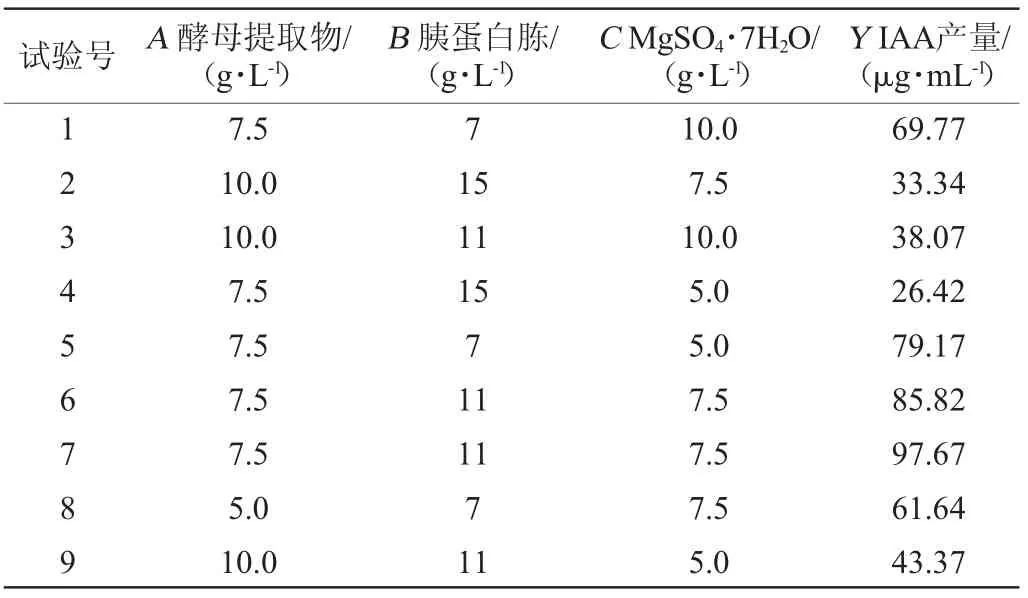
表2 Box-Behnken试验结果与分析Table 2 Results and analysis of Box-Behnken experiments
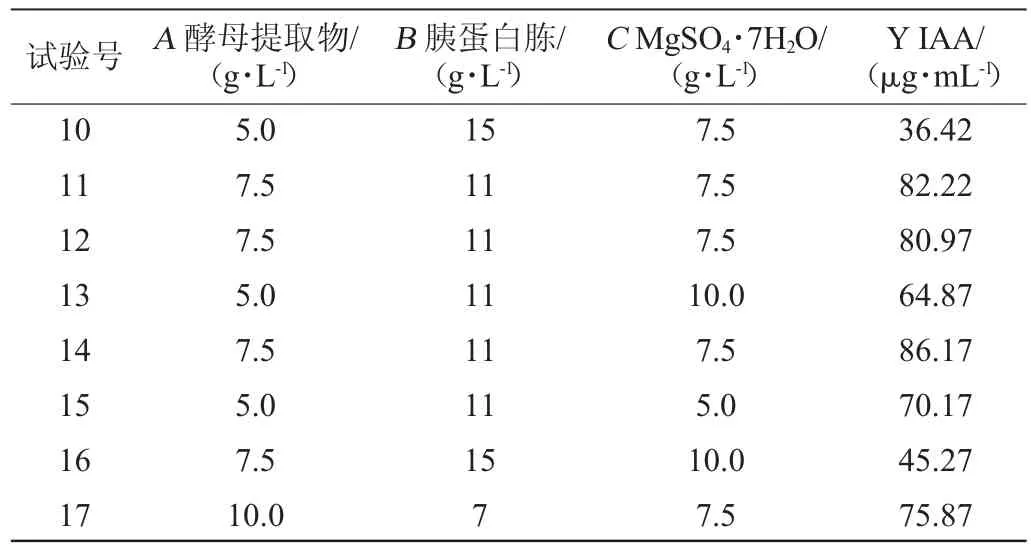
续表
利用Design-Expert 10.0软件对数据进行二次多元回归拟合,得到吲哚乙酸产量(Y)对酵母提取物添加量(A)、胰蛋白胨添加量(B)和MgSO4·7H2O添加量(C)的二次多项回归方程为:Y=86.57-5.31A-18.13B-0.14C-4.33AB+7.06BC-17.90A2-16.86B2-14.5C2。
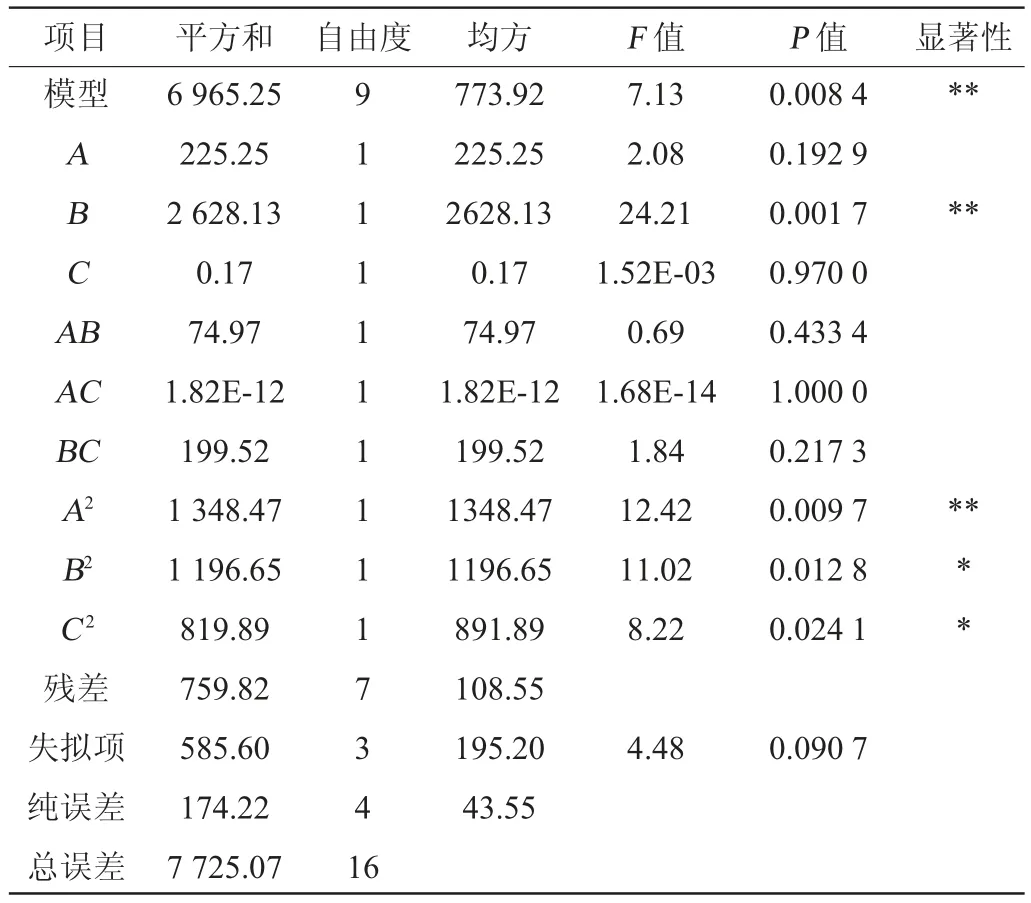
表3 回归模型的方差分析Table 3 Variance analysis of regression model
由表3可知,回归模型的P值为0.008 4<0.01,表明模型对试验结果具有极显著的影响;而失拟项P值=0.090 7>0.05,不显著,说明未知因素对试验结果的影响较小;该模型的决定系数R2=0.901 6,变异系数(coefficient of variation,CV)值较低为16.44%,由此可知回归方程的拟合度较好,可信度高,可以用此模型对短小芽孢杆菌BG-5产IAA量进行预测。回归方程的一次项B和二次项A2对IAA产量有极显著影响(P<0.01),二次项B2、C2对IAA产量有显著的影响(P<0.05),其他因素对IAA产量的影响不显著(P>0.05)。通过响应面优化得出短小芽孢杆菌BG-5产吲哚乙酸的最佳培养基配方为酵母提取物7.298 g/L、胰蛋白胨8.773 g/L、七水硫酸镁7.151 g/L,IAA产量预测值为91.838 μg/mL。为方便实际操作,将培养基组分修改为酵母提取物7.3 g/L、胰蛋白胨8.8 g/L、七水硫酸镁7.2 g/L,在此最优培养基组分下,得出实际IAA产量平均值为87.86 μg/mL,与预测值接近,说明模型具有很高的可靠性。
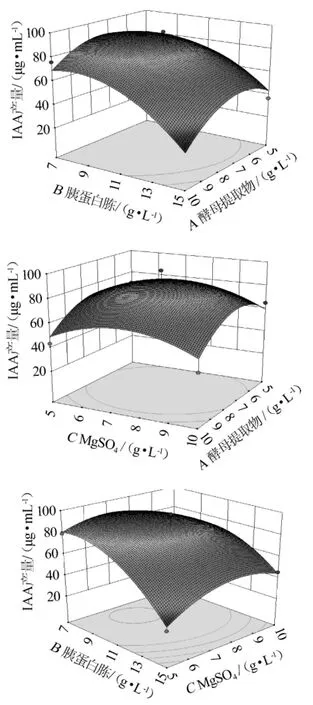
图5 各因素间的交互作用对短小芽孢杆菌BG-5产吲哚乙酸影响的响应面及等高线Fig.5 Response surface plots and contour lines of effects of interaction between each factors on indoleacetic acid production by Bacillus pumilus BG-5
2.7 不同培养条件对短小芽孢杆菌BG-5产吲哚乙酸的影响
由图6a可知,当装液量为30 mL/250 mL时,BG-5菌株产生的IAA量最多,达43.64 μg/mL。进一步增加装液量,IAA的产量逐渐减少,这可能与发酵液中的溶氧量多少有关。因此,选择最佳装液量为30 mL/250 mL。
由图6b可知,BG-5菌株在初始pH值为8时生长最好,产IAA量最高,为44.02 μg/mL,可能是因为pH值会影响菌株对培养基里各种营养物质的有效吸收和利用,进而影响其细胞中的代谢酶活性,从而决定菌株的正常生长。因此,选择最佳初始pH值为8。
由图6c可知,发酵温度为37 ℃时菌株产IAA量多,高达52.64 μg/mL,其次是42 ℃,菌株产IAA量为49.74 μg/mL。温度过高或过低都会降低产IAA相关酶的活性。因此,选择最佳发酵温度为37 ℃。
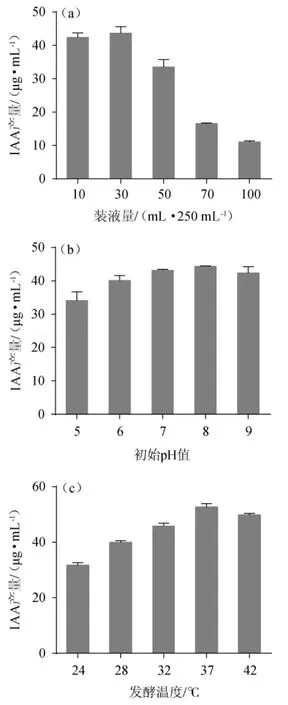
图6 不同培养条件对菌株BG-5产吲哚乙酸的影响Fig.6 Effects of different fermentation conditions on indoleacetic acid production by strain BG-5
3 结论
本实验室对从新疆盐碱地的碱蓬根际中分离获得一株产IAA的PGPR进行了一系列优化试验,确定其最佳培养条件为装液量30 mL/250 mL、起始pH值为8、培养温度37 ℃,菌株BG-5产吲哚乙酸的最佳培养基配方为酵母提取物7.3 g/L、胰蛋白胨8.8 g/L、七水硫酸镁7.2 g/L。在最优条件下,IAA产量为87.86 μg/mL,约为优化前(39.70 μg/mL)的2倍。该试验为功能微生物肥料的研发提供了更多选择,也为后续菌株的开发和应用奠定基础。
