酱香型白酒第四轮次酒酿造过程中真菌多样性分析
2019-12-04孙利林李立郎麻颖垚袁再顺
孙利林,李立郎,胡 萍 *,田 亚,麻颖垚,袁再顺
(1.贵州大学 酿酒与食品工程学院,贵州 贵阳 550025;2.贵州省中国科学院天然产物化学重点实验室,贵州 贵阳 550014)
酱香型白酒生产历史悠久、源远流长,一直深受人们的喜爱。其典型的代表是茅台酒,酒体酱香突出、香味幽雅细腻、酒体醇厚、回味悠长、空杯留香[1-3]。酱香型白酒生产工艺独特,具有高温制曲、高温堆积、高温发酵、高温馏酒、长期贮存的“四高一长”的工艺特点。一年一个生产周期,分二次投料,经过八轮次发酵,七次蒸酒,长期陈酿,精心勾兑而形成其独特的风味品质。酱香型白酒在其独特的酿造环境和工艺条件下,酒曲、酒醅、窖泥中形成了丰富的微生物资源[4-7]。
酱香白酒酿造过程中可分离出的真菌,主要为酵母和霉菌[8-14],酵母是产乙醇和重要风味物质的关键微生物,霉菌能够分泌多种酶类,对酿造原料降解和中国白酒风味的形成有重要贡献[15]。据报道,酱香型白酒发酵过程中的酵母菌群产酯丰富,对优质酱香白酒风味的形成有重要的作用[10]。其主要作用是产酒产香,优势菌种有球拟酵母、假丝酵母、汉逊酵母等[16-17]。研究表明,大部分酵母具有产多元醇的能力,并且还可以代谢出苯乙醇、4-乙基愈创木酚、4-乙基苯酚、芳樟醇等物质[14]。霉菌的主要功能是分泌糖化酶、液化酶及蛋白酶,对分解酿酒原料中的淀粉、蛋白质等大分子物质具有积极的推动作用,使得整个反应体系中糖类及氨基酸含量升高,可为其他微生物的代谢提供基础物质,亦为后续的酒体风味形成奠定基础[18-19]。
本研究应用Illumina Miseq高通量测序技术,以酱香型白酒第四轮次酒酿造过程中高温大曲、酒醅(堆积酒醅、窖内酒醅)以及窖泥为研究对象,针对不同酒厂以及同一酒厂新、老车间之间真菌多样性进行对比研究,分析酱香型白酒酿造过程中真菌变化,探究酿造过程中的真菌群落结构以及各酿造阶段的主要优势菌群动态变化规律,为优化利用酿酒微生物资源和生产质量控制提供理论基础支撑。
1 材料与方法
1.1 材料与试剂
酒曲、酒醅(堆积酒醅、窖内酒醅)、窖泥样品:采自贵州省仁怀市茅台镇H酒厂和J酒厂,采样轮次为第四轮次。采样方式为每层中心和四角收集,每100 g混合样品装于采样袋,置于-80 ℃冰箱中备用。共采集17个样品,具体样品采集信息见表1。
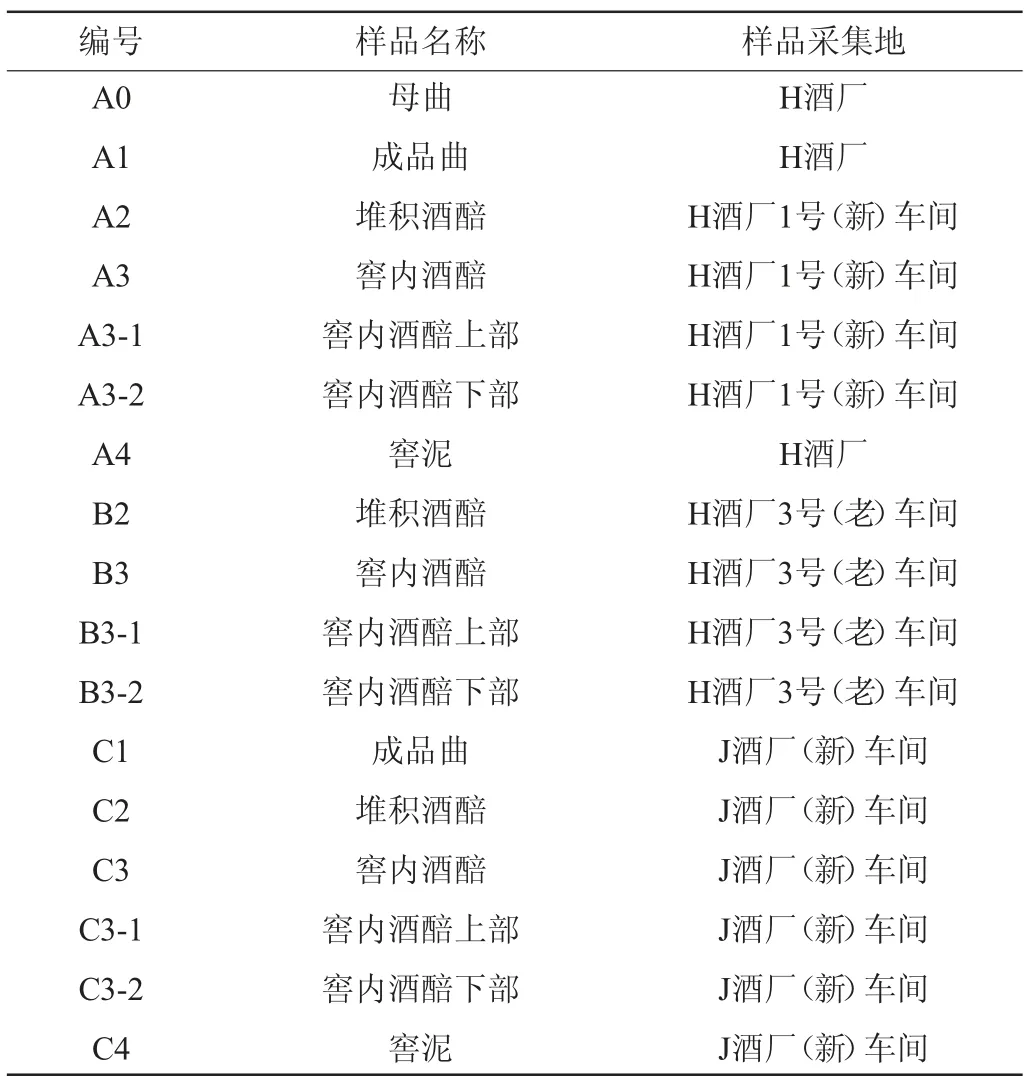
表1 样品采集信息情况Table 1 Information of collected sample
1.2 仪器与设备
1.3 方法
1.3.1 样品DNA提取及MiSeq测序分析
1.3.2 高通量测序数据统计分析
测序得到的序列信息,首先根据双端序列数据之间的对应关系,将成对的数据拼接成一条序列,同时对数据的质量和拼接的效果进行质控过滤,根据序列首尾两端的序列和引物序列区分样品得到有效序列,并校正序列方向。之后利用不同软件进行数据分析如:利用QIIME[21]等软件在97%的相似性水平上利用UPARSE算法[22]进行分类操作单元(operational taxonomic units,OTU)的聚类,并挑选出OUT的代表性序列,基于Silva和UNITE[23]数据库对97%相似水平的OTU代表序列进行分类学注释分析、利用QIIME和R语言软件对样本进行Alpha多样性分析、Beta多样性分析和群落变化分析等。
2 结果与分析
2.1 酱香型白酒酿造过程中的真菌多样性分析
2.1.1 Rank-Abundance曲线
Rank-Abundance曲线可用来解释多样性的两个方面,即物种丰度和物种均匀度。在水平方向,物种的丰度越高,曲线在横轴上的范围越大,说明其物种丰度最高;曲线的形状(平滑程度)反映了样品中物种的均度,曲线越平缓,物种分布越均匀。结合图1曲线得出:大部分样品的Rank-Abundance曲线在水平方向的跨度都在40以上,仅有小部分在20~40之间,说明酱香型白酒酿造过程中真菌的物种丰度较高,微生物群落结构复杂;另外,所有样品的Rank-Abundance曲线形状(倾斜率)整体比较陡,说明其中的真菌群落分布存在优势菌群。
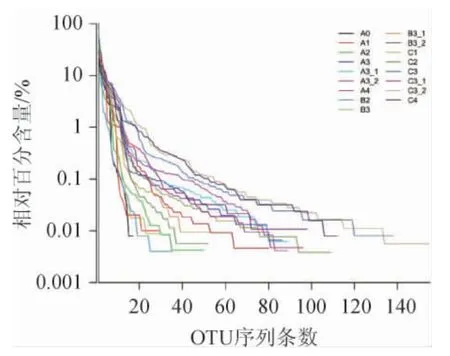
图1 Rank-Abundance曲线Fig.1 Rank-Abundance curve
2.1.2 真菌群落结构分析
基于门水平上的样品群落结构柱状图,结果见图2。
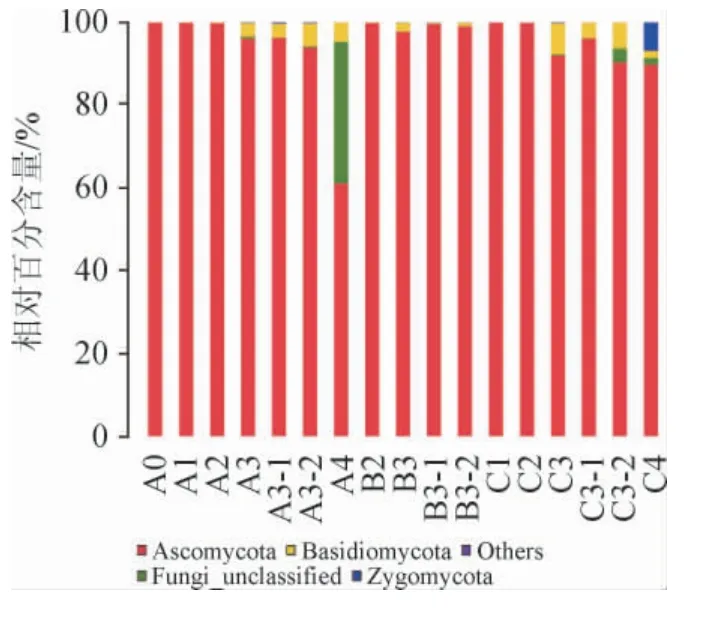
图2 基于门水平的样品菌落组成相对含量Fig.2 Relative abundance of microbial community based on phylum level
样品菌落在基于门水平的组成情况见图2。由图2可知,在17个样品中最主要的是子囊菌门(Ascomycota),其次是担子菌门(Basidiomycota)、真菌界未定义菌类(Fungi_unclassified)、接合菌门(Zygomycota)。
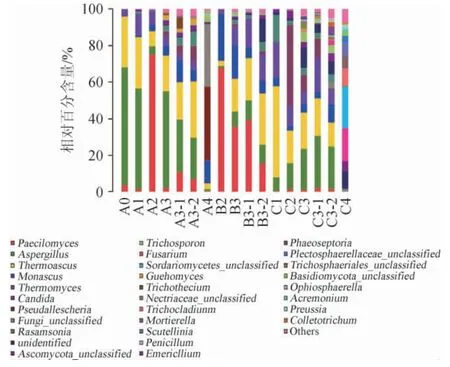
图3 基于属水平的样品菌落组成相对含量Fig.3 Relative abundance of microbial community based on genus level
样品菌落在基于属水平的组成情况见图3。由图3可知,在17个样品中主要存在30个真菌菌属,其中酒曲中主要是曲霉属(Aspergillus)、嗜热子囊菌属(Thermoascus)嗜热真菌属(Thermomyces)、拟青霉属(Paecilomyces)和红曲霉属(Monascus)等;堆积发酵中主要有拟青霉属(Paecilomyces)、念珠菌属(Candida)、红曲霉属(Monascus)、嗜热子囊菌属(Thermoascus)和嗜热真菌属(Thermomyces)等;窖内发酵中主要优势菌有嗜热子囊菌属(Thermoascus)、嗜热真菌属(Thermomyces)、红曲霉属(Monascus)、踝节菌属(Rasamsonia)和曲霉属(Aspergillus)等;窖泥中主要优势菌有假霉样真菌属(Pseudallescheria)、镰刀菌属/镰孢属(Fusarium)、短梗蠕孢属(Trichocladium)和红曲霉属(Monascus)。
2.1.3 多样本聚类树
基于样本OTU种类数计算样本间的weighted unifrac距离,综合考量序列数据、序列同源性、微生物构成的丰度等对各个样本进行聚类,结果见图4。由图4可知,A0和A1之间距离较近,说明了同一酒厂的母曲A0与成品曲A1的真菌组成亲缘关系较近。A1和C1之间距离较远,说明不同酒厂大曲的真菌微生物亲缘关系较远,这可能与各酒厂之间制曲配方、工艺及地理环境有关。
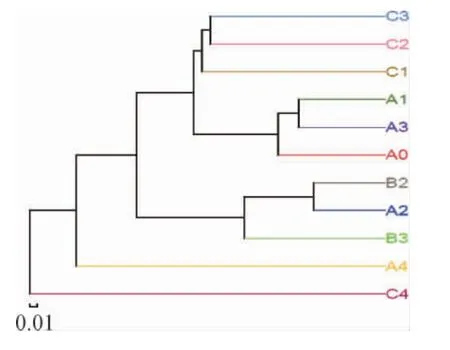
图4 样本相似度分析树状图Fig.4 Tree diagram of samples similarity analysis
A2和B2归属到了一起,但与C2相隔一定距离。结果表明,同一酒厂不论是新车间还是老车间,它们堆积发酵酒醅的真菌微生物菌相之间亲缘关系很接近,而不同酒厂堆积发酵酒醅真菌微生物之间亲缘关系较远。不同酒厂虽然都在茅台镇赤水河边,但酒厂间地理位置有一定距离,发酵车间环境微生物以及来自大曲的微生物亲缘关系有较大差异。同时也说明了堆积发酵受空间环境的影响较大,发酵环境微生物的多样性影响着堆积酒醅的微生物多样性。A3、B3、C3都没有同一归属,表明它们所含真菌种群结构差异较大,菌群之间的亲缘关系较远。这说明窖池不同,窖池微生态环境微生物的真菌组成存在很大差异,可能与窖池的结构、窖龄、环境条件都有关系,这也是值得下一步深入研究的问题。A4和C4没有归于同一归属并且与酒醅相距较远,说明不同酒厂窖泥之间真菌菌相组成差别较大,这可能与窖泥的来源不同有关系。
同一酒厂新、老车间以及不同酒厂的窖内酒醅样本进行聚类分析,结果见图5。由图5可知,A3-1和A3-2归属到了一起,B3-1和B3-2归属到了一起,但C3-1和C3-2之间距离相对较远。说明H酒厂无论是新车间还是老车间同一窖池内发酵酒醅上面部分与下面部分的微生物亲缘关系十分接近,但不同窖龄的窖内酒醅真菌群落有差异;而J酒厂的窖内酒醅上面部分与下面部分的微生物差异较大,J酒厂为新建酒厂,可能微生物群体还不太稳定,也更进一步说明了窖龄是影响窖池真菌多样性的关键因素。
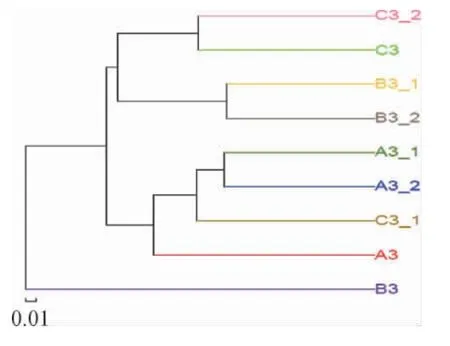
图5 窖内酒醅样本相似度分析树状图Fig.5 Tree diagram of similarity analysis of fermented grains in pit
窖内发酵中的微生物,长期在密封、高温、高压、高酸度、高酒精、高湿度的特殊环境下,微生物的遗传性状、功能特性、代谢机制等可能发生了改变,形成了独特的较稳定的窖池微生态菌群,也造成了不同窖池间微生物的亲缘关系都较远。微生物遗传性状、功能特性、代谢机制的改变,窖池微生态独特菌群的形成,都是需要时间积累的。说明窖龄越老的窖池,其窖内发酵微生物特别是其优势菌群是值得深入挖掘研究的特殊微生物资源。
2.2 酿酒过程优势真菌群落动态变化分析
2.2.1 酒曲真菌多样性分析
由图6可知,H酒厂母曲和成品曲中的真菌组成差别不大,但成品曲真菌多样性大于母曲。母曲中优势真菌更为突出,优势真菌为曲霉属(Aspergillus)(64.43%)、嗜热子囊菌属(Thermoascus)(27.79%)、嗜热真菌属(Thermomyces)(3.85%),其次是拟青霉(Paecilomyces)(3.63%)以及其他真菌。这与高温制曲的工艺密切相关。以米曲霉为主的霉菌具有很强的产葡萄糖氧化酶、糖化酶和蛋白酶等酶活性能;嗜热子囊菌属有产木聚糖酶、碱性耐热过氧化氢酶、超氧化物歧化酶、角质酶等酶类,它们在后续的堆积糖化发酵以及对酱香风味的形成起着重要的作用。成品曲中优势菌群与母曲相比增加了多样性,而嗜热真菌属的菌群数量显著增多,曲霉菌属和青霉属的菌群相对减少。其中,曲霉属(Aspergillus)(55.00%)、嗜热子囊菌属(Thermoascus)(28.11%)和嗜热真菌属(Thermomyces)(11.7%)是H酒厂成品曲中重要的微生物菌群,其次还有拟青霉属(Paecilomyces)(1.44%)、踝节菌属(Rasamsonia)(1.17%)、子囊菌纲未鉴别菌属(Ascomycota_unidentified)(1.14%)、红曲霉属(Monascus)(1.11%)、毛孢子菌属/丝孢酵母属(Trichosporon)(0.04%)等。J酒厂成品曲C1中的主要真菌是嗜热子囊菌属(Thermoascus)(49.85%)、嗜热真菌属(Thermomyces)(19.24%),踝节菌属(Rasamsonia)(14.90%)、曲霉属(Aspergillus)(7.58%)、红曲霉属(Monascus)(4.89%)等。A1与C1相比主要优势菌群的丰度存在明显差异,说明酱香型白酒生产酒曲中主要发酵微生物菌相是相似的,但组成比例有差异。主要原因可能是不同酒厂间制曲工艺相似,但具体的工艺参数及酿酒环境有所不同,这也是同一地区不同品牌白酒质量和风味有所差异的原因之一。
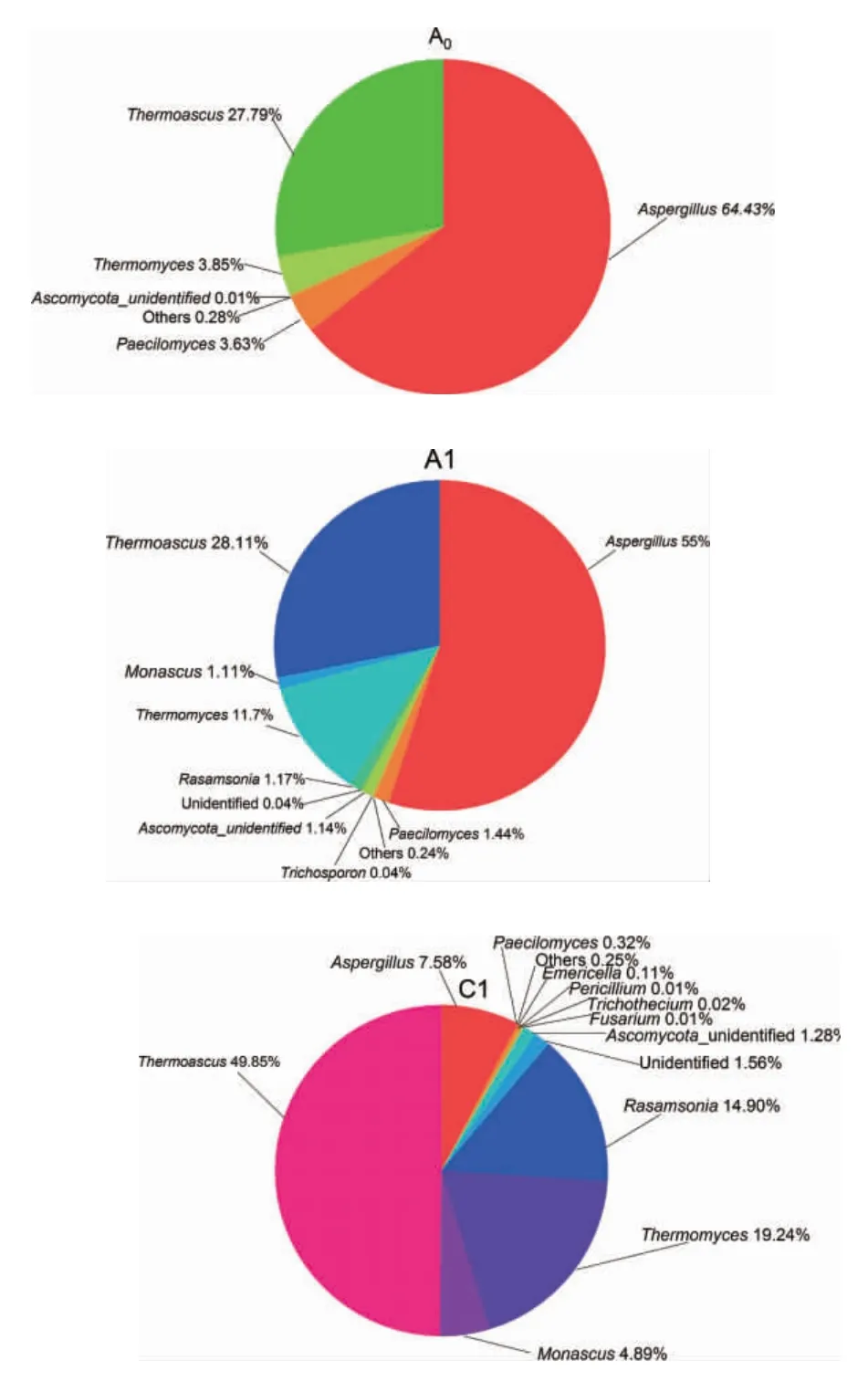
图6 不同车间不同酒厂酒曲样品真菌群落结构饼状图Fig.6 Pie chart of fungal community structure of different Jiuqu samples in different workshops of different distilleries
2.2.2 堆积酒醅真菌多样性分析
堆积发酵是将淀粉转化成糖的关键环节,这时需要更多的微生物代谢产生大量的水解酶类。由于堆积发酵环境的高温特殊性,耐热微生物的优势就凸显出来,成为了优势菌群。堆积发酵是开放的发酵环节,除了拌入大曲中的微生物以外,还网罗环境中的微生物,对酱香型风味的形成影响也很大。由图7可知,拟青霉属(Paecilomyces)是H酒厂堆积酒醅中的主要优势菌群,在A2和B2中相对丰度分别达到75.08%和67.71%。另外,A2中的主要优势菌群还有:嗜热子囊菌属(Thermoascus)(8.25%)、嗜热真菌属(Thermomyces)(7.05%)、曲霉属(Aspergillus)(4.47%)、红曲霉属(Monascus)(3.53%);B2中红曲霉属(Monascus)也是主要优势菌群,丰度达(25.42%)。与A2相比,B2中的嗜热子囊菌属(Thermoascus)(2.85%)、嗜热真菌属(Thermomyces)(2.09%)、曲霉属(Aspergillus)(1.06%)的丰度降低,优势菌群更加突显,拟青霉属和红曲霉属,特别是红曲霉属数量增加显著。红曲霉产β-淀粉酶及产蛋白酶活性较强,在酿酒、制醋和腐乳中,对乙醇发酵和风味的产生都发挥着重要的作用,值得进一步研究。老车间已使用30多年,发酵车间使用年限越长,微生物的多样性降低,但微生物优势菌群越突出,可能更有利于酿酒发酵及风味的产生。
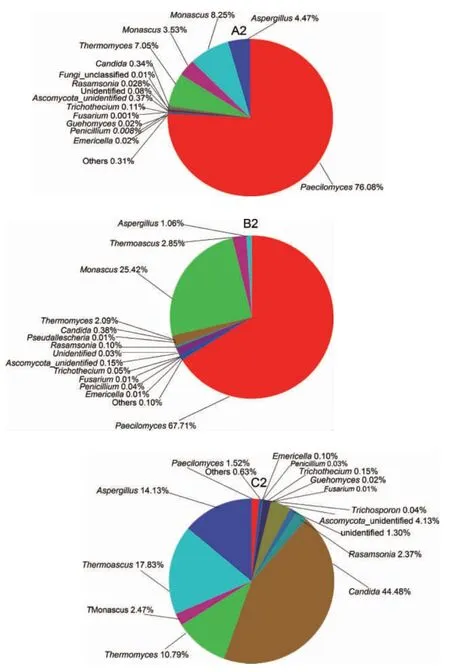
图7 不同车间不同酒厂堆积酒醅真菌群落结构饼状图Fig.7 Pie chart of fungal community structure of accumulated fermented grains in different workshops of different distilleries
J酒厂的堆积酒醅C2中假丝酵母属/念珠菌属(Candida)(44.48%)是最优势的,另外嗜热子囊菌属(Thermoascus)(17.83%)、曲霉属(Aspergillus)(14.13%)、嗜热真菌属(Thermomyces)(10.79%)、红曲霉属(Monascus)(2.47%),也是重要的微生物菌群。A2与C2相比主要优势菌群存在明显差异,虽然所用酒曲菌相似,但丰度和占比差异较大。这说明不同的酒厂发酵车间之间环境微生物多样性的差异影响着堆积酒醅的微生物多样性。另外,不同酒厂的发酵工艺虽然相似,但工艺差数的不一样也可能造成优势菌群差异,这也是不同酒厂的酒品质和风味差异化的主要原因之一。
2.2.3 窖内酒醅真菌多样性分析
由图8可知,3种窖内酿酒真菌菌群多样性均较高,但种群结构差异较大。A3中主要微生物为曲霉属(Aspergillus)(52.89%)、嗜热子囊菌属(Thermoascus)(19.49%),红曲霉属(Monascus)(5.44%)、嗜热真菌属(Thermomyces)(5.19%)、踝节菌属(Rasamsonia)(2.74%)、子囊菌纲未鉴别菌属(Ascomycota_unidentified)(2.63%)、假丝酵母属/念珠菌属(Candida)(2.57%)及其它未归类的真菌菌群。B3中则仍然以拟青霉属(Paecilomyces)(35.45%)占比最大、此外还有嗜热子囊菌属(Thermoascus)(17.94%)、红曲霉属(Monascus)(18.45%)为主要微生物菌群,另外嗜热真菌属(Thermomyces)(9.83%)、曲霉属(Aspergillus)(8.42%)、踝节菌属(Rasamsonia)(2.38%)、假丝酵母属/念珠菌属(Candida)(1.67%)等也是重要的微生物菌群。A3与B3相比主要优势菌群差异较大,说明同样的制酒工艺,同样的酒曲,不同使用年龄的车间和窖池,窖内发酵酒醅真菌多样性的差异较大。老窖池中真菌菌落多样性同样较高,并且主要优势真菌的种类和丰度与堆积发酵酒醅相关度高。这说明使用时间长的车间和窖池其环境微生物种群结构更稳定,优势菌群更突出。J酒厂窖内酒醅C3中曲霉属(Aspergillus)(22.39%),嗜热子囊菌属(Thermoascus)(19.81%)是主要突出的优势菌群,这与A3主要优势菌群相似,但丰度有差异;其次假丝酵母属/念珠菌属(Candida)(9.32%)、嗜热真菌(Thermomyces)(6.57%)、丝孢酵母属(Trichosporon)(5.66%)、红曲霉属(Monascus)(4.87%)、青霉属(Paecilomyces)(3.57%)、踝节菌属(Rasamsonia)(3.57%)也是重要的微生物菌群,J酒厂的车间使用年限及窖龄也不长,说明窖内发酵与发酵车间使用年限和窖龄密切相关。
由以上分析可知:窖内发酵是酱香型白酒真菌种群最丰富的环节,这一环节的真菌微生物多样性最高。由于窖内发酵是在密封、高温、高压等极端环境条件下,不同酒厂窖内酒醅真菌种类差异不大,主要优势菌群都是曲霉属(Aspergillus)、嗜热子囊菌(Thermoascus)、假丝酵母属/念珠菌属(Candida)、嗜热真菌属(Thermomyces)、青霉属(Paecilomyces)和红曲霉属(Monascus),但丰度差异是明显的。曲霉是酿酒、制醋粬的主要菌种。现代工业利用曲霉生产各种酶制剂(淀粉酶、蛋白酶、果胶酶等)、有机酸(柠檬酸、葡萄糖酸、五倍子酸等),农业上用作糖化饲料菌种。早在二千多年前,我国人民已懂得依靠曲霉来制酱,我国特有的调制品豆豉,也是利用曲霉分解豆类而作。由此可看出,窖内发酵中曲霉成为主要的优势菌与酱香风味的产生相关性很大,值得进一步深入研究。
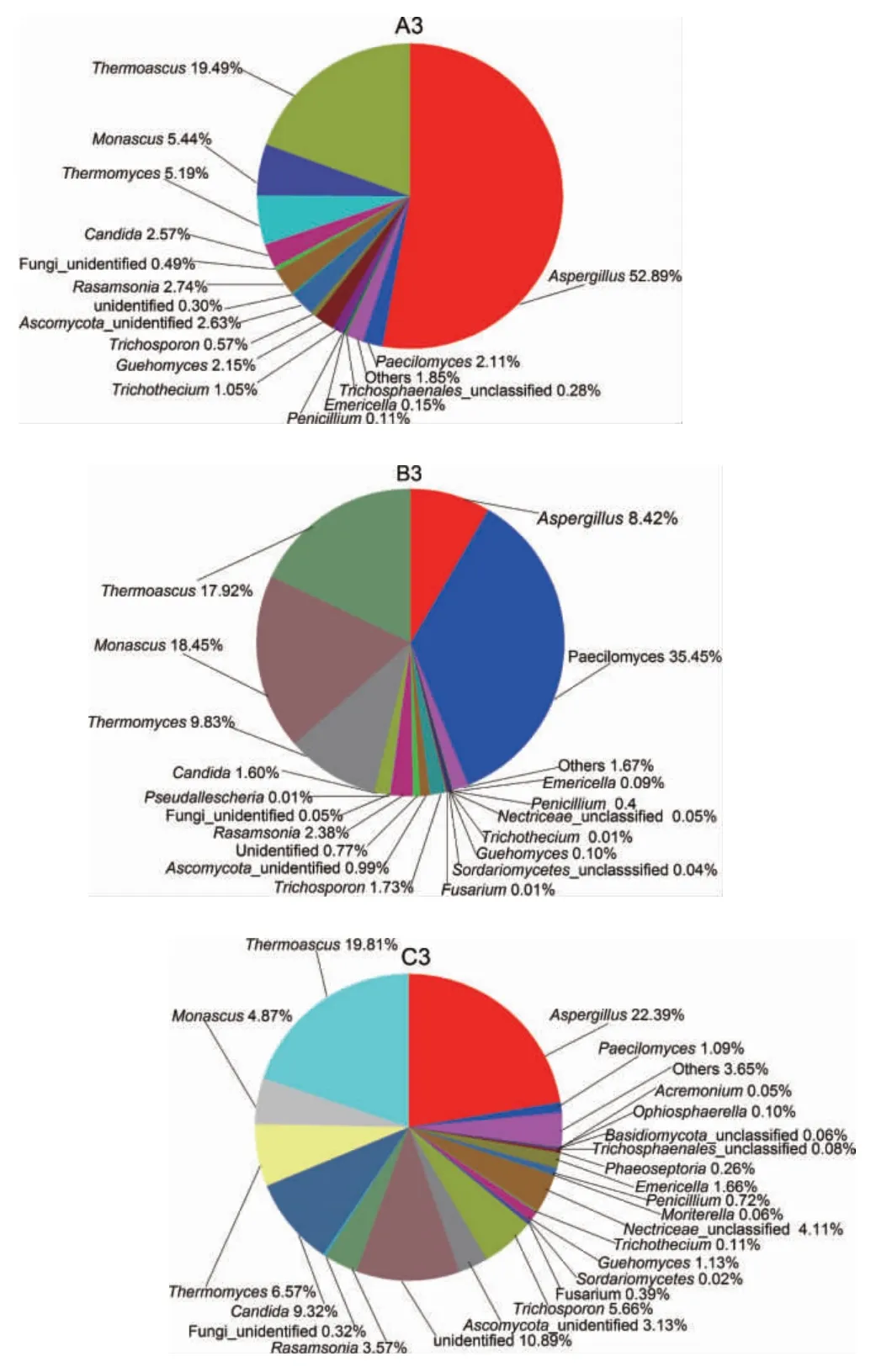
图8 不同车间不同酒厂窖内酒醅真菌群落结构饼状图Fig.8 Pie chart of fungal community structure of fermented grains in pits in different wineries in different workshops
2.2.4 窖泥真菌多样性分析
窖泥的主要作用是密封窖内发酵,为窖内发酵提供一个密闭环境,同时也是和窖内酒醅接触最紧密的物质。由图9可知,不同酒厂使用的窖泥中真菌组成差异明显。A4中的主要真菌是假霉样真菌属(Pseudallescheria)(39.97%)和真菌界未定义菌类(Fungi_unclassified)(34.14%),其次为红曲霉属(Monascus)(12.17%)等。C4中真菌多样性较高,主要微生物除了未鉴定菌属(unclassified)占多数外,镰刀菌属/镰孢属(Fusarium)(18.09%)和短梗蠕孢属(Trichocladium)(9.32%)、被孢霉属(Mortierella)(6.8%),与A4对比主要优势菌群存在明显差异。这可能是不同酒厂的窖泥来源和使用时间、使用方法不一样造成的。
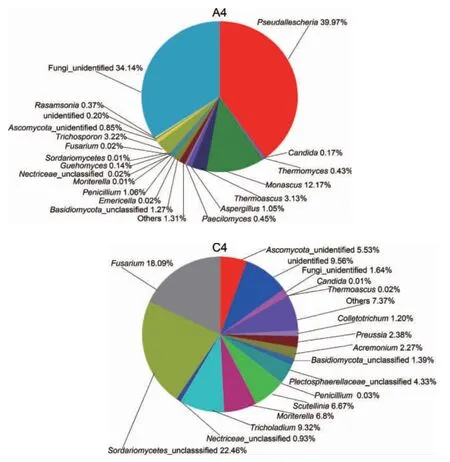
图9 不同酒厂窖泥真菌群落结构饼状图Fig.9 Pie chart of fungal community structure in pit mud from different distilleries
3 结论
采用微生物高通量测序分析技术,对酱香型白酒第四轮次酒曲、堆积酒醅、窖内酒醅和窖泥进行真菌微生物多样性和优势种群结构变化进行分析,结果表明:酱香型白酒的高温大曲、堆积发酵和窖池发酵的真菌资源丰富且主要优势菌群存在动态变化:在酒曲中主要优势菌有曲霉属(Aspergillus)、嗜热子囊菌属(Thermoascus)和嗜热真菌属(Thermomyces);堆积发酵中主要优势菌有拟青霉属(Paecilomyces)、假丝酵母属/念珠菌属(Candida)和红曲霉属(Monascus);窖内发酵中主要优势菌有嗜热子囊菌属(Thermoascus)、嗜热真菌属(Thermomyces)和红曲霉属(Monascus);窖泥中主要优势菌有假霉样真菌属(Pseudallescheria)、镰刀菌属/镰孢属(Fusarium)和短梗蠕孢属(Trichocladium)。同一酒厂新老车间酒曲、堆积发酵、窖内发酵、窖泥之间真菌组成相似度较高,不同酒厂酒曲、堆积发酵、窖内发酵、窖泥之间真菌组成相似度亦较高,但其优势菌群丰度差异显著。发酵车间使用年限及窖龄影响着微生物多样性;时间长的车间和窖池车间和窖池其环境微生物种群结构更稳定,优势菌群更突出。
