内镜下治疗7例食管颗粒细胞瘤临床报道
2019-12-03花海洋蒋海森李建辉孙秀静
花海洋,蒋海森,李建辉,孙秀静
(1.首都医科大学附属北京友谊医院消化内科/国家消化系统疾病临床医学研究中心/北京市消化疾病中心/首都医科大学消化病学系/消化疾病癌前病变北京市重点实验室,北京 100050;2.河北省承德市中心医院消化内科 067000;3.承德医学院附属医院老年病科,河北承德 067000)
颗粒细胞瘤(granular cell tumor,GCT)是一种罕见的具有恶性倾向的神经源性软组织肿瘤,1926年由ABRUKOSSOF首次报道[1]。任何年龄均可发病,但以30~60岁多见[2],可见于身体任何部位,以皮肤及皮下软组织多发,消化道仅占8%~10%[3],其中食管占2%~3%[4]。目前该病多为个案报道,系统研究不多。本文对7例食管GCT的临床、内镜特点及内镜下治疗效果进行研究、总结,分析并报道如下。
1 资料与方法
1.1 一般资料 2009年1月至2018年4月在北京友谊医院消化内科住院诊治且资料完整的食管GCT患者共7例,其中男3例,女4例,年龄33~57岁,平均(47.8±7.9)岁。
1.2 研究方法 回顾性分析7例食管GCT患者的临床资料:一般资料、临床表现、白光内镜及超声内镜特点、病理及免疫组织化学结果、治疗方法及预后,分析其临床特点及治疗效果。
2 结 果
2.1 患者临床表现 7例患者中5例因体检意外发现,1例出现间断胸骨后不适感,1例则表现为间断呃逆、反酸。
2.2 白光内镜及超声内镜表现 5例病变位于食管下段,2例位于食管中段,且发生于食管下段者多位于距门齿35~37 cm。白光内镜下病变呈结节状/丘状隆起,黏膜光滑,界限清楚,直径大小2~11 mm,6例病变外观均呈黄色改变,1例为灰白色。超声内镜显示7例病变均局限于黏膜及黏膜下层,呈低回声改变,均未累及固有肌层。见图1。
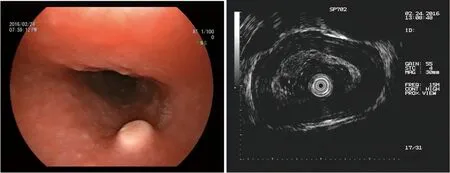
图1 食管GCT的白光内镜及超声内镜表现
2.3 治疗及预后 4例患者行内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)治疗,3 例行内镜下黏膜切除术(endoscopic mucosal resection,EMR)治疗。7例均完整切除并送病理学检查,术中无穿孔及活动性出血,术后均恢复良好。术后6例随访1~3年,复查胃镜未见肿瘤复发。1 例因为近期发现,术后3个月随访1次,复查胃镜未见复发。见图2。
2.4 病理及免疫组织化学结果 术后病理证实4例病变浸润至黏膜层、3例为黏膜下层。与术前超声内镜比较3例患者层次判断有误,其中2例为黏膜下层,超声内镜判断为黏膜层;另1例为黏膜层,却判断为黏膜下层,判断过深。
病理HE染色见肿瘤细胞排列紧密,呈巢状或条索状,细胞大小一致,胞质丰富有大量嗜酸性颗粒细胞,核小、圆而居中。免疫组织化学肿瘤细胞 S-100、Vinmentin、CD68均阳性,CK、CD117、CD34、Actin、Desmin均阴性,Ki-67<5%。见图3。
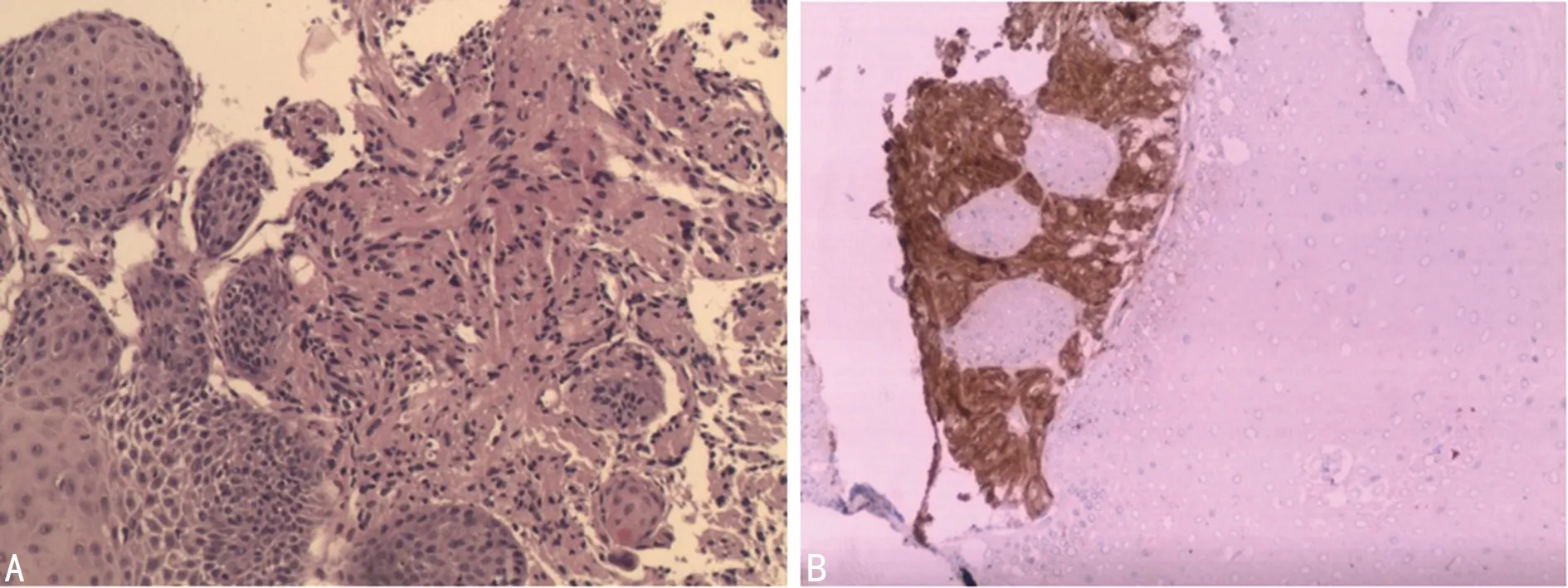
A:S-100阳性;B:CD68阳性
图3食管GCT免疫组织化学染色(Envision法,×100)
3 讨 论
颗粒细胞瘤(granular cell tumor,GCT)因其细胞质充满分布均匀的嗜酸性颗粒而命名。1926年由ABRIKOSSOF教授首次描述报道,而食管GCT于1931年首次被报道。目前多认为其来源于施万细胞分化的神经鞘膜细胞或外周神经[5],在解剖上与神经关系密切。曾有文献[6]报道GCT好发于30~60岁,女性多见。本研究显示患者发病年龄为33~57岁,平均(47.8±7.9)岁,其中女4例,男3例,男女比例为3∶4,与文献[6]报道相符。
食管GCT 无特异性症状,多因非特异性症状偶然行胃镜检查被发现,部分瘤体较大者可表现为腹部不适、胸骨后不适,吞咽不畅等消化道症状,根据肿瘤大小及部位的不同而症状各异[7]。本研究 7例患者中5例因偶然胃镜检查被发现。故胃镜筛查是目前发现GCT的主要方法。
内镜下食管GCT多表现为黏膜下隆起,肿瘤直径多小于2 cm,呈结节状、颗粒状或无蒂息肉状,表面呈淡黄色或灰白色[8]。本研究中7例均为单发,其中2例病变位于食管中段,5例病变位于食管下段,且发生于食管下段者多位于距门齿35~37 cm,直径在2~11 mm。但从白光内镜下很难与平滑肌瘤、类癌、神经内分泌瘤或息肉等相鉴别。不过本研究中6例病变外观均呈黄色改变,1例为灰白色,故食管中下段淡黄色、灰白色病变均需注意该病可能,但确诊仍需病理活检。
近年来超声内镜在临床上被广泛应用,其有利于观察病变的大小、层次,并对是否能内镜下治疗有一定的指导意义[9]。本研究中7例均表现为低回声病变,内部回声均匀,主要来源于黏膜层和黏膜下层,但与术后病理的病变浸润层次比较结果仍有差异。分析原因可能与普通的超声微探头分辨率限制,对于黏膜层病变,具体到上皮层、黏膜固有层和黏膜肌层较难准确分辨,此外因为病变无包膜,呈浸润生长,且部分病灶由黏膜固有层、黏膜肌层及黏膜下层逐渐浸润并累及,也较难分辨。另与操作者手法、经验和熟练成程度也有一定关系。故目前超声内镜对于较小病变的诊断准确性仍待提高,但因病变主要局限于黏膜层和黏膜下层,故对于指导内镜下治疗仍有一定参考价值。
食管GCT有恶变的可能,且可能并存其他类型的恶性肿瘤,故目前主张进行积极的治疗。因GCT多位于黏膜固有层及黏膜下层,与固有肌层彻底分离,因此内镜下切除包括内镜下黏膜剥离术(ESD)和内镜下黏膜切除术(EMR)等是一种安全、可行的方法[10]。KAHNG等[11]曾报道了ESD成功整块切除了直径2.8 cm的病例,并且认为对于直径大于2 cm的病变应用ESD治疗是一种安全、可行的方法。也有学者提出对于直径2~3 cm,位于黏膜下层的病变可采用一种新型的内镜治疗技术-黏膜下隧道内镜切除术(submucosal tunneling endoscopic resection,STER)[12]。本研究均采用的是内镜下治疗,除第5、6、7例患者因诊断是2015年前,采用的是EMR方法,近3年来均采用ESD方法切除病变,结果提示病变均完整切除,切缘干净,术中及术后未见出血、穿孔等并发症,术后随访1~3年,未见肿瘤复发及转移,证明ESD和EMR术治疗食管GCT安全有效并且值得临床上推广应用。但因部分患者仍有恶变和转移可能,故应注意术后随访。
目前食管GCT确诊仍依靠病理和免疫组织化学结果。病理上肿瘤呈浸润性生长,瘤细胞排列呈片状或巢状,瘤细胞呈卵圆形或多角形,胞质嗜酸性,颗粒状,细胞核位于中央,小而呈圆形,一般不见核分裂及坏死。免疫组织化学上表达S-100、CD68和Vimentin,不表达CD117、CD34、Actin、Desmin、CK等[13]。本组颗粒细胞瘤绝大部分具有颗粒细胞瘤典型的病理形态学特点,免疫组织化学检测S-100蛋白、CD68和Vimentin均为阳性。
食管颗粒细胞瘤是一种罕见的具有恶性倾向的来源于神经施万细胞的软组织肿瘤,其早期多无典型临床症状,经偶然胃镜检查发现,确诊主要依靠特征性的病理形态学特点及典型的免疫组织化学结果。超声内镜对于判断病变的来源层次仍有待提高,但对于指导内镜下治疗有一定意义。对于局限在黏膜和黏膜下层者,目前内镜下ESD和EMR治疗是较好的手术方式。
