新疆额尔齐斯河冷水性鲤鱼肠道细菌多样性分析
2019-12-03黄丽丽孙海龙倪永清
黄丽丽 孙海龙 倪永清 周 红*
(1 石河子大学食品学院 新疆石河子832000 2 江南大学食品学院 江苏无锡214122)
鲤鱼(Cyprinus carpio),俗称鲤子,属于硬骨鱼纲,鲤形目,鲤科,是分布最广、历史最为悠久的淡水鱼之一。其适应环境的能力比较强,可在低温及溶氧条件下存活。鲤鱼喜欢生活在营养丰富的底层或水草滋生繁茂的水域,常栖息于水流缓慢的河川、湖泊、水库、池塘等地区。鲤鱼是杂食性鱼类,主要以藻类、水生植物以及各种浮游生物和底栖动物等为食[1]。鱼类生活的环境(水体)、食物中存在着大量的微生物,在鱼类生长发育过程中,这些微生物随着鱼类的饮水或进食进入其消化道,由此建立起复杂的肠道微生物区系[2-4]。
鱼肠道内寄生着的各种微生物,对鱼体的营养、健康和免疫等发挥着极其重要的作用[3,5-7]。鱼肠道最初只是一个相对简单而密闭的腔道,在胚胎时期开始逐渐地变长、弯曲,最后发育成熟[8]。刚孵化的鱼仔的肠道是无菌的[2],之后孵化出的幼鱼开始摄食和饮水,这样鱼肠道内就逐渐形成了一个由好氧、厌氧和兼性厌氧的微生物组成菌群[9-10]。鱼类的肠道微生物菌群并不是对其栖息环境中微生物的简单反映[11]。正常生理条件下,定植在鱼肠道中的各种微生物保持平衡状态,是一个多种群动态变化的系统[4,10,12]。鱼肠道菌群结构的组成与鱼的种类、生存环境和捕食习性等因素密切相关[12-14]。研究表明,在淡水鱼类的肠道中,比较常见的微生物主要有拟杆菌属(Bacteroide)、邻单胞菌属(Plesiomonas)、气单胞菌属(Aeromonas)、肠杆菌属(Enterobacter)、不动杆菌(Acinetobacter)和假单胞菌属(Pseudomonas),海水鱼中主要是假单胞菌(Pseudomonas)、微 球 菌 属(Micrococcus)、无 色杆菌属(Achromobacter)、棒状杆菌属(Corynebacterium)、交替单胞菌属 (Alteromonas)、黄杆菌属(Flavobacterium)和弧菌(Vibrio)[15]。而在鲤鱼肠道中,拟杆菌门(Bacteroidetes)、浮霉菌门(Planctomycetes)和变形菌门(Proteobacteria)是其优势菌群[16]。Han 等[17]对生存于相同环境中的杂食性鲤鱼、鲫鱼以及其它食性的8 种鱼的肠道微生物区系进行比较分析,结果表明鱼类的营养水平不同会显著影响其肠道微生物组成与多样性。另外,不同区段的鱼肠道中,微生物菌落结构有所不同。Moran 等[18]利用末端限制片段长度多态性(Terminal restriction fragment length polymorphism,TRFLP) 技术分析草食性海水鱼 (Kyphosus sydneyanus)肠道菌群的多样性,发现后肠中的细菌群落的多样性比较复杂。也有研究显示,淡水类鲤科鱼的肠道细菌数量从前肠至后肠逐渐增多,这有可能是肠道内容物由前向后推进,或者是后肠的肠道内容物和环境更适合细菌的生长繁殖[19]。目前有关鲤鱼肠道细菌多样性的报道主要集中在人工养殖的鲤鱼,对野生鲤鱼肠道细菌研究较少,尤其与冷水性鲤鱼相关的报道几乎为零。
额尔齐斯河流域 (47°00′~49°10′N,85°31′~90°31′E)位于我国新疆北部,属于中高纬度地区,水质清澈(基本无污染),河内水生生物丰富多样。额尔齐斯河平均水温常年低于20 ℃,栖居着大量的冷水性鱼类,长期以来一直为我国渔业行业所关注。鲤鱼作为额尔齐斯河主要冷水性鱼类之一,主要分布在额尔齐斯河布尔津河段。本研究采用Illumina MiSeq 测序技术对新疆额尔齐斯河流域的野生冷水性鲤鱼肠道中不同区段细菌微生物组进行比较研究,以期了解鲤鱼肠道细菌群落的组成差异及其多样性,为额尔齐斯河冷水鱼资源的保护、开发和利用提供科学依据。
1 材料与主要试剂
1.1 材料与试剂
2014年8月,在新疆额尔齐斯河采集成年野生鲤鱼(Cyprinus carpio),编号LY,体重(8.00 ±0.3)kg,分为3 组,置于4 ℃冷藏,12 h 内运至实验室。
相关生理生化试验试剂,天津市巴斯夫化学试剂厂;DNA 提取试剂盒(Qiagen,Germany)QIAGEN 公司。
1.2 主要仪器和设备
凝胶成像系统 (Gel DOC XR),Bio Rad 公司;超微量紫外分光光度计 (NanoDrop 2000),Thermo 公司;水平电泳仪(Power Pac Universal),Bio Rad 公司;高速冷冻离型机 (Fresco21 型),Thermo 公司。
2 方法
2.1 样品处理
新鲜的鲤鱼样品先用70%的酒精漂洗,在无菌操作台上解剖,得到鲤鱼肠道。肠道外表面再用70%的酒精擦拭,在无菌条件下每条鱼按照前肠(Q)、中肠(Z)和后肠(H)将其肠道分为3 段[20],然后收集肠道样品放入已灭菌的离心管中,于4 ℃条件下保存。
2.2 样品总DNA 的提取
准确称取鲤鱼肠道样品1 g 于10 mL 无菌PBS(pH 7.4) 缓冲液中,使样品充分溶解。取混合液在4 ℃条件2 000 r/min 离心5 min,弃沉淀。吸取上层液体于另一干净的无菌离心管中,4 ℃下10 000 r/min 离 心10 min,收 集 沉 淀。按 照TIANamp Stool DNA Kit 试剂盒要求提取沉淀中的细菌总DNA。提取的DNA 经琼脂糖凝胶电泳分析后,用超微量紫外分光光度计检测总DNA 的浓度和纯度,最后将DNA 于-20 ℃保存备用。
2.3 PCR 扩增及高通量测序
以样品总DNA 为模板,对细菌16Sr RNA 基因的V4 区进行PCR 扩增,上游引物515F:5’-GTGCCAGCMGCCGCGGTAA-3’,下游引物806R:5’-GGACTACHVGGGTWTCTAAT-3’,并引入接头。PCR 扩增体系25 μL,预混液(5×Prime Hot Master Mix) 10 μL,引物各0.5 μL,DNA 模板1 μL,补足ddH2O 至25 μL。反应条件:94 ℃预变性3 min,(94 ℃45 s;50 ℃60 s;72 ℃90 s)×35 次循环,后72 ℃终延伸10 min[21]。PCR 产物通过琼脂糖凝胶电泳检测,并利用琼脂糖凝胶回收试剂盒纯化产物,采用Illumina MiSeq 测序平台进行高通量测序。
3 结果与分析
3.1 鲤鱼肠道样品的DNA 预定量
提取的样品DNA 用超微量紫外分光光度计测定浓度与纯度,并依据OD260/OD280值检测DNA纯度。由表1可知,样品DNA 的OD260/OD280值在1.8~2.0 之间,OD260/OD230值均大于2.0,符合测序要求。
3.2 鲤鱼肠道门水平细菌组成及其多样性
利用Illmina miseq 高通量测序对鲤鱼肠道样品的16S rDNA 基因V4 区进行分析,获得35 289个优化序列。按照97%的相似度进行OTU 分类,共划分158 个OTU,见图1。通过计算多样性指数发现,鲤鱼后肠的ACE 指数和Chao 指数明显高于前肠和中肠,说明后肠中物种丰度最高。此外,后肠的Shannon 指数最小,Simpson 指数最大,表明鲤鱼后肠中细菌群落结构较为复杂。而鲤鱼前肠和中肠中ACE、Chao、Shannon 和Simpson 指数几乎相同,两者差异不显著。
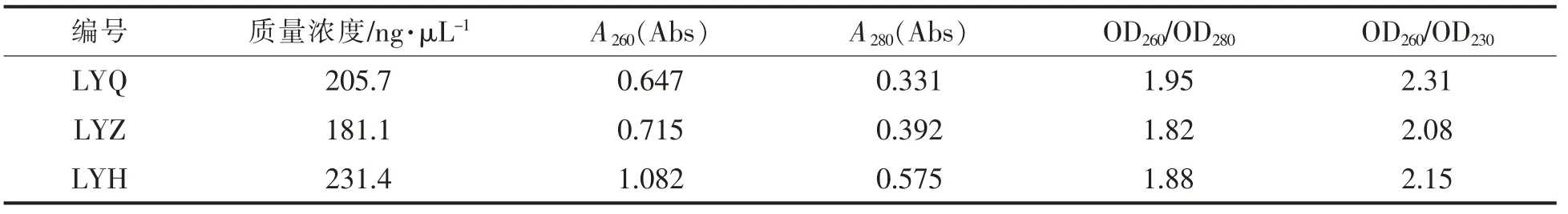
表1 样品DNA 的浓度与纯度Table 1 The concentration and purity of DNA in the samples
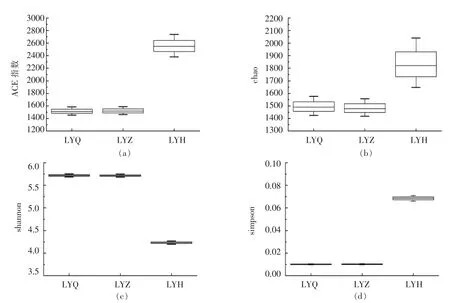
图1 鲤鱼肠道不同区段的细菌多样性指数Fig.1 Bacterial diversity index in different segments of carp intestine
根据各样品OTU 分类结果进行物种注释,分别在门和纲水平下统计样品物种的丰度。从鲤鱼肠道中共鉴定出12 个细菌门,分别是酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)、蓝菌门(Cyanobacteria)、绿弯菌门(Chloroflexi)、浮霉菌门(Planctomycetes)、变形菌门(Proteobacteria)、互养菌门(Synergistetes)、硝化螺菌门(Nitrospira)、疣微菌门(Verrucomicrobia)、未分类菌群(Others)(图2a)。其中,变形菌门(38.80%)是鲤鱼肠道中最丰富的类群,其次是厚壁菌门(31.86%);拟杆菌门(7.47%)和放线菌门(7.26%)等丰度也较高,且鲤鱼肠道不同区段均有分布。在前肠和中肠中最占优势的菌群门也是变形菌门,占各自样本序列的56.24%和55.85%;其次是拟杆菌门,分别占其样本序列的11.04%和11.42%。鲤鱼后肠中厚壁菌门为其优势菌,其所占比例达到58.06%;变形菌门是其第二大优势菌群。如图2b 所示,对鲤鱼肠道的主要细菌类群做进一步分析发现,变形菌门主要由α-变形菌纲(Alphaproteobacteria),β-变形菌纲 (Betaproteobacteria),δ-变形菌纲(Deltaproteobacteria),γ-变形菌纲(Gammaproteobacteria)构成,厚壁菌门主要以芽孢杆菌纲(Bacilli)和梭菌纲(Clostridia)为主,而黄杆菌(Flavobacteria)是拟杆菌门的主要构成部分。γ-变形菌纲在鲤鱼肠道中占主要优势,其次是β-变形菌门和杆菌。前肠的纲类群有α-变形菌纲,β-变形菌纲,δ-变形菌纲,γ-变形菌纲,黄杆菌和互养菌纲等,其中γ-变形菌纲丰度最高,占其样本序列的29.94%。在中肠丰度最高也是γ-变形菌纲 (27.74%),其中有12.07%的样本序列被划分为叶绿体(类似于蓝藻细菌),这些序列可能是来源于食物成分中植物的叶绿体序列,此外检测到β-变形菌纲(11.68%),δ-变形菌纲(11.08%)等。而后肠中却只检测到酸杆菌纲、芽孢杆菌纲、梭菌纲和Negativicutes 纲,4者的占比分别为24.42%,64.55%,10.88%和0.14%。由此可以看出,鲤鱼肠道中不同区段的细菌群落结构有所不同,前肠和中肠细菌的组成和丰度比例较为相似,与后肠存在显著差异。
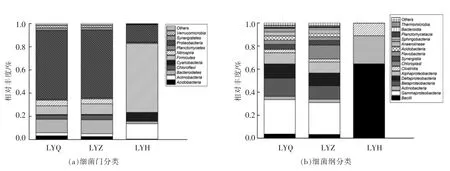
图2 门和纲水平不同区段的鲤鱼肠道细菌组成Fig.2 Bacteria composition in different segments of carp intestine at phylum and class levels
3.3 鲤鱼肠道属水平细菌群落结构及其组成差异
如图3所示,属水平上鲤鱼肠道中细菌主要由乳球菌属(Lactococcus)、极小单胞菌属(Pusillimonas)、肉食杆菌属(Carnobacterium)、棒状杆菌(Corynebacterium)、肠球菌属(Enterococcus)、土壤红杆菌属 (Solirubrobacter)、伯克氏菌属(Burkholderia)、假单胞菌属(Pseudomonas)、螺菌属(Leptospirillum)、硫杆菌属(Acidithiobacillus)、不动杆菌属 (Acinetobacter)、盐单胞菌属(Halomonas)、固氮弧菌 (Azoarcus)、链球菌属(Streptococcus)、红球菌属(Rhodococcus)和明串珠菌属(Trichococcus)等组成。在鲤鱼肠道中最占优势的菌群是肉食杆菌属(14.69%);其次是硫杆菌属(10.32%)、乳球菌属(7.74%)、固氮弧菌(6.75%)、螺菌属(5.61%)和极小单胞菌属(4.13%),占样本总量的近50%。在前肠和中肠中硫杆菌属占主要优势,分别占各自样本序列的15.00%和18.77%;其后是固氮弧菌,在样本中的丰度分别为10.84%和10.77%。而在后肠中,以肉食杆菌属、乳球菌属、肠球菌属和土壤红杆菌属等为主,其中肉食杆菌属占其样本序列的31.69%,是后肠中的主要菌群,乳球菌属(10.78%)次之。不同区段的鲤鱼肠道中细菌数量有所不同,其中硫杆菌属、固氮弧菌、螺菌属、极小单胞菌属等在肠和中肠中所占比例较高,而在后肠中丰度急剧下降,占比分别降到2.41%,1.92%,0.07%,1.33%和1.10%;而肉食杆菌属、肠球菌属、土壤红杆菌属、棒状杆菌、链球菌属、红球菌、梭菌在后肠丰度较高,在前肠和中肠丰度极低,不足1%,而在后肠则迅速增多。此外,有些类群则仅在特定的样品中出现,如土壤红杆菌属仅在中肠和后肠存在,在中肠丰度较低,而后肠中比例达5.46%;同样,前肠和后肠所特有的属是梭菌属,在前肠中丰度较低,而后肠中比例为3.91%;与后肠相比,这些菌群在前肠和中肠的相对丰度通常较低,物种丰度也明显低于后肠。聚类结果表明鲤鱼前肠和中肠的细菌组成和丰度比例相近,两样本具有相似性,而后肠中细菌的种类和数量均与前肠和中肠存在差异,这说明不同区段的鲤鱼肠道中细菌群落结构有所不同。由图4可知,前肠和中肠之间差异比较小,中肠和后肠次之,而前肠和后肠样本间群落结构差异最大,表明鲤鱼前肠和中肠的细菌群落结构较相似。

图3 鲤鱼肠道细菌群落结构Heatmap 图Fig.3 The Heatmap of bacterial community structure in carp intestinal
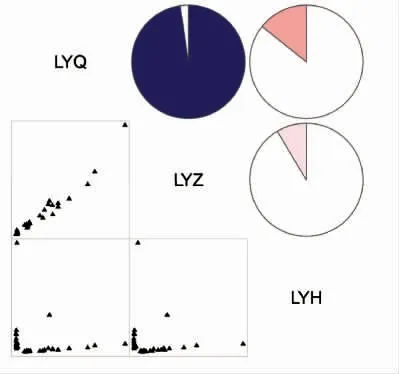
图4 不同区段的鲤鱼肠道细菌群落结构差异分析Fig.4 Differential analysis the community structure in different segments of carp intestine
根据鲤鱼肠道不同区段中细菌的丰度差异,对20 个主要的属进行相关性分析(图5),结果表明样品中各个细菌属之间存在一定的相关性。由图5可知,伯克氏菌和硫杆菌与其它属之间的相关性都比较低,这3 个属的数量随着鲤鱼肠道由前至后呈递减趋势。而分枝杆菌(Mycobacterium)、棒状杆菌、梭菌和土壤红杆菌之间的正相关性比较大,其在前肠和中肠所占比例较低,而在后肠中数量显著增加,分别为2.65%,2.39%,1.79%,1.26%和2.50%。此外,随着乳球菌、肉食杆菌等乳酸菌数量的增加,假单胞菌前肠的3.69%降到中肠的2.82%,最后在后肠中所占比例仅有0.40%,它们之间表现出负相关性;在乳球菌、链球菌、肠球菌和肉食杆菌之间数量变化趋势一致,而且从前肠到后肠是逐渐增多的。它们中增长趋势最大是肉食杆菌,在前肠和中场中占比只有0.12%和0.69%,而在后肠中肉食杆菌的比例为31.69%。乳球菌、链球菌和肠球菌各自在后肠中的占比为10.78%,1.44%和6.38%,是后肠中的主要菌群。
4 讨论
鱼类肠道菌群与其宿主形成了相互作用、相互依赖的统一体,是宿主必不可少的关键部分[22]。鱼肠道中的微生物种类繁多,数量极大,包括好氧、专性厌氧和兼性厌氧等微生物。据报道,细菌是鱼肠道主要的微生物种类[23]。在鱼类的肠道中的细菌,比较常见的主要有弧菌、气单胞菌属、邻单胞菌、假单胞菌、肠杆菌、微球菌、不动杆菌、梭菌和拟杆菌等[24]。因鱼的食性,生存环境等差异,故在优势菌群和群落结构组成及比例方面均有所不同。Han 等[17]采用高通量测序技术研究芜湖野生鲤鱼肠道中的细菌群落,发现梭菌和拟杆菌是鲤鱼肠道中占主要优势的类群。Maartje 等[25]研究人工养殖的鲤鱼肠道微生物结构,结果显示,梭菌、拟杆菌和浮霉菌为其主要的优势菌群。而在本研究中,冷水鲤鱼肠道中主要以梭菌、拟杆菌、假单胞菌、气单胞菌和一些乳酸菌(Lactic acid bacteria)为主。与以上研究相比,优势菌群基本一致,丰度比例却各有不同,这可能是栖息环境、营养水平等对鲤鱼肠道菌群组成的影响。有研究表明,鱼肠道内的细菌,如发光细菌、弧菌、细杆菌、微球菌、不动杆菌、假单胞菌、气单胞菌以及一些未鉴定出的厌氧菌等都可以分泌蛋白酶、α-淀粉酶等消化酶,促进鱼类的消化和吸收[7]。另外,乳酸菌也是鱼类肠道菌群的重要组成成分,在本研究中检测到乳球菌、肠球菌、链球菌、明串珠菌和肉食杆菌等乳酸菌。研究表明乳酸菌不仅有助于鱼类的消化吸收,还能竞争肠壁附着点分泌抑菌物质来抑制致病菌的增殖,保持肠道微生物区系的稳定,增强鱼类的免疫力[26]。Robertson 等[27]发现在大马哈鱼肠道中分离出的肉食杆菌能抑制气单胞菌、黄杆菌和弧菌等病原菌。Carlos 等[28]在虹鳟鱼中鉴定出片球菌、乳球菌、魏斯氏菌、肉食杆菌等乳酸菌具有抗菌活性,能抑制主要的鱼源性致病菌,减少病原菌在鱼肠道内的定植,可作为微生物饲料添加剂应用于水产养殖业中。

图5 鲤鱼肠道细菌群落属间相关性分析Fig.5 Correlation analysis the community of carp intestinal at genus level
研究显示,鱼类的肠道微生物群落的组成和功能在不同的肠道区域和器官各不相同[29]。Ni等[30]发现鱼类的肠道菌群不只受外界环境的影响,其所处的肠道部位的不同微生物群落组成也有所不同。对成年大比目鱼(Scophthalmus maximus)的肠道微生物进行研究,发现其胃、前肠、后肠和直肠中的细菌群落存在明显差异,具有地域特异性,并且细菌群落的多样性从胃到直肠依次降低[31]。Moran 等[32]也证实了草食性海水鱼(Kyphosus sydneyanus)肠道的不同部位的细菌群落结构不同,其中后肠细菌多样性高于前肠。本研究中,通过计算多样性指数发现冷水性鲤鱼后肠物种丰度高于前肠和中肠,后肠的细菌多样性最复杂。其中梭菌、乳球菌、棒状杆菌、肠球菌、链球菌、红球菌、Solirubrobacter、明串珠菌、漫游球菌和肉食杆菌等菌群随着鲤鱼肠道从前肠到后肠逐渐增多,这可能是由于后肠更利于细菌的生长繁殖的缘故。研究表明鲤鱼前肠中的细菌大多数依赖于宿主的营养而生存,而后肠中细菌的生长繁殖主要靠吸收食物中的营养成分[33]。此外,Kihara 等[34]发现鲤鱼肠道中的细菌能分解利用饮食中酶不消化性低聚糖产生短链脂肪酸(Short Chain Fatty Acid,SCFA),包括乙酸、丙酸和丁酸等。本研究中发现后肠中乳酸菌的数量较多,是后肠中的主要菌群,这可能是因为食物在后肠发酵产生的酸环境更利于乳酸菌的定植。另外,乳球菌、肉食杆菌等乳酸菌常被作为益生菌添加于饲料中,可以提高鱼类的免疫功能[26]。假单胞菌、气单胞菌和黄杆菌是常见的鱼类致病菌[27]。本研究中发现随着乳酸菌数量的增加,假单胞菌、伯克氏菌等病原菌减少,推测这可能是乳酸菌在肠道中代谢产生的细菌素等活性物质会抑制病原菌的生长。乳球菌链球菌、肉食杆菌、肠球菌各种乳酸菌之间的还表现出协同作用,这为混合益生菌饲料添加剂的开发和研究提供理论依据。
本文对额尔齐斯河冷水性鲤鱼冷水鲤鱼不同区段肠道的细菌微生物组进行比较分析,发现鲤鱼肠道细菌群落组成复杂多样,前肠和中肠的细菌群落结构组成较为相似,与后肠细菌群落结构及多样性差异显著。这将为进一步开展有关鲤鱼肠道菌群的研究提供理论依据。
