不同类型水生植物对水化学性质影响差异研究
2019-12-03柱李秀苏
张 乾 柱李 玉 秀苏 玲
(1.重庆交通大学 建筑与城市规划学院,重庆 400074; 2.长江科学院 重庆分院,重庆 400026; 3.自然资源部 广西岩溶动力学重点实验室,广西 桂林 541004)
作为水域生态系统的重要组成部分,水生植物通过光合作用和呼吸作用影响水-岩-气之间的相互作用以及水中溶解无机碳(DIC)的稳定性,进而引起水化学动态变化[1-2]。水化学性质的空间、季节甚至昼夜变化正逐渐受到人们的重视[3-5]。对水化学性质,尤其是对水中DIC的来源、转化及其影响因素的监测,也成为了研究全球碳循环的重要手段。
然而,不同类型的水生植物利用的碳源(CO2或HCO3-)[6]、根际环境[7]等有所差别,进而会对水化学性质产生不同影响。由于气体CO2在水中的扩散受到限制,沉水植物进行光合作用更倾向于利用水中HCO3-作为碳源,而挺水植物则可以更多地利用大气中的CO2。对桂林会仙湿地研究发现,尽管挺水植物的固碳量大于沉水植物,但沉水植物固定的碳77.27%~100%来自于水中HCO3-,挺水植物固定的碳则只有17.65%~35.07%来自于水中HCO3-,其余部分来自于大气CO2[8]。另外,沉水植物分布的水域,溶解氧(DO)主要受沉水植物光合作用和呼吸作用影响,往往与HCO3-浓度表现出相反的变化特征[4]。而在挺水植物分布的水域,挺水植物根部泌氧则是影响水中DO的主要原因[9],因此导致挺水植物水域DO含量较高[10]。这说明在不同的植物类型影响下,水化学性质会表现出不同的变化特征。揭示不同水生植物对其产生的影响机制,有利于准确估算全球碳通量并为合理改善水生态环境提供理论依据。
1 研究区概况
该研究选择重庆交通大学李子湖为研究对象。研究区位于重庆市江津区,属亚热带季风气候,年平均气温和年平均降水量分别为18.2°C和1 034.7 mm。于2018年5月7日从上游至下游,在东西两岸各选择4个监测点进行对比分析(见图1)。该区出露地层为侏罗系上沙溪庙组暗紫色、紫红色砂质泥岩、泥岩与灰岩、灰紫色长石砂岩、粉砂岩互层。作为校区内重要的水体景观,李子湖受人类活动影响较强,湖水中藻类繁盛。西岸连续分布挺水植物(香蒲),而东岸紧邻教学区域,挺水植物较少且分布零散。另外,4号和8号监测点生长大量沉水植物(菹草)。湖水主要来源于上游的李子水库,并从4号处流出。
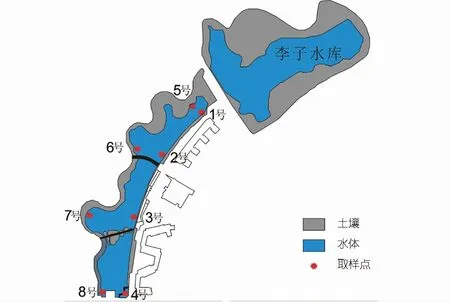
图1 研究区概况Fig.1 Location of study site
2 样品采取与监测方法
在各监测点现场监测水温、pH、电导率(EC)、溶解氧(DO)及总溶解固体(TDS)。水温、EC、pH值及DO采用德国WTW公司生产的Multi350i测定,精度分别为0.1°C、1 μS/cm、0.01和0.5%;TDS用美国麦隆9P型便携式电导率仪进行测定,精度为1 μS/cm;HCO3-和CO32-浓度在现场用德国Merck碱度计测定,精度为0.1 mmol/L。同时,采集水样以测试湖水阴阳离子浓度及δ13CDIC。用50 mL聚乙烯塑料瓶采集水样,加入1∶1优级纯硝酸,酸化至pH <2,以防止阳离子附着在瓶壁上,用赛默飞iCAPTM7200 ICP-OES 等离子体光谱仪测试阳离子浓度,测试工作在长江科学院重庆分院完成。用50 mL棕色聚乙烯塑料瓶装满水样,在现场滴入2滴饱和HgCl2以避免微生物对其产生干扰,带回实验室后保存在4°C的冰箱中,用连接Gas Bench的MAT253(美国热电公司)同位素质谱仪测试δ13CDIC(V-PDB),分析误差<0.15‰,测试工作在自然资源部岩溶动力学重点实验室完成。
3 结果与分析
3.1 李子湖水化学性质变化特征
各监测点之间距离较近,水温差异较小,但pH,EC,TDS和DO差异明显,其变化范围分别为8.68~9.74,392.80~460.70 μS/cm,257.80~304.80 mg/L以及8.87~14.20 mg/L(见图2)。pH,EC,TDS和DO在东岸呈现出沿程降低的变化特征;在西岸,8号处的EC和TDS最低, pH值和DO含量最高。
两岸离子浓度的变化特征也具有一定的差异性。东岸Ca2+浓度沿程降低,而西岸除8号处Ca2+浓度明显降低外,其他各点Ca2+浓度变化不大,见图3(a)。除8号外,各监测点的Mg2+浓度差异较小,变化范围为8.03~8.97 mmol/L,见图3(b)。由于湖水pH大于8.3且小于12,水中溶解无机碳(DIC)由HCO3-以及CO32-两部分组成。HCO3-,CO32-及DIC的浓度分别为1.7~2.7,0.1~0.5,2.2~2.8 mmol/L。东岸DIC浓度呈现出沿程增加的趋势,从1号处的2.3 mmol/L上升到4号处的2.7 mmol/L。而西岸除8号处DIC浓度明显下降外,其他3个监测点的DIC浓度基本相同,见图3(c)。

图2 各监测点水化学性质差异Fig.2 Variation of hydrochemistry among eight sites
3.2 不同水生植物光合作用对水化学性质的影响
8号处的DIC浓度、Ca2+浓度、EC以及TDS最低,pH值和DO浓度最高(见图2,3),这与该监测点分布有大量沉水植物有关。由于取样时间为13:00~16:00,植物光合作用强烈,沉水植物光合作用可以利用水中HCO3-作为碳源并释放氧气。许多研究也发现了类似的现象,尤其是在HCO3-浓度较高的岩溶地区,水生植物光合作用吸收HCO3-并导致方解石沉淀,进而导致水中DIC浓度、Ca2+浓度以及EC降低而DO和pH上升[11]。然而,4号监测点也分布有大量沉水植物,水化学性质并没有表现出与8号相似的特征。Hayashi等人的研究发现,在平水期受植物光合作用和呼吸作用影响,水中的DO和pH具有明显的昼夜变化,但洪水导致流速加快会移除生物膜和固着生物,影响水生植物的光合作用,从而使DO和pH的昼夜变化受到干扰[12]。由于4号位于李子湖出水口处,流速较高导致湖水滞留时间较短,从而在一定程度上限制了光合作用的影响。因此,4号处的水化学性质与8号处存在明显差异。
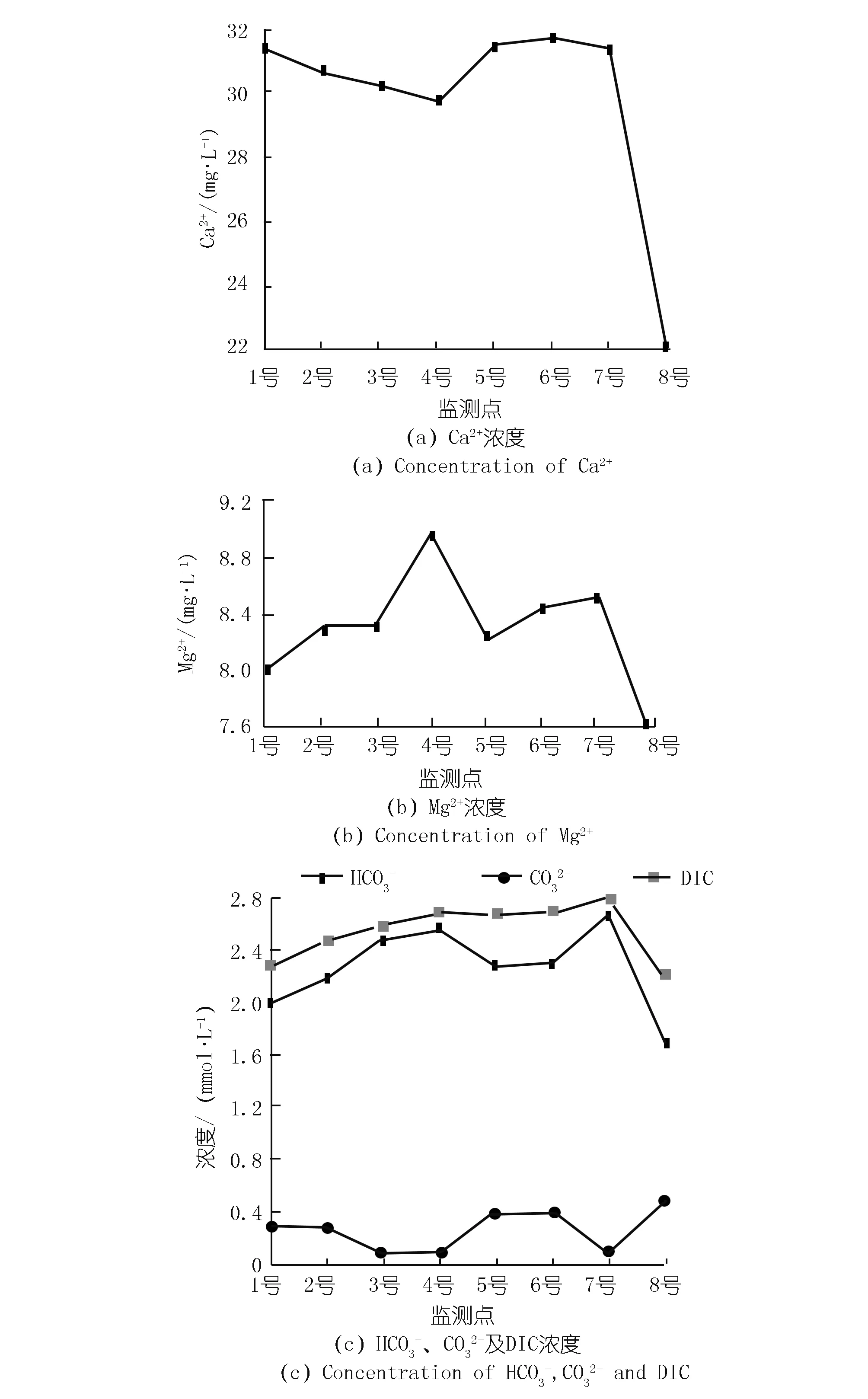
图3 各监测点离子浓度Fig.3 Ion concentrations of eight sites
在不考虑8号的情况下,对比两岸水化学性质发现,西岸5,6,7号的Ca2+浓度、DIC浓度、EC和TDS分别大于东岸1,2,3号,这可能与两岸水生植物类型的差异有关。不同的水生植物,其利用碳源的方式并不相同。李子湖东岸水生植物主要以藻类为主,其光合作用消耗HCO3-导致DIC浓度降低。而西岸分布有大量的挺水植物,其进行光合作用并不以水中HCO3-为主。根据李强等对贵州草海的研究,沉水植物进行光合作用的碳源可以全部来自于HCO3-,而挺水植物进行光合作用的碳源只有12.93%来自于HCO3-[6]。这是因为挺水植物可以充分利用大气、水中和底泥中CO2三种碳源,并且在水中DIC浓度较低的情况下,挺水植物更倾向于利用大气CO2[13]。同时,挺水植物还会通过遮光作用、与藻类竞争水中营养物质以及分泌抑制藻类的化感物质等,对藻类生长产生抑制作用[14-15],阻碍藻类通过光合作用吸收HCO3-,进而导致西岸水中Ca2+浓度、DIC浓度、EC和TDS大于东岸。然而,水化学性质若只受光合作用影响,DO应与DIC浓度、EC和TDS呈现相反的变化特征。但图2显示,西岸DO并没有小于东岸,因为挺水植物可以通过植物的通气组织将氧气输送到底质部分以增加水中DO[10,16]。因此,虽然西岸挺水植物抑制藻类生长使DIC浓度高于东岸,但并没有导致水中的DO浓度降低。
3.3 水化学性质沿程变化特征及影响因素
3.3.1东 岸
东岸EC、TDS和Ca2+浓度沿程递减反映了藻类光合作用对水化学性质产生了重要影响。但如上所述,藻类光合作用消耗水中DIC并释放氧气,水中DIC浓度应沿程逐渐降低而pH和DO应沿程逐渐升高。结果却显示东岸DIC含量沿程逐渐增加,而pH和DO逐渐降低(见图2)。
本次监测期间的湖水温度较高(见图2),微生物活性加强。微生物分解有机质消耗氧气,并向水体释放CO2,可能导致东岸DO、pH沿程降低而DIC浓度沿程增加。然而除碳源氧化耗氧外,有机质分解耗氧还包括硝化耗氧[17]。硝化耗氧也会降低DO,同时释放H+,导致湖水pH下降。但硝化耗氧并不产生CO2,从而不会导致水中DIC浓度增加。为验证湖水中DIC是否主要来源于有机质的分解,本研究进一步分析了湖水DIC的稳定碳同位素(δ13CDIC)。
李子湖水δ13CDIC为-7.91‰~-4.82‰(见图4),这与贵州草海湖水δ13CDIC(-3.7‰~-10.6‰)的变化范围一致[18]。李子湖水主要来源于上游的李子水库,大气CO2、水生植物呼吸与有机质分解产生的CO2以及基岩溶解是水中DIC的主要来源。由于各个碳源的δ13C不同,δ13CDIC可以反映出不同碳源对水中DIC的贡献。有机质的δ13CDIC较为偏负[18],如果湖水中DIC浓度沿程增加是由于微生物分解有机质造成的,湖水δ13CDIC应沿程逐渐偏负。
然而,东岸δ13CDIC沿程偏正,说明水中DIC增加的主要原因并不是有机质分解,而是有更为偏正的碳进入水体。其来源可能有以下两个:① 研究区基岩中碳酸盐岩的溶蚀。碳酸盐岩溶蚀性较强,并且碳酸盐岩的δ13C通常为-3‰~+2‰[19],溶蚀后会导致水中DIC浓度增加且δ13CDIC偏正。但东岸Ca2+浓度、EC以及TDS并没有随DIC增加而增加,说明东岸DIC浓度沿程增加并不是由碳酸盐岩溶蚀造成的。② 大气CO2通过水-气界面进入水体。太湖春季水-气界面的碳通量监测结果显示,在水体营养化严重的湖区,白天湖水会成为大气CO2的汇[20]。陈毅凤等[18]建立的贵州草海湖泊系统碳循环简单模式,也发现大气CO2每年向湖水输入的净碳量高达35 t。大气CO2的δ13C约为-8‰,其溶解于水后发生+8%的同位素分馏,形成的DIC的δ13C约为0‰[21]。假设4号处DIC由1号处的DIC和混入水中的DIC两个端元组成。运用同位素混合比例法可知混入水中的DIC的δ13C。公式如下:
δ13CDIC(4号)=
Xδ13CDIC(1号)+(1-X)δ13CDIC(混入DIC)
式中,X为各端元DIC所占比例。1号处为2.3 mmol/L,占4号处DIC(2.7 mmol/L)的85%;沿途DIC增加了0.4 mmol/L(即混入了0.4 mmol/L的DIC),占4号处DIC的15%;4号处δ13CDIC为-5.29‰;1号处δ13CDIC为-5.95‰。计算得出混入水中的DIC,其δ13C为-1.55‰,接近大气CO2进入水中形成的DIC的δ13C值(0‰),说明东岸增加的DIC主要来自于大气CO2。其δ13C值略偏负于大气CO2的δ13C,则说明并不能完全排除生物分解有机质对湖水DIC有一定的贡献。
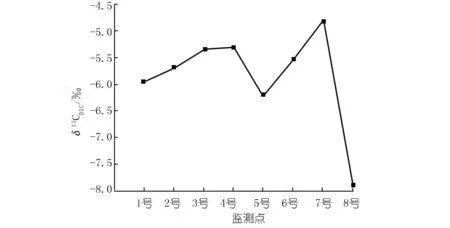
图4 各监测点δ13CDICFig.4 δ13CDICof eight sites
3.3.2西 岸
在不考虑8号的情况下,DO在6号处上升随后在7号处下降,Ca2+浓度、DIC浓度在5号、6号和7号处变化并不明显,这可能与西岸挺水植物有关。如上文所述,挺水植物输送到根际的氧气补偿了硝化作用对DO的消耗,从而导致6号处DO上升。而在7号处, DO下降则说明硝化耗氧的影响可能又开始大于挺水植物。另外,西岸Ca2+浓度并没有与东岸一样表现出沿程下降的趋势。一方面是由于挺水植物限制了藻类对水中DIC的吸收,从而减少了方解石沉淀;另一方面可能是由于挺水植物根部分泌有机酸以及根际环境有利于微生物生长,加速了碳酸盐岩溶蚀,从而弥补了光合作用造成的Ca2+损失。碳酸盐岩溶蚀同样会弥补藻类光合作用消耗的DIC,并导致湖水δ13CDIC偏正。但随着溶蚀作用加强,水中pCO2升高,这又会反过来限制大气CO2进入水体[22]。因此,与东岸不同,西岸受几种作用共同影响,虽然δ13CDIC沿程偏正但DIC浓度变化不大。
8号处明显受到了沉水植物光合作用的影响,但其δ13CDIC却最为偏负,这与光合作用会导致δ13CDIC偏正的现象不符。其原因可能是因为8号处较为封闭,沉水植物产生的有机质使水中轻碳富集,并且新鲜有机质的分解速率明显较快[23],碳源耗氧可能对水中DIC的贡献较大,从而导致了8号处δ13CDIC最为偏负。
4 结 语
(1) 水生植物光合作用会对水化学性质产生明显影响,但不同植物类型产生的影响并不相同。沉水植物和藻类吸收水中的DIC,导致Ca2+浓度、DIC浓度、TDS和EC电导率下降,而DO和pH升高;但挺水植物光合作用主要吸收大气CO2,同时对藻类产生抑制作用,从而导致东西两岸水化学性质的差异明显。
(2) 水中有机质分解硝化耗氧和大气CO2进入水体是影响东岸湖水DO、pH和DIC浓度沿程变化的主要因素。西岸挺水植物导致水化学性质受几种作用的综合影响,水化学性质沿程变化特征及影响因素与东岸明显不同。
该研究只监测了水化学性质的空间变化特征,为进一步探索李子湖水化学性质的影响因素,还需对水化学的时间(昼夜、季节)变化进行对比。
