RNAi沉默SDF-1基因对新诱导建立的人胃癌耐药细胞系SGC7901/L-OHP的影响
2019-12-02刘小慧贺曼曼郭明海冯运章
刘小慧 贺曼曼 张 伟 李 静 郭明海 冯运章
胃癌是消化系统恶性肿瘤,起病隐匿,80%以上的胃癌患者被诊断时已处于进展期,单纯手术治疗预后不理想[1]。目前进展期胃癌已形成以手术为主,联合化疗、放疗、靶向、免疫等措施的综合治疗模式。新辅助化疗、转化治疗或术后辅助化疗均能改善部分患者总体生存期[2]。奥沙利铂(oxaliplatin,L-OHP)是胃癌化疗核心药物,但临床上常见到对其耐药的患者[3,4]。胃癌异质性极强,一旦肿瘤细胞耐药严重影响化疗效果,最终导致肿瘤复发和转移。因此,深入研究肿瘤细胞耐药意义重大,而体外建立耐药细胞系是研究细胞耐药的重要模型。基质细胞衍生因子-1(stromal cell-derived factor- 1,SDF-1)是一种炎性趋化因子,与其特异性受体CXCR4结合后参与介导炎性和免疫反应、调控造血、血管生成、恶性肿瘤的浸润转移等多种病理生理过程[5]。目前有研究报道SDF-1高表达与白血病、卵巢癌、肺癌细胞化疗耐药密切相关[6~8]。但胃癌细胞耐药中SDF-1是否发挥作用鲜有报道。因此本研究旨在诱导建立对L-OHP耐药的胃癌细胞系SGC7901/L-OHP,观察其生物学行为变化,并在此基础上应用RNAi技术沉默SDF-1基因表达,探讨SDF-1基因对胃癌耐药细胞系SGC7901/L-OHP增殖、凋亡、耐药的影响及可能机制。
材料与方法
1.材料:(1)细胞株:胃癌细胞株SGC7901购自中国科学院上海细胞研究所。(2)主要试剂、药物:兔抗人SDF-1单克隆体抗(Abcam公司,ab155090);转染试剂盒Lipofectamine-2000、Trizol Reagent(美国 Invitrogen 公司);cDNA 合成试剂盒(美国Fermentas公司);全蛋白提取试剂盒(南京凯基生物公司);MTT试剂盒、溴化乙锭(美国Sigma公司)。实验相关PCR引物均由上海生物工程有限公司合成;SDF-1小干扰RNA质粒由上海吉玛制药有限公司合成。奥沙利铂(50毫克/支,武汉医药有限公司)。
2.奥沙利铂耐药胃癌细胞系的诱导构建及生物学行为变化:(1)奥沙利铂耐药胃癌细胞系的构建与评定:人胃癌细胞株SGC7901常规培养传代。采用高浓度间歇冲击诱导法:预实验检测SGC7901细胞IC50约为10μg/ml,取对数生长期细胞与1μg/ml(1/10 IC50)的L-OHP在培养箱共孵育24h,弃培养液,PBS清洗,换新鲜培养液,待细胞恢复生长后,增加药量为2μg/ml(1/5 IC50),重复上述步骤,根据存活耐药细胞恢复对数生长的时间,间歇缩短给药时间并增大药物浓度,分别为5、10、20、40、80μg/ml,历时5.5个月,最终诱导能在10μg/ml的L-OHP共培养基中稳定生长的细胞,MTT检测并计算其耐药指数(resistance index,RI)为5.5,经多次冷冻复苏其耐药指数均较为恒定,命名为SGC7901/L-OHP。下述实验开展前细胞均脱药培养2周。(2)观察SGC7901/L-OHP形态学变化:①倒置显微镜观察:SGC7901与SGC7901/L-OHP收集接种至24孔培养板,培养48h后倒置显微镜拍照观察;②透射电镜观察:收集两种细胞,经固定、脱水、包埋、切片、染色,透射电镜拍照观察。(3)细胞计数法绘制生长曲线:取对数生长期的细胞约2×104个,培养于24孔板,设3个复孔,用细胞计数板每天计数3个孔细胞数,取平均值,共观察6天,绘制细胞生长曲线,并计算两种细胞群体倍增时间(TD)。(4)MMT法检测L-OHP对SGC7901、SGC7901/L-OHP细胞增殖的影响:各取对数期细胞约2×104个,培养于96孔板,24h后分别按照L-OHP(1.0、2.5、5.0、10.0、20.0、40.0、80.0μg/ml)浓度梯度加药,每种浓度设3个复孔,培养48h后每孔加入MTT溶液(浓度5mg/ml)20μl,37℃培养4h,弃上清, 加100μl的DMSO,自动酶标仪测定各孔570nm波长吸光度值,分别计算两种细胞增殖抑制率[增殖抑制率=(1-用药组A/对照组A)×100%]。SPSS软件计算IC50值。实验重复5次。(5)流式细胞术检测SGC7901与SGC7901/L-OHP细胞周期变化:各取对数期细胞,0.25%胰酶消化后调整细胞密度为1×106/ml,设3个复孔,离心,弃上清,PBS洗涤,70%乙醇固定,4℃过夜,PBS洗涤3次,再离心,弃上清及乙醇,加碘化丙啶染液500μl,4℃避光反应30min,上机检测。实验重复5次。(6)RT-PCR检测SDF-1 mRNA表达:按2×107收集对数期两种细胞,Trizol法提取细胞总RNA,按试剂盒说明书将RNA反转录为cDNA,配置25μl反应体系扩增目的基因。引物序列:SDF-1,上游引物(5′→3′):GGGTACCATGCAGCTTGTTG;下游引物(5′→3′):GAGATCTCTAGGCGCCCTGG。GAPDH,上游引物(5′→3′): AGAAGGCTGGGGCTCATTTG;下游引物(5′→3′):AGGGGCCATCCACAGTCTTC。RT-PCR反应条件:预变性94℃5min→94℃变性30s→(SDF-1,55℃;GAPDH,58℃)退火60s→72℃延伸1min,扩增30个循环。SDF-1 mRNA相对表达强度=IOD(SDF-1)/IOD(GAPDH)。实验重复5次。(7)Western blot法检测SDF-1蛋白表达:分别收集2×107个细胞提取蛋白,BCA法测定蛋白浓度,50μg蛋白上样,经SDS-PAGE电泳分离,转PVDF膜。20ml封闭液室温摇床孵育1.5h,弃封闭液,一抗孵育(兔抗人SDF-1单抗),4℃孵育过夜后洗膜,按1∶3000稀释倍数加入辣根酶标记的二抗,室温摇床孵育1.5h。洗膜后用红外荧光扫描成像系统扫描,以GAPDH作为内参计算SDF-1蛋白相对表达强度。实验重复5次。
3.SDF-1-RNAi转染后SGC7901/L-OHP生物学行为的变化:(1)SDF-1-RNAi的合成、实验分组及转染:SDF-1-RNAi由上海吉凯基因化学技术有限公司合成,其序列(5′→3′):GTGCATTGACCCGAAGCTAAATCAAGAGTTTAGCTTCGGGTCAATG-CACTTTTT。非特异性序列(5′→3′):GATCCGAC-GAGTTGACTGCGATTGTTCAAGAGACAATCGCAGTC-AACTCGTCGTCAGA。实验分3组,即空白对照组(细胞不经任何处理)、阴性对照组(转染非特异性序列质粒)和SDF-1-RNAi组(转染SDF-1-RNAi质粒)。细胞接种于6孔板,融合度80%左右时通过Lipofectamine 2000进行转染。转染48h后检测转染效率并进行后续实验。后续实验均重复5次。(2)RT-PCR、Western blot法检测SDF-1表达情况:RT-PCR及Western blot法具体实验步骤同前,检验转染后3组细胞SDF-1 mRNA和蛋白表达,验证沉默效果。(3)MTT法检测3组细胞增殖抑制率变化:MTT实验步骤同前,检测转染后48h 3组细胞增殖及耐药性变化。(4)流式细胞仪检测3组细胞凋亡率及细胞周期变化:具体操作同前,凋亡率检测按照试剂盒说明书进行,应用流式细胞仪检测细胞凋亡率及周期分布。
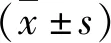
结 果
1.SGC7901/L-OHP形态学改变:5.5个月后成功诱导建立SGC7901/L-OHP,倒置显微镜下观察,与亲本细胞比较,最终建立的耐药细胞形态变得不规则,变细变长,可见梭形、长条形、三角形细胞,并可见较多漂浮细胞,生长分布比较均匀,聚集生长现象不明显(图1)。透射电镜下观察SGC7901细胞核清晰,核仁明显,细胞形态规则,表面见丰富微绒毛。SGC7901/L-OHP细胞核相对增大,细胞质空泡结构明显增多,细胞形态不规则,表面微绒毛较少(图2)。

图1 SGC7901和SGC7901/L-OHP倒置显微镜观察A.SGC7901(×100);B.SGC7901(×200);C.SGC7901/L-OHP(×100);D.SGC7901/L-OHP(×200)

图2 SGC7901和SGC7901/L-OHP透射电镜观察A.SGC7901(×5000);B.SGC7901/L-OHP(×5000)
2.SGC7901/L-OHP生长曲线及倍增时间:细胞计数法记录两种细胞每日细胞数,以时间为横轴,细胞数为纵轴,绘制生长曲线(图3)。经公式计算SGC7901与SGC7901/L-OHP的群体倍增时间分别为23.56±1.44h、27.83±1.67h。与SGC7901比较,SGC7901/L-OHP群体倍增时间明显延长(P<0.05),耐药细胞增殖明显减慢。

图3 SGC7901和GC7901/L-OHP细胞生长曲线
3.SGC7901/L-OHP对L-OHP的耐药性变化:由图4可见,随着L-OHP浓度的升高,两种细胞增殖抑制率均明显升高,但在L-OHP相同浓度下,SGC7901/L-OHP细胞增殖抑制率明显低于SGC7901(P均<0.05)。SGC7901的IC50为10.424±1.193μg/ml,SGC7901/L-OHP IC50为57.405±2.158μg/ml,RI为5.5。Snow等研究认为,细胞耐药分为低度耐药(RI<5)、中度耐药(RI 5~15)和高度耐药(RI>15)。依此标准本实验成功建立中度耐药细胞系SGC7901/L-OHP,且多次冷冻复苏后复测耐药指数恒定。

图4 奥沙利铂对SGC7901与SGC7901/L-OHP的细胞抑制率比较与SGC7901比较,*P<0.05
4.SGC7901与SGC7901/L-OHP细胞周期分布情况:流式细胞仪检测结果显示,与SGC7901比较,SGC7901/L-OHP的G0/G1期细胞比例显著升高(P<0.01),S期细胞比例显著减低(P<0.01),G2/M期细胞比例无变化(P>0.05,表1,图5)。
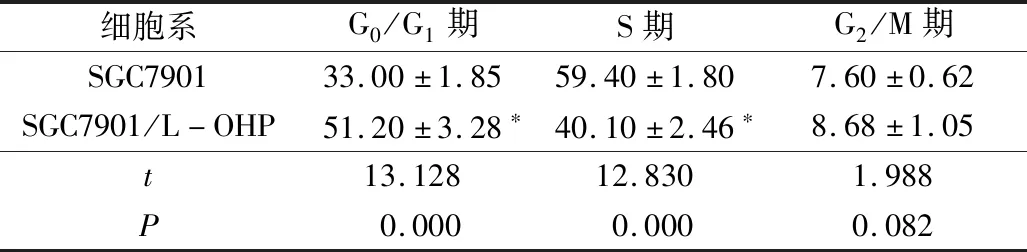
表1 SGC7901与SGC7901/L-OHP细胞周期分布
与SGC7901比较,*P<0.05
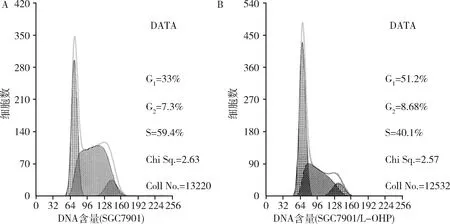
图5 SGC7901与SGC7901/L-OHP细胞周期分布
5.SGC7901与SGC7901/L-OHP中SDF-1表达情况:RT-PCR结果显示,SGC7901/L-OHP细胞中SDF-1 mRNA的表达量明显高于SGC7901细胞(1.367±0.173 vs 0.750±0.104,t=6.833,P<0.01)。Western blot法检测结果显示,SGC7901/L-OHP细胞中SDF-1蛋白的表达量明显高于SGC7901细胞(1.647±0.220 vs 1.255±0.158,t=3.226,P<0.05,图6)。

图6 两种细胞株中SDF-1 mRNA及蛋白的表达情况a.SGC7901;b.SGC7901/L-OHP
6.SDF-1-RNAi转染后SDF-1的表达:RT-PCR结果显示SDF-1-RNAi转染48h后,空白对照组、阴性对照组、SDF-1-RNAi组SDF-1 mRNA表达量分别为1.367±0.178、1.336±0.225、0.328±0.035,转染组与空白、阴性对照组比较差异均有统计学意义(F=62.843,P<0.01),空白与阴性对照组比较差异无统计学意义,表明siRNA-SDF-1成功沉默了SDF-1 mRNA的表达。Western blot法检测结果显示,空白对照组、阴性对照组、SDF-1-RNAi组SDF-1蛋白表达量分别为1.655±0.282、1.583±0.263、0.242±0.024,SDF-1-RNAi组与空白、阴性对照组比较差异均有统计学意义(F=64.147,P<0.01),空白与阴性对照组比较差异无统计学意义,从蛋白水平也印证了siRNA-SDF-1成功沉默了SDF-1蛋白的表达(图7)。

图7 转染后3组细胞SDF-1 mRNA和蛋白表达情况A.空白对照组;B.阴性对照组;C.SDF-1-RNAi组
7.SDF-1-RNAi转染后SGC7901/L-OHP细胞增殖抑制率及化疗敏感度变化:转染48h后MTT检测结果显示,随着L-OHP浓度的递增,3组细胞的增殖抑制率均明显升高。在L-OHP相同浓度下,SDF-1-RNAi组细胞的增殖抑制率明显高于空白、阴性对照组(P均<0.05),阴性对照组与空白对照组比较差异无统计学意义,提示沉默SDF-1后SGC7901/L-OHP增殖受到明显抑制。同时,SDF-1-RNAi组IC50(20.512±1.666)明显低于空白及阴性对照组(55.565±2.345,53.030±2.458,P<0.05),耐药指数明显降低(图8)。

图8 奥沙利铂对各组细胞增殖抑制率的比较与空白、阴性对照组比较,*P<0.05
8.SDF-1-RNAi转染后SGC7901/L-OHP细胞凋亡率的变化:转染48h后流式细胞仪检测结果显示,SDF-1-RNAi组细胞凋亡率明显高于空白及阴性对照组(P均<0.05),空白对照组与阴性对照组凋亡率比较差异无统计学意义(P>0.05,表2)。
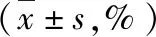
表2 3组细胞凋亡率及细胞周期分布的比较
与空白、阴性对照组比较,*P<0.05
9.SDF-1-RNAi转染后SGC7901/L-OHP细胞周期分布变化:流式细胞仪检测结果(表2,图9)显示,与空白及阴性对照组比较,SDF-1-RNAi组细胞被阻滞于S期,S期细胞比例显著增加(F=17.584,P<0.01),G0/G1期细胞比例显著降低(F=37.193,P<0.01),G2/M期细胞比例无变化(F=0.822,P>0.05)。空白对照组与阴性对照组比较,各期细胞比例均衡,差异无统计学意义(P均>0.05)。

图9 流式细胞仪检测3组细胞的细胞周期分布A.空白对照组;B.阴性对照组;C.SDF-1-RNAi组
讨 论
我国胃癌发生率位居恶性肿瘤第4位,病死率居第2位,其中约90%发现时已到进展期,即使手术治疗,5年生存率仍低于30%[9,10]。扩大手术切除范围和术后辅助化疗依旧是提高胃癌术后生存率的主要手段[11]。XELOX方案或SOX方案是胃癌一线化疗方案,核心药物均包含奥沙利铂。奥沙利铂通过铂原子与DNA形成链内交联、链间交联及蛋白质交联,从而损伤DNA[3]。然而在治愈肿瘤或显著延长患者生存期方面,化疗效果并不理想,化疗过程中存活肿瘤细胞的再增殖及肿瘤细胞的耐药性是导致化疗失败的关键[12]。有鉴于此,对肿瘤细胞耐药及逆转耐药的研究始终是一种热潮。体外建立耐药细胞系是研究肿瘤耐药的基础,通常采用低浓度持续诱导和高浓度间歇冲击两种方法构建。
李彩丽等[13]分别采用上述两种方法诱导建立大肠癌耐药细胞系SW480/OXP,认为高浓度间歇冲击法具有诱导时相短以及构建的细胞系耐药性更稳定的优点。因此本研究采用大剂量间歇冲击诱导法,历时5.5个月成功建立人胃癌奥沙利铂中度耐药细胞系SGC7901/L-OXP。从光镜下观察,与SGC7901细胞比较,SGC7901/L-OXP细胞形态不规则,细胞细长,可见梭形、长条形、三角形细胞。文俏程等[14]研究认为SGC7901/L-OXP细胞的这种形态改变属于上皮-间质转化(epithelial-mesenchymal transition,EMT),EMT可能是人胃癌细胞对 L-OHP 产生耐药的重要机制。生长曲线分析显示SGC7901/L-OXP细胞增殖变缓,倍增时间较SGC7901细胞延长约4h。而细胞倍增时间越长其对化疗药物越不敏感[15]。MTT结果显示在L-OHP相同浓度作用下,SGC7901/L-OHP细胞增殖抑制率明显低于SGC7901,表明耐药细胞对L-OHP药物敏感度明显降低。同时,与SGC7901细胞比较,SGC7901/L-OHP细胞周期分布发生改变,G0/G1期细胞升高,S期细胞减少,G2/M期细胞无变化。一般的化疗药物只对增殖期细胞敏感,对G0期细胞效果相对较差[9],这可能是人胃癌SGC7901细胞对 L-OHP 产生耐药的另一个重要原因。
SDF-1是一种炎性趋化因子,与其配体 CXCR4 广泛表达于人体多种细胞和组织,在白血病、卵巢癌、肺癌等恶性肿瘤增殖、侵袭、转移、耐药中均发挥重要作用[6~8]。SDF-1能够诱导ERK磷酸化,上调Bcl-xL的表达进而降低ALL细胞株SUP-B15对阿霉素的敏感度,保护白血病细胞耐受化疗[6]。SDF-1能促进卵巢癌细胞增殖与克隆,提高其同源重组修复能力,介导顺铂耐药[7]。肿瘤相关成纤维细胞通过分泌SDF-1提高Bcl-xL的表达,增强肺癌A549细胞对顺铂的耐药性[8]。此外,沈照华等[16]发现SDF-1/CXCR4轴能促使白血病成骨龛基质细胞层包裹白血病细胞形成“庇护所”样结构,促使白血病细胞滞留于静止期,屏蔽阿糖胞苷的杀伤,而阻断SDF-1/CXCR4轴活性后,静止期细胞脱离成骨龛,对化疗药物敏感度增加,细胞凋亡增加。
本实验结果显示,SGC7901/L-OHP细胞中SDF-1 mRNA和蛋白的表达量明显高于SGC7901细胞,提示SDF-1高表达参与了SGC7901对L-OHP获得性耐药过程。应用RNAi技术沉默SDF-1表达后,SDF-1-RNAi组细胞SDF-1 mRNA和蛋白的表达量显著低于空白、阴性对照组,表明SDF-1-RNAi能够有效沉默SDF-1基因。在此基础上MTT结果显示,在相同L-OHP浓度作用下,SDF-1-RNAi组细胞增殖抑制率明显高于空白及阴性对照组,且其IC50值明显降低,表明沉默SDF-1能够有效抑制SGC7901/L-OHP细胞增殖,提高其对L-OHP的药物敏感度,部分逆转耐药。目前研究认为EMT与肿瘤侵袭转移耐药均有关联,而SDF-1对EMT具有正向促进作用[17~20]。SDF-1高表达能促进结直肠癌细胞、胆管癌RBE细胞EMT进程,促进侵袭转移[18,19]。
SDF-1可以通过MEK/ERK和PI3K/AKT信号通路上调胶质母细胞瘤U-251 细胞Survivin基因表达,进而调控细胞周期进展并促进EMT[20]。动物实验研究表明,SDF-1能促进G0/G1期兔膝关节软骨细胞进入增殖周期,促进其体外增殖并抑制凋亡[21]。本实验沉默SDF-1表达后发现,与对照组比较,SDF-1-RNAi组细胞增殖受限,凋亡率增加,且细胞周期分布发生改变,表现为G0/G1期细胞减少,S期细胞增多,细胞周期阻滞于S期。由此推测SDF-1促进SGC7901/L-OHP细胞增殖的靶点可能位于S期进入G2/M期的“关卡”上,当沉默SDF-1表达后细胞阻滞于S期,细胞增殖受限,并可能通过抑制Survivin、Bcl-xL的表达导致细胞凋亡增加。同时SDF-1基因沉默导致细胞EMT进程受阻,G0/G1期细胞失去间质化细胞的“庇护”,进入S期,在L-OHP的作用下大量坏死,从而提高了L-OHP的药物敏感度。
综上所述,本研究成功构建了人胃癌奥沙利铂中度耐药细胞系SGC7901/L-OHP,并通过RNAi技术沉默SDF-1基因表达,发现能够抑制细胞增殖,阻滞细胞周期进程,并促进细胞凋亡,提高细胞对L-OHP的敏感度,部分逆转耐药性。今后SDF-1有望成为逆转肿瘤耐药的一个靶点。
