纳米铁去除水体中镉的反应动力学、吸附平衡和影响因素
2019-11-30黄园英王倩汤奇峰刘久臣陈翠柏刘斯文
黄园英 ,王倩 ,汤奇峰 ,刘久臣 ,陈翠柏,刘斯文 *
1. 国家地质实验测试中心,北京 100037;
2. 自然资源部生态地球化学重点实验室,北京 100037;
3. 中国地质大学水资源与环境学院,北京 100083;
4. 青岛聚创环保设备有限公司,山东 青岛 266043
随着工业发展,大量重金属排入土壤及河流、湖泊和海洋等水体中,危害土壤、水生生态环境(Axtell et al.,2003;Amarasinghe et al.,2007;陈程等,2010)。在这些重金属中,镉尤为突出。镉(Cd)主要是通过石油燃烧、金属生产、磷肥施用、染料和液晶屏(Sharma,2008;Alloway et al.,1999;Perez-Marin et al.,2007)等途经进入环境中。在我国,重金属已导致土壤和水严重污染。Cd被列为人类致癌和致畸形物质,有研究表明Cd进入人体后首先造成对肾功能的损伤,进而引起肺、肝、骨、生殖器官的损伤,严重时可导致癌症的产生(Mahalik et al.,1995)。世界卫生组织(WHO)规定饮用水中 Cd浓度不能超过 0.003 mg·L-1(WHO,2008)。由于 Cd污染的普遍性和低的饮用水标准,所以必须发展一些技术去除污染水体中Cd。
目前,含镉废水实用处理技术包括化学沉淀法(邵红艳等,2018;常艳丽,2013)、铁氧体法(商娟等,2017;Wen et al.,2017)、离子交换法(车荣睿等,1994)、电絮凝法(孔茜,2009)、膜分离法(Mathilde,2004)、吸附法(符云聪等,2018;Qasemi et al.,2018)等。处理含镉废水技术方法很多,但各有优点和不足,含镉废水要达到低浓度或零排放标准则需对一些新颖且具有广阔应用前景的方法加大科研力度。吸附法能够高效去除低浓度重金属,且具有易操作、高选择性、低成本等优点,因此其是重金属最有应用前景的分离和净化方法(King et al.,2007;Fazlzadeh et al.,2017;Shams et al.,2016)。近年来,纳米零价铁(nano zero valent iron,nZVI)将污染物还原去除成为了一个非常活跃研究领域(Boparai et al.,2011;Leili et al.,2018;黄园英等,2014)。纳米零价铁具有较强还原能力,可把在金属活动顺序表中排于其后的金属置换出来而沉积在铁表面从而达到去除污染的目的(Westerhof et al.,2003)。大量研究表明,与普通铁粉和铁屑相比,nZVI具有粒径小,比表面积大,反应活性高的特点。因此,nZVI用于环境污染物治理已成为一种新技术。
目前国内有关纳米铁去除水体中Cd吸附行为和动力学方面研究报道较少。本研究通过批实验考察nZVI对Cd2+吸附反应动力学和等温吸附平衡过程,并探讨了nZVI对Cd2+去除效果的主要影响因素(包括反应液初始pH、反应时间、nZVI投加量和重金属初始质量浓度等),研究结果将有助于更好地评估nZVI对重金属去除,尤其是对含镉污染场地治理实际应用的可行性。
1 材料与方法
1.1 纳米铁制备
室温,磁力搅拌器搅拌条件下,将1.6 mol·L-1NaBH4溶液逐滴加入到等体积1.0 mol·L-1FeCl3溶液中,待所有NaBH4溶液加完后,继续反应15 min,便可获得纳米铁颗粒,Fe3+被还原的过程如下:

通过上述反应,将获得的黑色铁颗粒分别用大量除氧去离子水和无水乙醇洗2—3遍,于50 ℃烘箱中放置过夜,置于干燥器中保存备用,以上所有操作都在氮气流中进行(黄园英等,2014)。利用比表面与孔隙度分析仪通过氮气吸附法测得纳米铁颗粒比表面积。通过透射电镜(TEM)和扫描电镜(SEM)可观察纳米铁颗粒大小分布特征和微型貌,见图1。
1.2 主要仪器和试剂
仪器:H-8100型透射电子显微镜(日本日立公司),Quanta FEG 450型热场发射环境电镜(美国FEI公司),Autosorb-1型比表面与孔隙度分析仪(美国康塔仪器),SHA-B型数显水浴恒温振荡器(江苏金坛市荣华仪器),DHG-9070A型干燥箱(上海一恒科技有限公司),C-MAG HS4S25型磁力搅拌器(德国IKA公司),AP-9908S型真空泵(天津奥特赛恩斯仪器有限公司),TJA-IRIS-Advantage型电感耦合等离子体光谱仪(美国Thermo公司)。
试剂:FeCl3、NaBH4、Cd(NO3)2和NaOH都为分析纯,浓HCl为优级纯,无水乙醇为色谱纯。
所有玻璃器皿在使用前均用 1:1 HNO3浸泡48 h,分别用自来水和去离子水冲洗数次,阴干,备用。
实验中所有含镉水溶液为模拟废水,均由分析纯Cd(NO3)2试剂配制而成。
1.3 nZVI的吸附试验
1.3.1 动力学吸附试验
为了研究nZVI对Cd2+吸附动力学性质,将1.00 g·L-1nZVI投加到 100 mL初始质量浓度为 75 mg·L-1Cd2+模拟废水中,反应瓶为140 mL玻璃瓶,用密封盖将每个反应瓶封口后放入(25±1) ℃水浴中振荡,振荡速率为130 r·min-1,同时以不加入纳米铁颗粒的反应瓶做平行实验(即为控制样),每隔一定时间取上层清液,经离心和尼龙 66孔径为0.45 μm微孔滤膜过滤后用ICP-AES测定Cd2+的质量浓度。
1.3.2 等温吸附试验
等温吸附实验数据可用于判定吸附机理。通过等温吸附实验可获得不同等温吸附模型,包括Langmuir、Freundlich和Temkin模型。采用批试验方式,进行了Cd2+等温吸附平衡试验研究。吸附平衡试验主要通过改变Cd2+不同初始质量浓度,范围为75—350 mg·L-1,反应瓶为50 mL带活塞的磨口三角瓶,然后向各反应瓶中加入0.04 g新鲜合成的纳米铁,反应液体积为40 mL,即纳米铁质量浓度为1.0 g·L-1,将反应瓶置于(25±1) ℃水浴振荡器中,振荡速率为130 r·min-1,分别在0、48 h取上层清液,经离心和0.45 μm微孔滤膜过滤后用ICP-AES测定Cd2+浓度,每克纳米铁吸附镉质量记为qe,可由下式计算获得:

图1 纳米铁微观图像Fig. 1 Images of nanoscale Fe particles

此处,Ci和 Ce分别为 Cd2+的起始浓度和平衡浓度;m为纳米铁质量(0.04 g);V为反应液体积(0.04 L)。
每个样品都设置2个平行样,文中数据为两者平均值,误差通过误差棒表示。
1.3.3 主要影响因素
采用批实验,探讨反应液中 Cd2+初始质量浓度、nZVI投加量、反应液初始pH对去除率的影响。Cd2+的去除率(η)用下式计算:

式中,t为反应时间(min);C0为初始质量浓度(mg·L-1);Ct为 t时刻时水中 Cd2+质量浓度(mg·L-1)。
1.4 吸附动力学模型
1.4.1 准一级反应动力学
准一级反应动力学方程用来描述发生在固-液界面间的吸附(Ho,2004)。假设一个重金属离子占据一个纳米铁吸附位:

此处A代表纳米铁表面没有被占据的吸附位,k1为准一级反应动力学速率常数(t-1)。该常数能够通过准一级反应方程获得,计算式如下:

式中,qe和qt分别为重金属离子在达到吸附平衡和t时刻的吸附量(mg·g-1);k1为准一级反应动力学速率常数(t-1)。通过积分和边界条件(当t=0时,qt=0,t=t时,qe=qt)由式(3)可推导出:

一级反应动力学认为吸附位被占据速率与未被占据位数量成正比关系。k1和qe可通过ln(qe-qt)与时间t线性关系方程的斜率和截距获得。
1.4.2 准二级反应动力学
准二级反应动力学速率主要用于分析发生在溶液体系中的化学吸附动力学过程(Azizian,2004;Ho,2006)。假设一个Cd2+占据两个纳米铁吸附位,通过化学键(包括共价键或离子键)作用发生化学吸附。吸附速率方程如下式:

(Z)0和(Z)t分别为达到吸附平衡和t时刻吸附材料被占据的活性反应位数。而驱动力,(qe-qt)与可获得的活性反应位成正比关系,由此可推导出准二级反应速率线性方程表达式如下(Ho,2006):

t/qt与t呈线性关系。式(6)中,qt和qe分别为t时刻和达到吸附平衡时纳米铁对重金属的吸附量(单位 m g·g-1);当 t →0 时 ,为起始吸附速率。
1.5 等温吸附模型
单位质量纳米铁对镉吸附量记为qe(mg·g-1),对 qe与达到吸附平衡时溶液中镉的浓度 Ce(mg·L-1)相关关系分别作 Langmuir、Freundlich 和Temkin等温吸附曲线。
1.5.1 Langmuir
Langmuir等温吸附方程为:

式中,KL(L·mg-1)为Langmuir常数;qm(mg·g-1)为单层表面对镉离子最大吸附量。
1.5.2 Freundlich
Freundlich等温吸附方程为:
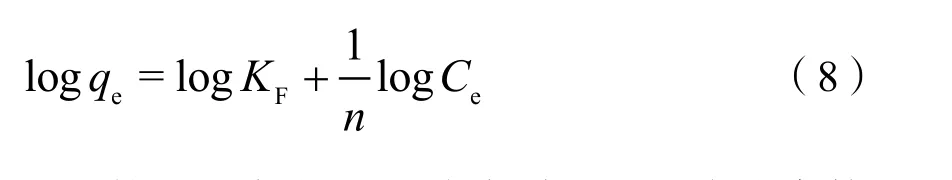
对于某个吸附-解吸系统来说KF和n应为常数,并可通过logqe-logCe曲线回归方程获得。
1.5.3 Temkin
Temkin等温吸附模型表示因吸附质间相互作用,所以吸附热随吸附剂吸附位覆盖率增加而呈线性降低。Temkin等温模型方程为:

式中,b是与吸附热相关的 Temkin常数(J·mol-1);KT为 Temkin 吸附常数(L·g-1);R 为气体常数,8.314 J·mol-1·K-1;t为反应时间;T 为绝对温度。
1.6 粒内扩散方程
粒内扩散方程为:

式中,ki是粒内扩散速率常数(mg·g-1·min0.5);C为截距。
2 结果与分析
2.1 纳米铁颗粒表征
图 1a为纳米铁透射电镜(TEM)微型貌图,图1b—图1d分别为放大3万和1万倍的自制纳米铁扫描电镜(SEM)微型貌图,由图1a TEM可清晰看出纳米铁主要表现为颗粒球状。由 SEM 微型貌图(图 1b—图 1d)可知,纳米铁主要以颗粒状和纤维状存在,并且形成网状结构,直径范围为20—40 nm,表明在纳米铁合成过程中,无水乙醇对抑制纳米铁颗粒团聚具有明显分散效果,因而有利于大幅度提高纳米铁颗粒比表面积。实验室合成的纳米铁颗粒比表面积为49.16 m2·g-1,比商用的微米级铁颗粒高1—2个数量级。
2.2 反应时间和吸附动力学
通常,反应时间将影响污染物吸附量。一般在达到吸附平衡前,随着反应时间延长,吸附量逐渐增加,但达到吸附平衡后,延长反应时间,吸附量基本保持稳定,因此需要通过实验确定达到吸附平衡时间。
反应时间t对Cd2+吸附量影响如图2所示。图2表明在反应0.5 h时,nZVI对Cd2+吸附量快速增加至41.00 mg·g-1,这是由于此时nZVI吸附位都是空缺的,Cd2+很容易占据这些吸附位。随着反应时间延长,nZVI对 Cd2+吸附量逐渐增加,但吸附速率越来越小。振荡24 h后,水溶液中Cd2+质量浓度变化很小,反应基本达到平衡,因此nZVI吸附Cd2+达到平衡时间定为24 h,为了确保有足够反应时间,本吸附实验结束时间为48 h。在达到吸附平衡之前,振荡时间越长,吸附量越大。

图2 反应时间对纳米铁吸附Cd2+的影响Fig. 2 Effect of reaction time on Cd2+ uptake by nZVI
2.2.1 准一级反应动力学

图3 nZVI吸附Cd2+的准一级反应回归曲线Fig. 3 Pseudo-first-order kinetic model fitting for Cd2+ adsorption onto nZVI
根据准一级反应动力学模型,绘制 ln(qe-qt)-t曲线(见图3),得到该反应条件下nZVI对Cd2+准一级反应动力学方程:ln(qe-qt)=-0.078t+3.031。
由回归方程可获得准一级反应速率常数k1=0.078 h-1,相关系数=0.737,由回归方程计算得到qe,cal(20.71 mg·g-1)与实验测得qe,exp(73.48 mg·g-1),其非线性,因此认为nZVI对Cd2+吸附过程并不符合准一级反应动力学模型。
2.2.2 准二级反应动力学
根据二级反应动力学模型,绘制t/qt-t曲线(见图4),得出该反应条件下nZVI对Cd2+的二级反应动力学方程:t/qt=0.013t+0.007。
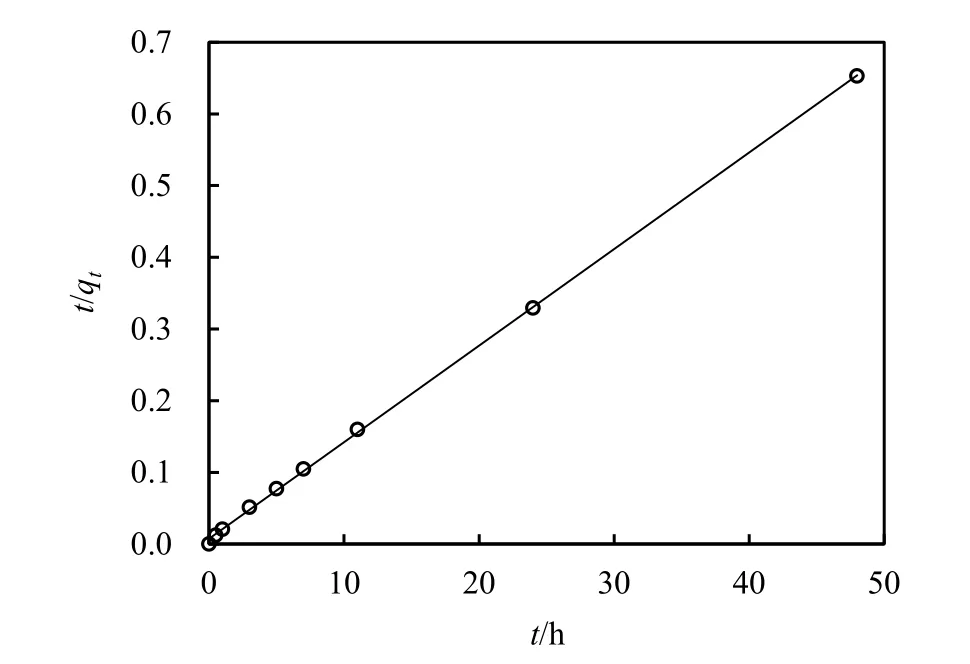
图4 nZVI吸附Cd2+的准二级反应回归曲线Fig.. 4 Pseudo-second-order kinetic model fitting for Cd2+ adsorption onto nZVI
由式(6)得二级反应速率常数k2=0.024 mg·(g·h)-1,相关系数r2=0.999,由式(6)计算得到的qe,cal(76.92 mg·g-1)与实验测得的qe,exp(73.48 mg·g-1),,因此认为nZVI对Cd2+的吸附过程适合二级反应动力学模型,同时说明 nZVI对 Cd2+吸附是通过化学作用吸附在 nZVI表面。
2.3 等温吸附模型
以Ce为横坐标,Ce/qe为纵坐标作图,Langmuir等温吸附模型Ce/qe-Ce关系见图 5,线性回归方程为Ce/qe=0.0039Ce+0.0819(r²=0.9953),Freundlich模型 logqe-logCe线性关系见图 6,回归方程为logqe=0.4106 logCe+1.5281(r²=0.9483),由此方程可知,KF=33.73,n=2.4。因此本实验数据能够很好地符合Langmuir和Freundlich模型,且Langmuir方程比Freundlich更具有代表性。由Langmuir方程可获得纳米铁对镉离子最大吸附量qm为 256.4 mg·g-1。

图5 纳米铁对Cd2+ Langmuir吸附等温曲线Fig. 5 Langmuir isotherms for adsorption of Cd2+ on NZVI

图6 纳米铁对Cd2+ Freundlich吸附等温曲线Fig. 6 Freundlich isotherms for adsorption of Cd2+ on NZVI
Temkin吸附模型的lnCe-qe线性关系见图7,线性回归方程为qe=55.295 lnCe-41.588,线性相关系数r²=0.9666,表明吸附质与吸附剂之间是化学吸附。

图7 纳米铁对Cd2+ Temkin吸附等温曲线Fig. 7 Temkin isotherms for adsorption of Cd2+ on NZVI
2.4 主要影响因素
2.4.1 初始质量浓度
初始质量浓度发挥着重要作用,作为一个驱动力来克服传质阻力,金属离子在溶液与吸附剂表面之间发生运移。然而当功能团表面可获得的活性位达到饱和时,将进一步阻止金属离子的吸附。如图8所示,Cd2+去除率随初始质量浓度增大而减小,初始质量浓度由 45 mg·L-1增加到 92 mg·L-1时,去除率由99.88%下降到76.62%;反应平衡吸附量随Cd2+初始质量浓度的增大而增大,反应进行48 h时,由 44 mg·g-1增大到 79 mg·g-1,这主要是由 Cd2+离子对吸附剂表面吸附位驱动力增加所引起(Kumar et al.,2010)。当 Cd2+初始质量浓度低时,吸附点位足够多,就会发生完全吸附。然而,Cd2+质量浓度高时,吸附点位相对不足,吸附点位容易达到饱和,Cd2+吸附率就会减小。
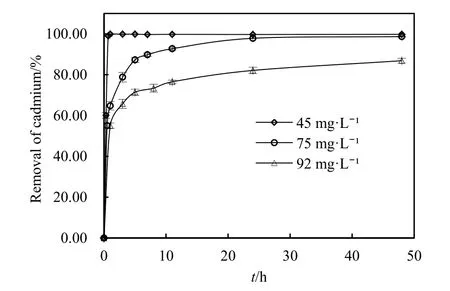
图8 起始浓度对纳米铁吸附Cd2+影响Fig. 8 Effect of initial concentration on Cd2+ uptake by nZVI
2.4.2 nZVI投加量
nZVI作为反应材料,其表面反应点位直接影响反应速率,nZVI质量和表面状况(如反应位数量、表面积质量浓度、表面氧化膜等)在反应体系中起重要作用。本实验通过改变参加反应材料质量来研究nZVI投加量对去除Cd2+影响。
实验中 Cd2+初始质量浓度为 78.02 mg·L-1,nZVI投加量分别为 0.50、0.75、1.00、1.25 g·L-1,其他基准条件不变,结果见图 9。实验结果表明:随着nZVI投加量增加,Cd2+去除率增大,在nZVI投加量大于1.00 g·L-1时,Cd2+去除率基本不变。因此,考虑成本因素,确定投加量为1.00 g·L-1。随着nZVI投加量增加,吸附速率也明显增加,但每克纳米铁对镉吸附量降低,这结果表明获得的吸附位或功能团随着吸附剂增加而增大。当金属离子浓度固定时,吸附剂投加量降低,吸附剂与重金属离子之间更容易发生相互作用。另外,镉离子吸附量随镉离子初始质量浓度增加而增大,但是吸附速率随着Cd2+浓度增加而降低。
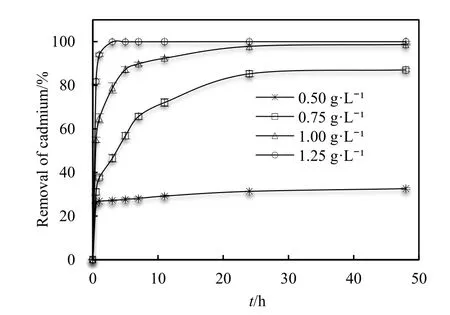
图9 nZVI投加量对纳米铁吸附Cd2+影响Fig. 9 Effect of adsorbent dosage on Cd2+ uptake by nZVI
2.4.3 初始pH
溶液pH是影响吸附剂表面与重金属功能团比例的重要参数之一,众所周知,H+与镉离子(主要是 Cd2+和 CdOH+)存在竞争吸附(Benjamin,2002),因此考察pH范围对Cd2+去除效果影响程度是非常必要的。为了考察pH对纳米铁吸附Cd的影响,吸附试验Cd2+初始质量浓度为75.7 mg·L-1,溶液pH初始变化范围为 1—7之间,其他条件不变。实验前,分别用l mol·L-1NaOH和HCl来调节反应液初始pH值。图10为反应液初始pH分别为(1.7±0.2)、(4.5±0.2)、(7.1±0.2)时,nZVI对 Cd2+吸附速率影响,反应过程中不调节溶液pH。由图10可看出在pH为1.7—7.1时,Cd2+去除率随pH增加而增大。pH为(1.7±0.2)时,观察到反应一段时间后大部分纳米铁溶解,因此去除率会出现先增大后减小的现象,48 h去除率仅为3.4%。在低pH值条件下,吸附剂表面被H+紧密相连,由于排斥作用阻碍金属离子靠近。而当pH在4.5时,吸附量有明显快速增加,48 h去除率达82%。在碱性条件下,吸附剂表面带更多负电荷,随着pH增加静电排斥作用逐渐降低。如果pH更高,越来越多H+与OH-结合产生H2O:在溶液中有Cd2+和Cd(OH)+存在,Cd2+增加或许是由于产生了阳离子水解Cd(OH)+。考虑到当pH大于7时,Cd2+将生成Cd(OH)2沉淀,所以本实验选择pH范围为酸性和近中性条件。因此pH是一个重要影响因素,实际应用过程中要予以重视,比较适宜的溶液pH为中性。

图10 初始pH对纳米铁吸附Cd2+影响Fig. 10 Effect of initial pH on Cd2+ uptake by nZVI
3 讨论
3.1 两种反应动力学模型
动力学模型有利于理解金属吸附机理和评价吸附剂对金属离子去除效果。用来描述重金属去除动力学过程的动力学模型有很多。通过对准一级反应动力学和准二级反应动力学进行比较,发现准二级反应动力学模型获得的线性相关系数r2为0.999,远高于准一级反应动力学模型获得的线性相关系数r2(0.737)。而且由准二级反应动力学模型计算和实验所获得的吸附量具有很好的一致性,其非线性χ2为0.15,远小于准一级反应动力学方程计算的134.5,这表明镉的吸附符合准二级反应动力学模型,同时说明nZVI对Cd2+的吸附是通过化学作用吸附在nZVI表面。这与许多学者用其他吸附剂对Cd2+进行吸附得到结论相似(Perez-Marin et al.,2007;Benguella et al.,2002;Soltani et al.,2009)。
3.2 3种吸附等温模型
吸附等温模型是用来判断吸附机理的最重要依据,且可获得不同的等温吸附方程和参数。本研究共应用了Freundlich、Langmuir和Temkin 3种吸附等温模型模拟纳米铁颗粒吸附Cd2+过程,通过比较其相关系数来确定哪种模型最合适。Freundlich等温吸附常数KF为33.73,n为2.4,线性相关系数r²为0.9483;而Langmuir等温曲线获得的线性相关系数r²为0.9953,表明纳米铁颗粒吸附Cd2+能够很好地符合Langmuir和Freundlich模型,且Langmuir方程比Freundlich更具有代表性。n>1被认为是L型等温吸附,表明吸附剂对被吸附物质具有很好的吸附性能,且为化学吸附。由 Langmuir方程可获得纳米铁对Cd2+最大吸附量qm为256.4 mg·g-1。这明显比文献中曾报道过许多吸附剂最大吸附量要高很多,比如活性炭(3.37 mg·g-1)(Perez-Marin et al.,2007),赤铁矿(4.94 mg·g-1)(Tan et al.,2009),小麦茎秆(11.6 mg·g-1)(Benguella et al.,2002),甲壳质(14.7 mg·g-1)(Meng et al.,2009),有机废料(48.3 mg·g-1)(Soltani et al.,2009),骨炭(64.1 mg·g-1)(An et al.,2001),垃圾灰(100.25 mg·g-1)(Qasemi et al.,2018),活性污泥(204.1 mg·g-1)(Singh et al.,1998),生物锰氧化物(229.3 mg·g-1)(Cheung et al.,2001)。
Temkin吸附模型线性曲线非常适合,相关系数主要用于判断被吸附物质与吸附剂之间是否为化学吸附。r2线性相关系数≥0.95,这进一步表明纳米铁对Cd2+吸附过程是化学吸附。
3.3 吸附机理
许多研究者就纳米铁对重金属离子去除机理已进行了较深入探讨,重金属去除机理主要取决于重金属标准电位,通常包括吸附、还原和沉淀或 2种作用机理同时存在。铁标准电势为-0.41 eV,其他重金属的标准电势一般与铁标准电势(-0.41 eV)接近或更高一些。例如,在25 ℃时,Cd2+的标准电势为-0.40 eV,这与零价铁的标准电势非常接近(-0.41 eV),所以从热力学角度认为纳米铁主要是通过化学吸附作用去除Cd2+,吸附速率受表面吸附控制(Li et al.,2006;Boparai et al.,2011)。当有溶解氧存在时,溶解氧作为强氧化剂导致铁快速发生腐蚀。纳米铁与溶液中H2O发生反应,生成亚铁离子(Fe2+)同时导致 pH 升高(Fe0+O2+2H2O→2Fe2++4OH-)(Qiao et al.,2018),有利于镉的固定。
纳米铁对 Cd2+吸附过程主要包括下面 3个步骤:(1)通过液膜扩散作用,溶液中大量被吸附的物质迁移到吸附剂表面;(2)颗粒内扩散作用,被吸附物质向吸附剂颗粒孔隙内部扩散;(3)被吸附物质在吸附剂内部活性基位置发生吸附作用。由于此吸附过程是非常快的,假设它不会影响整个反应动力学,因此,吸附过程快慢主要由液膜表面扩散或颗粒内的扩散速度所控制。根据这个模型,假如吸附过程中包含颗粒内扩散,那么qt与t0.5应该呈直线变化关系,若该直线通过原点,则表明颗粒内扩散是控制吸附过程的限速步骤;也有人认为当qt与t0.5呈多种线性关系,主要由两个或更多步骤控制整个吸附过程(Chen et al.,2009)。而本研究中qt与t0.5关系见图11,纳米铁对Cd2+的吸附呈多级线性关系,主要由3个阶段组成。起始阶段代表表面或膜扩散,第2段线性部分代表逐步吸附阶段,粒内或孔隙扩散控制了吸附速率,第3段表示最后达到吸附平衡阶段。这表明有3个过程控制了整个吸附速率,但在每个时间段都仅有一个过程控制吸附速率。粒内扩散速率ki可以通过第2段线性部分计算。第2部分截距C值大小与临界面厚度有关,截距越大表明表面扩散在控制速率方面影响越大(Kavitha et al.,2007)。

图11 纳米铁吸附Cd2+粒内扩散曲线Fig. 11 Intraparticle diffusion plots for Cd2+ adsorption on nZVI
对于金属离子在溶液和吸附剂表面运移过程中,金属离子起始浓度作为一种驱动力在克服质量传输阻力方面发挥着重要作用。然而当功能团表面吸附位达到饱和时,这也将阻止了金属离子进一步吸收(Arief et al.,2008)。
4 结论
本研究结果表明,纳米铁可作为污染水体中Cd2+有效去除的吸附剂之一。通过采用准一级和准二级动力学模型对吸附过程进行了模拟,结果表明nZVI吸附 Cd2+过程符合准二级反应动力学模型。吸附机理主要是化学吸附,膜扩散过程是吸附速度控制步骤。等温吸附过程能够很好地符合Langmuir和 Freundlich模型(R2>0.95),且 Langmuir方程比Freundlich更具有代表性,表明纳米铁对Cd2+吸附为单层覆盖,最大吸附量为 256.4 mg·g-1,吸附平衡数据也能够很好地适合 Temkin方程,进一步表明纳米铁对Cd吸附是化学吸附过程。
同时通过探讨影响纳米铁吸附 Cd2+快慢主要因素,可得出以下结论:
(1)当纳米铁投加量为 0.5—1.25 g·L-1,纳米铁投加量都与Cd2+去除率呈正相关,但当投加量达到一定值后,去除率并不再升高,考虑经济成本,纳米铁最佳投加量建议为1.00 g·L-1。
(2)在镉离子浓度为 45—92 mg·L-1范围内,镉离子的初始浓度高低将影响纳米铁对 Cd2+的去除速率,浓度越高去除速率也慢。
(3)在pH 2—7范围内,纳米铁对Cd2+吸附随pH增加而增大,当pH为近中性,吸附效果最佳。
总之,纳米铁因具有高的比表面积和高反应活性,其对水体中的镉离子有很好的去除效果,且具有用量少、成本低廉、效率高且操作简便等优点,所以纳米铁可作为水体中镉离子有效去除的吸附材料之一。
