环氧丙烷分子在非对称外场作用下的光谱特性
2019-11-28刘文彦
刘文彦,鲍 捷
(1.吉林化工学院 理学院,吉林 吉林 132022;2.吉林医药学院 生物医学工程学院,吉林 吉林 132013)
有机物在外场作用下可使其物理性能发生改变,如化学键断裂及生成新激发态等[1].环氧丙烷(CH3—C2H3O)属烷烃类,常温下CH3—C2H3O分散雾化性能较好,常用于火箭推进剂材料.文献[2-5]研究了环氧丙烷的化学反应机理;文献[6-8]理论研究了压力和湿度等条件对可燃气体在密闭容器内最小点火能的影响;文献[9-10]利用激发态理论研究了丙酮等有机小分子的低激发态光谱性质及外场作用下的分子结构特性.但对外加电场诱导作用下CH3—C2H3O分子光谱特性的理论研究目前文献报道较少,基于此,本文利用外电场模拟飞秒激光作用等外部诱导条件对CH3—C2H3O分子激发态光谱特性进行理论研究.
1 理论和计算方法
利用含时密度泛函理论(TD-DFT)方法可计算有机小分子的激发能,且在Hamilton量计算中体现了电场作用[11-12].采用密度泛函理论(DFT)方法,在不同基组水平上优化CH3—C2H3O分子几何基本构型,并在此基础上选择最佳方法.计算结果表明,由B3P86/6-311++G(2df)方法和基组优化得到的数据更理想.在Gaussian09W软件包[13]内进行计算,用GaussView5.0软件产生图形,用Origin8.6.0软件绘制线图.
2 结果与讨论
2.1 无外场作用下的分子结构及特性
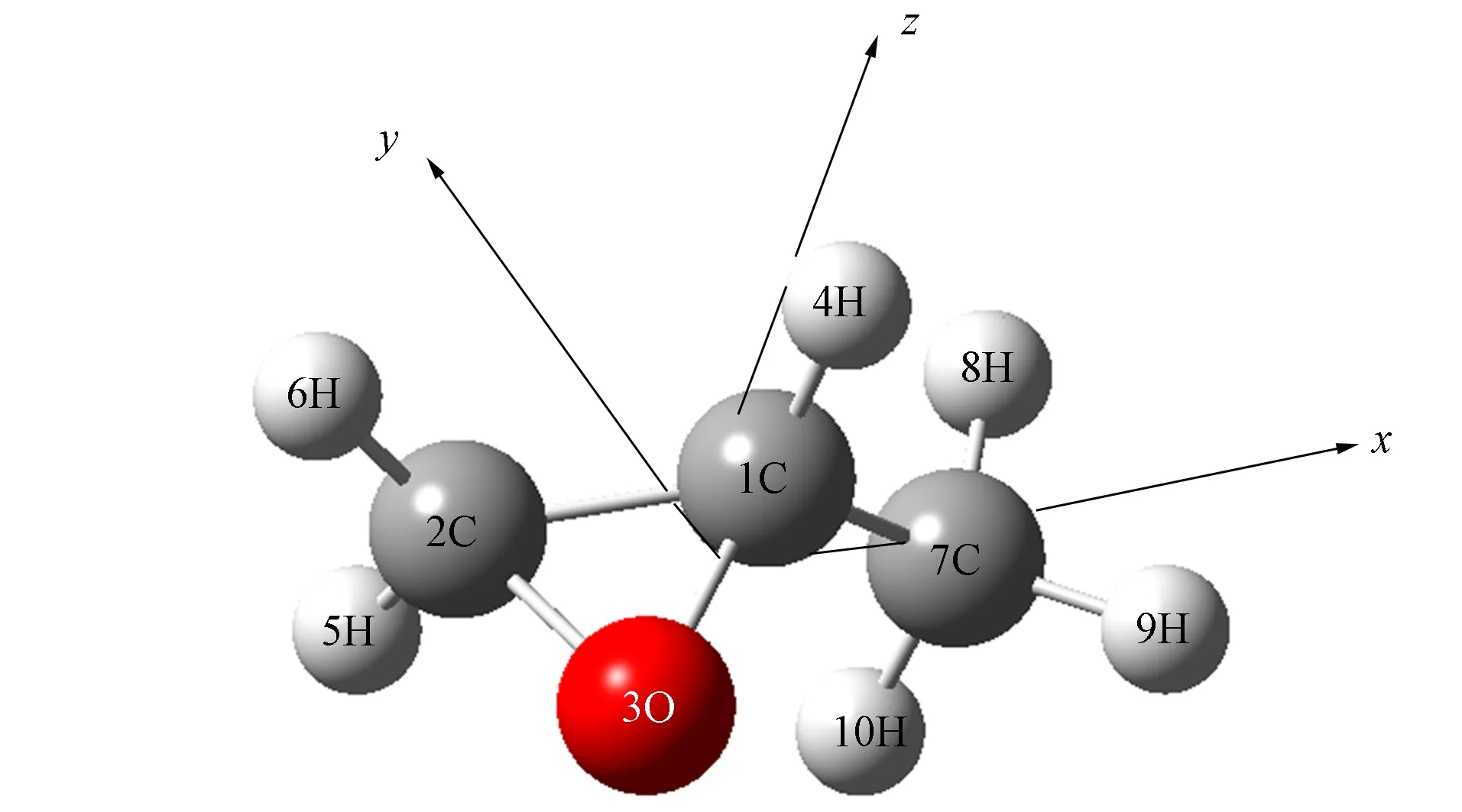
图1 CH3—C2H3O分子结构Fig.1 Structure of CH3—C2H3O molecule
无外场作用时CH3—C2H3O分子基态为稳定构型,其分子结构如图1所示.无外场作用时CH3—C2H3O分子吸收与辐射特性为CH3—C2H3O分子由基态均可跃迁至前10个激发态;基态跃迁至第3,4,7,8激发态比跃迁至第1,2,5,6,9,10激发态的振子强度大.
2.2 外电场作用下CH3—C2H3O分子吸收与辐射特性
对CH3—C2H3O分子在x轴(3O→7C)方向外电场作用下的基态构型进行优化.优化后CH3—C2H3O分子前8个低激发态的激发能、波长和振子强度等表征该分子光谱特性的计算结果分别列于表1~表3.其中S1~S8分别表示前8个激发态.

表1 CH3—C2H3O分子前8个激发态的激发能(ΔE)与电场强度F的关系

表2 CH3—C2H3O分子前8个低激发态的波长(λ)与电场强度F的关系
由表1可见: S1和S4的ΔE随F增大先增加再减小;S2和S3的ΔE随F增大而减小;S5~S8的ΔE随F增大而增加.若ΔE随外电场强度F增加而减小(如S1~S4),则表明在外电场作用下该分子体系中的电子更易被激发偏离原轨道.CH3—C2H3O分子波长与电场强度的关系如图2所示.由表2和图2可见:S1和S4的λ随F增大先减小再增加;S2和S3的λ随F增大而增加;S5~S8的λ随F增大而减小.若λ随电场强度F增大而变长(如S1~S4),则基态分子更易被激发或被解离成更小碎片化结构.在外电场作用下,CH3—C2H3O分子的电子跃迁光谱均富集于紫外光区,λ=140.96~168.46 nm.
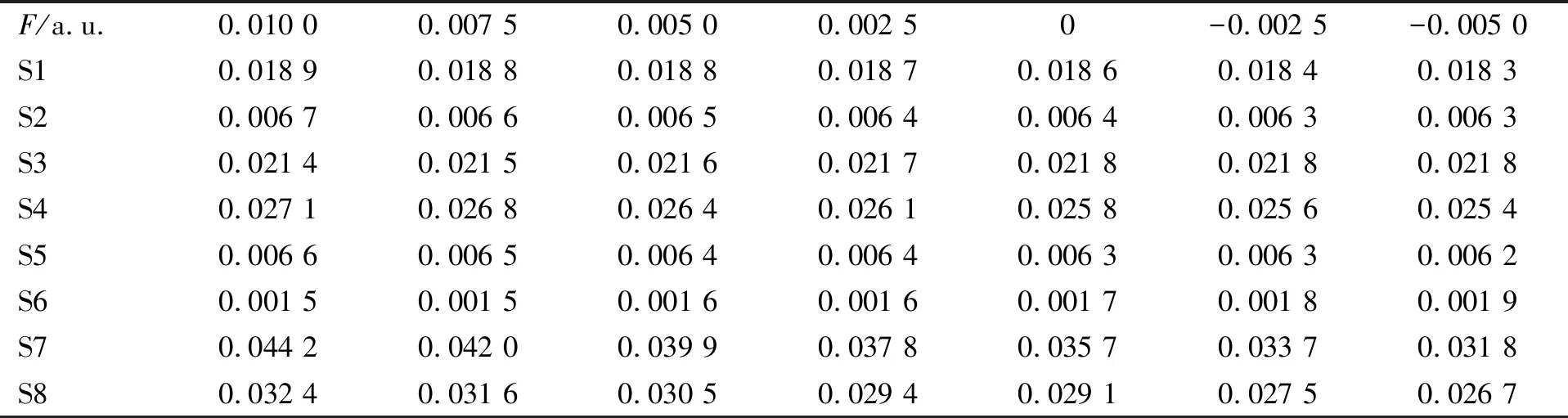
表3 CH3—C2H3O分子前8个低激发态的振子强度f与电场强度F的关系

图2 CH3—C2H3O分子波长与电场强度的关系Fig.2 Relationship between wavelengths of CH3—C2H3O molecule and electric field intensities
CH3—C2H3O分子振子强度与电场强度的关系如图3所示.由表3和图3可见:S1,S2,S4,S5,S7,S8的f随F增大而增加;S3和S6的f随F增大而减小.若f随F的增大而增加,则表明跃迁几率有增大趋势.当外电场分别为-0.002 5,-0.005 0,0.005 0和0.010 0时,CH3—C2H3O分子的紫外-可见吸收光谱如图4所示.由图4可见:随着电场强度F的变化,最右侧主峰值变化明显,当F=-0.005 0时,主峰值达到最小;最左侧标有三角峰峰值变化也较明显,当F=-0.002 5时,该峰峰值达最大.

图3 CH3—C2H3O分子振子强度与电场强度的关系Fig.3 Relationship between oscillator strengths of CH3—C2H3O molecule and electric field intensities
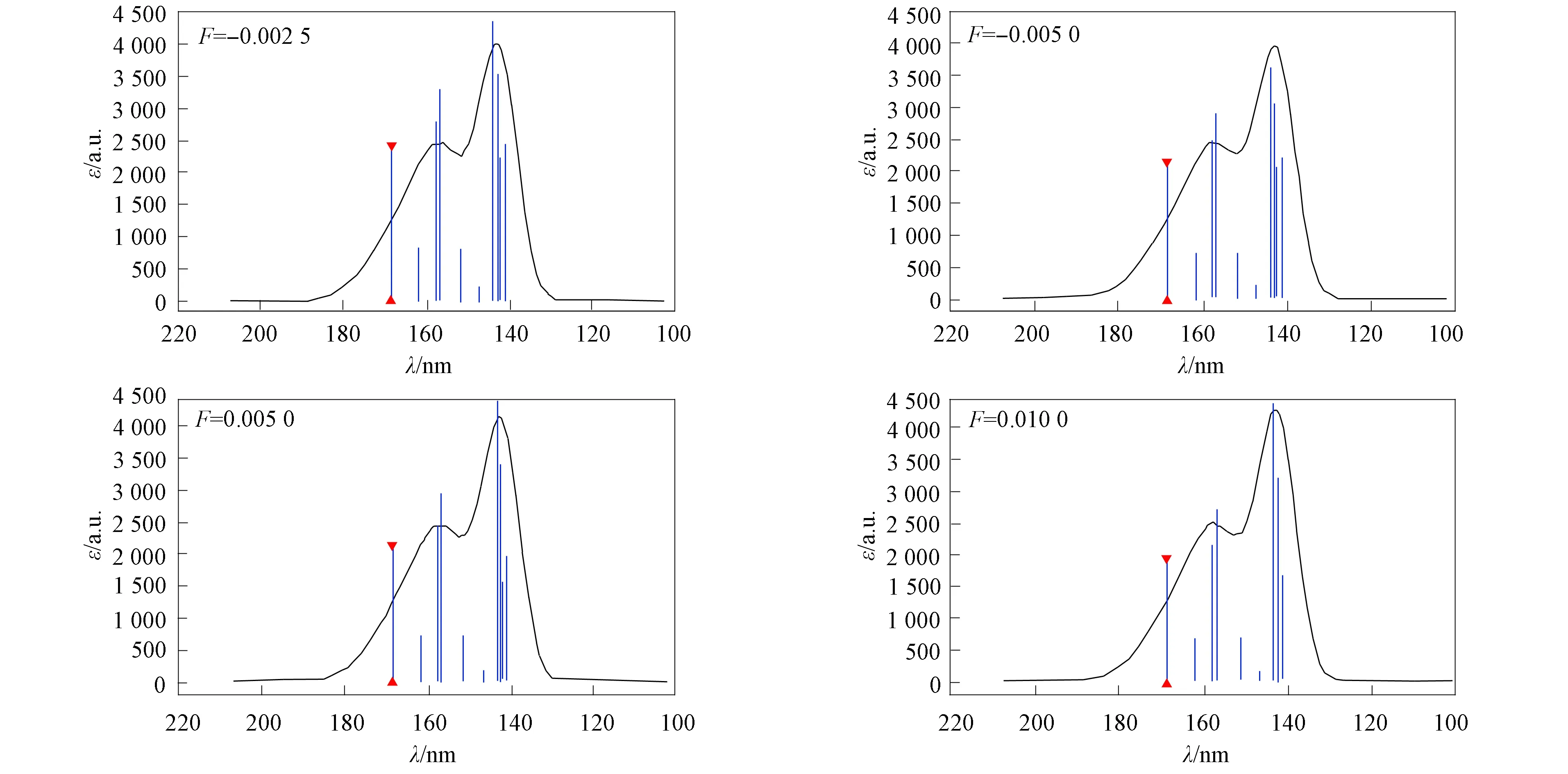
图4 CH3—C2H3O分子UV-Vis谱Fig.4 UV-Vis spectra of CH3—C2H3O molecule
2.3 电场诱导对CH3—C2H3O分子前8个激发态轨道跃迁的影响
CH3—C2H3O分子前8个激发态的电子跃迁轨道与电场强度的关系列于表4.由表4可见,电场强度不影响S1,S2,S4,S5,S6和S7激发态的电子跃迁轨道,但对其他各激发态均有影响,如第3激发态当F=0时,分子轨道电子跃迁为16→18,16→19,16→20;当F=0.002 5,-0.002 5,-0.005 0时,其对应的电子跃迁轨道均未发生变化;当F=0.005 0,0.007 5,0.010 0时,其对应的电子跃迁轨道均少了一条16→20.第8激发态当F=0时,分子轨道电子跃迁为15→18,15→19,16→21,16→22,16→24;当F=0.002 5,0.005 0,0.007 5,0.010 0时,其对应的电子跃迁轨道未发生变化;当F=-0.002 5时,其对应的电子跃迁轨道少了两条15→18,15→19;当F=-0.005 0时,其对应的电子跃迁轨道少了16→22,16→24.

表4 CH3—C2H3O分子前8个激发态的电子跃迁轨道与电场强度的关系

续表4
综上,本文可得如下结论:CH3—C2H3O分子的4个低激发态激发能均随电场强度的增加而减小,表明在外电场作用下该分子体系中的电子易被激发而偏离原轨道;波长随电场强度增大而变长,表明分子更易被激发或解离成更小的碎片化结构;在外电场作用下,CH3—C2H3O分子的电子跃迁光谱均富集于紫外光区.
