重组人源抗血管内皮生长因子单克隆抗体的制备及鉴定
2019-11-28徐雨昕龚忠阔夏霖亚殷玉和吴丛梅
董 雪,徐雨昕,郭 晶,龚忠阔,夏霖亚,殷玉和,吴丛梅
( 1.长春工业大学 化学与生命科学学院,长春 130012;2.东北农业大学 生命科学学院,哈尔滨 150030)
人源抗血管内皮生长因子(VEGF)通过与血管内皮细胞相应的受体结合,刺激血管内皮细胞的增殖和迁移,诱导形成新生血管,使肿瘤持续生长[1-4].抗VEGF单克隆抗体通过中和VEGF因子,阻断其与内皮细胞表面VEGF受体结合,从而抑制内皮细胞的增殖与迁移[5-7].因此,抗VEGF抗体成为抗肿瘤血管治疗的重要研究方向.这类新药可通过阻断微血管的形成和生长达到抑制肿瘤细胞生长或维持肿瘤处于休眠期的目的.目前VEGF抗体药物对肺癌、乳腺癌和结肠癌等血管生成具有较好的阻断作用[8],作为新药研发的主要靶标已引起人们广泛关注[9-10].
本文先获得人源化抗VEGF抗体可变区蛋白序列,通过密码子优化得到其DNA序列,再与人源抗化VEGF抗体恒定区DNA序列连接,并在其前端设计信号肽,得到多条人源化抗VEGF抗体重链轻链序列,其中一对表达量和生物效应较好,可进一步扩大培养.
1 材料与方法
1.1 材料与仪器
HEK-293,HEK-293F,C6细胞由长春工业大学细胞生物实验室保存,常规培养;pcDNA3.1+质粒由长春工业大学细胞生物实验室保存;质粒大提试剂盒(北京天根生化科技有限公司);转染试剂(美国 Polysciences公司);内切酶(大连Tokava生物技术公司);辣根过氧化物酶(HRP)兔抗人IgG(北京索莱宝公司);标准品(美国Roche公司);培养基,血清(美国Gibco公司).
酶标仪(model680型美国BIO-RAD公司);Transwell小室(美国Corning公司).
1.2 方 法
1.2.1 HEK-293F瞬时转染 HEK-293F细胞以0.8×106个/mL接种,123 mL悬浮培养.20 μg质粒与60 μg PEI室温孵育15~20 min,将其混合液混匀快速加入细胞悬液中,同时设空白对照组和pcDNA3.1+载体对照组.培养24 h可检测转染效率,分别在48,96,144 h后加入补料培养基,当细胞存活率降至约60%时,离心收取细胞上清液,纯化.
1.2.2 抗体蛋白分离纯化 pcDNA-VEGFH和pcDNA-VEGFV表达载体共同转染HEK-293F细胞,转染不同时间后细胞培养上清液经Protein A亲和层析柱纯化.细胞表达上清液样品进行离心及0.45 μm滤膜过滤.用10倍柱体积的结合缓冲液(20 mmol/L Na2HPO4,0.15 mol/L NaCl,pH=7.0)平衡层析柱,流速为1 mL/min.最后加入洗脱缓冲液(0.1 mol/L甘氨酸盐酸缓冲液,pH=2.7)洗脱.用4 mL EP管收集洗脱的样品,每管2.4 mL,每EP管内需预先加入中和缓冲液(1 mol/L Tris-HCl,pH=9.0) 600 μL,进行收集.
1.2.3 SDS-PAGE检测蛋白表达 pcDNA-VEGFH和pcDNA-VEGFV表达载体共同转染HEK-293F细胞,pCDNA3.1+质粒转染作为对照组.转染48 h后取等量细胞蛋白上清液,进行质量分数为12%的聚丙烯酰胺凝胶电泳,电泳结束后将分离胶置于考马斯亮蓝溶液中染色,染色30 min后,加脱色液脱色至背景无色,保存干胶.SDS-PAGE电泳图中蛋白通过Quantity One软件进行纯度测定.
1.2.4 细胞共培养 六孔板内接种C6细胞(3×105个/孔),同时将HEK-293细胞接种于0.45 μm的Transwell小室.C6细胞贴壁后,将pcDNA-VEGFH和pcDNA-VEGFV表达载体共同转染HEK-293细胞,转染后6 h与C6细胞共培养.同时设pCDNA3.1+质粒对照组,培养48 h后用噻唑蓝(MTT)法检测细胞增殖.
1.2.5 抗体蛋白活性检测 六孔板内接种C6细胞(3×105个/孔),细胞贴壁后,将不同质量浓度的蛋白加入细胞中,同时设标准品对照组和正常细胞组[5].培养48 h后用MTT法检测细胞增殖.
1.2.6 MTT检测细胞增殖 六孔板每孔加入MTT溶液(5 mg/mL)100 μL,于CO2培养箱中继续孵育3.5 h后终止培养.吸净孔内培养上清液,每孔加1 mL二甲基亚砜(DMSO),振荡10 min使结晶物充分溶解;用酶标仪于570 nm波长测OD值,记录结果.
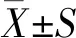
2 结果与讨论
2.1 设计并优化抗VEGF抗体重链及轻链基因序列
人源抗VEGF抗体可变区序列为已公开专利中提供的序列(专利号:EP2792687A1),在NCBI网站Ig BLAST在线工具对其进行密码子优化,用软件RNA structure 预测经密码子优化后目的基因二级结构,用SingalP3.0信号肽预测软件对轻、重链可变区信号肽进行分析,与人重链和人轻链恒定区DNA序列组装,并在5′端和3′端分别设计NheⅠ和EcoRⅠ酶切位点,得到抗VEGF抗体重链和轻链各一条.基因由北京君诺德生物技术有限公司合成.其蛋白序列及基因序列为

重链蛋白: MYRIQLLSCIALSLALVTNSEVQLVESGGGLVQPGGSLRLSCAASGFSINGSWIFWVRQAPGKGLEWVGAIWPFGGYTHYADSVKGRFTISADTSKNTAYLQMNSLRAEDTAVYYCARWGHSTSPWAMDYWGQGTLVASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK;

重链DNA: ATGTACCGGATCCAGCTGCTGTCCTGCATCGCCCTGAGCCTGGCCCTGGTGACCAACAGCGAGGTGCAGCTGGTGGAGAGCGGGGGGGGACTGGTGCAGCCTGGAGGAAGCCTGAGACTGAGCTGCGCCGCCTCTGGCTTTTCTATCAATGGCTCCTGGATTTTCTGGGTGAGGCAGGCCCCCGGAAAGGGGCTGGAGTGGGTGGGAGCTATTTGGCCCTTTGGGGGATACACCCATTACGCCGACAGTGTCAAGGGCAGGTTCACCATTTCTGCCGACACCAGCAAGAACACAGCCTACCTGCAGATGAACAGCCTGAGGGCCGAGGACACCGCCGTGTACTACTGCGCCAGATGGGGACACAGCACAAGCCCTTGGGCCATGGACTACTGGGGACAAGGAACACTGGTGGCCAGCACCAAAGGCCCAAGCGTGTTCCCCCTGGCCCCCTCTTCTAAGAGCACCAGCGGAGGTACAGCCGCCCTGGGATGCCTGGTGAAGGACTACTTCCCCGAGCCTGTGACCGTGTCCTGGAACAGCGGAGCCCTGACCTCCGGCGTGCACACCTTCCCCGCCGTGCTGCAGAGTTCTGGCCTGTATTCTCTGTCCTCCGTGGTGACCGTGCCCTCCAGCAGCCTGGGCACTCAGACTTACATCTGTAACGTGAACCACAAACCTTCCAACACCAAGGTGGATAAGAAGGTGGAGCCCAAGAGCTGCGACAAGACCCATACCTGCCCCCCCTGCCCCGCCCCTGAACTGCTGGGAGGACCCAGCGTGTTCCTGTTCCCCCCCAAGCCCAAGGACACCCTGATGATCTCCCGTACCCCCGAAGTGACCTGCGTGGTCGTGGACGTCTCCCACGAAGATCCCGAAGTGAAATTCAACTGGTACGTCGACGGCGTTGAAGTCCACAACGCCAAAACCAAACCCCGCGAGGAGCAATACAACAGCACCTACAGAGTGGTGAGCGTGCTGACCGTGCTGCACCAGGACTGGCTCAACGGGAAGGAGTACAAATGTAAGGTGAGCAACAAGGCACTGCCCGCCCCTATAGAGAAAACCATCAGCAAAGCCAAGGGACAGCCCAGAGAACCCCAAGTGTACACACTGCCCCCCAGCAGAGACGAACTGACCAAGAACCAGGTGAGCCTCACCTGCCTCGTGAAAGGATTCTACCCCAGCGACATCGCCGTGGAATGGGAGAGCAACGGCCAACCCGAGAACAACTACAAAACCACCCCTCCCGTGCTGGACAGCGACGGCAGCTTCTTCCTGTACAGCAAACTCACCGTCGACAAGAGCAGGTGGCAGCAGGGCAACGTGTTCAGCTGCAGCGTGATGCACGAGGCCCTGCACAACCATTACACCCAGAAGAGCCTGAGCCTGTCTCCCGGCAAGTACTGA;

轻链蛋白: MYRIQLLSCIALSLALVTNSDIQMTQSPSSLSASVGDRVTITCRASQVIRRSLAWYQQKPGKAPKLLIYAASNLASGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSNTSPLTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC;

轻链DNA: ATGTACCGGATCCAGCTGCTGTCCTGCATCGCCCTGAGCCTGGCCCTGGTGACCAACAGCGACATCCAGATGACCCAGAGCCCCTCCTCCCTGAGCGCCTCCGTGGGAGACAGAGTGACCATCACCTGCAGAGCCTCCCAGGTTATCAGAAGAAGCCTGGCCTGGTACCAGCAAAAGCCCGGCAAAGCCCCCAAGCTGCTCATCTACGCCGCCTCAAACCTGGCCAGCGGAGTGCCCAGCAGATTCAGCGGCAGCGGAAGCGGCACAGACTTCACCCTCACCATCTCCAGCCTGCAGCCTGAGGATTTCGCCACCTACTACTGCCAGCAATCCAACACCAGCCCCCTGACCTTCGGACAGGGCACCAAAGTCGAAATCAAGAGAACCGTCGCCGCCCCCTCCGTGTTCATCTTCCCCCCCTCCGACGAACAACTGAAGAGCGGCACCGCCAGCGTCGTGTGCCTGCTCAACAACTTCTACCCCAGAGAAGCCAAGGTGCAGTGGAAGGTTGATAACGCCCTGCAGAGCGGCAACTCCCAGGAGAGCGTGACCGAACAGGATAGCAAGGACTCTACCTACTCTCTCAGCAGCACCCTGACCCTGAGCAAGGCCGATTACGAGAAGCACAAGGTGTACGCCTGCGAGGTCACACACCAAGGCCTGAGCAGCCCCGTCACCAAAAGCTTCAACCGCGGCGAGTGCTACTGA.
2.2 构建表达载体
将重链、轻链基因分别连接进入pcDNA3.1+表达载体NheⅠ和EcoRⅠ位点,构建成pcDNA-VEGFH和pcDNA-VEGFV表达载体.表达载体鉴定结果如图1所示.由图1可见: pcDNA-VEGFH表达载体分别用NheⅠ+EcoRⅠ和BamHⅠ+EcoRⅠ双酶切,有约700 bp目的条带;pcDNA-VEGFV表达载体分别用NheⅠ+EcoRⅠ和BamHⅠ+EcoRⅠ双酶切,有约250 bp目的条带.结果表明,表达载体构建正确.
2.3 VEGF抗体大量表达特性
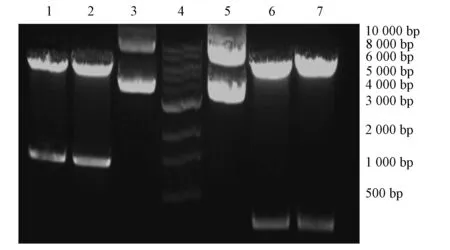
将pcDNA-VEGFH和pcDNA-VEGFV表达载体共转染HEK-293F细胞,用SDS-PAGE方法检测不同时间蛋白表达水平,结果如图2所示.由图2可见,50 000,25 000附近可见明显的蛋白表达带,转染后24~144 h均有重链和轻链蛋白表达.
1:pcDNA-VEGFH/NheⅠ+EcoRⅠ;2:pcDNA-VEGFH/BamHⅠ+EcoRⅠ;3:pcDNA-VEGFH;4:DL10000;5:pcDNA-VEGFV;6:pcDNA-VEGFV/NheⅠ+EcoRⅠ;7:pcDNA-VEGFH/BamHⅠ+EcoRⅠ.图1 pcDNA-VEGFH和pcDNA-VEGFV表达载体酶切鉴定Fig.1 Identification of pcDNA-VEGFH and pcDNA-VEGFV expression vectors
1: Marker;2.对照组;3~8: 分别转染24,48,72,96,120,144 h.图2 pcDNA-VEGFH和pcDNA-VEGFV共转染 HEK-293F细胞上清液蛋白表达Fig.2 Protein expression of HEK-293F cells transfected with pcDNA-VEGFH and pcDNA-VEGFV in cell culture supernate
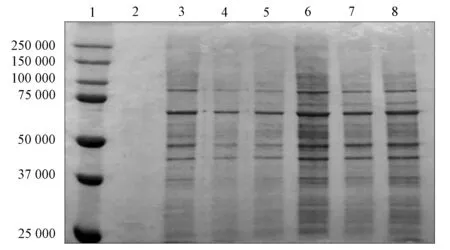
图3 共培养对C6细胞增殖的影响Fig.3 Effect of co-cultured on proliferation of C6 cells
2.4 重组基因表达产物活性检测
将pcDNA-VEGFH和pcDNA-VEGFV表达载体共转染HEK-293细胞后,与C6细胞共培养.用MTT法检测C6细胞的增殖特性,结果如图3所示.由图3可见,pcDNA-VEGFH和pcDNA-VEGFV表达载体共转染HEK-293细胞并与C6细胞共培养,可显著抑制C6细胞增殖(P<0.01).
2.5 VEGF抗体分离纯化及检测
将pcDNA-VEGFH和pcDNA-VEGFV表达载体共转染HEK-293F细胞,转染后培养96 h,提取上清液,用Protein A亲和层析柱纯化方法纯化.SDS-PAGE检测蛋白纯化结果如图4所示.由图4可见,洗脱后的抗体分别在50 000,25 000附近得到明显蛋白表达带,与抗体轻链和重链分子量相符,在流川处无目的条带,表明纯度较高.用Protein A亲和层析柱纯化抗VEGF抗体,以VEGF165蛋白为抗原,以纯化的抗VEGF抗体为一抗,并以标准品作为对照,进行Western-blot检测,结果如图5所示.由图5可见,所得抗体与标准品一致.

1: Marker;2: 标准品;3: 原样;4: 流川;5: 洗脱1;6: 洗脱2.图4 SDS-PAGE检测纯化蛋白Fig.4 Detection of purified protein by SDS-PAGE
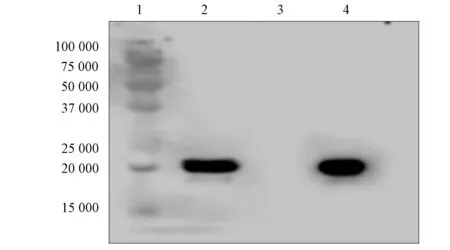
1: Marker;2: VEGF抗体蛋白;3: 空白对照;4: 标准品.图5 Western-blot检测纯化蛋白Fig.5 Detection of purified protein by Western-blot
2.6 VEGF抗体生物活性检测
将分离纯化获得的抗体以不同质量浓度加入C6细胞中,48 h后用MTT法检测细胞增殖,结果如图6所示.由图6可见: 不同剂量抗体蛋白对C6细胞增殖均有抑制作用,2~20 μg/mL组抑制作用明显(P<0.05~0.01);相同剂量的抑制效果与标准品(10 μg/mL)相近.

图6 不同质量浓度抗体对C6细胞增殖的影响Fig.6 Effect of different mass concentrations of antibodies on proliferation of C6 cells
综上,本文首先获得人源抗VEGF抗体可变区序列,利用NCBI在线平台及相关数据库进行密码子优化,并与信号肽[11-13]、人重链和人轻链恒定区DNA序列组装,得到了多条抗VEGF抗体重链和轻链[14-16],其中一对表达效果较好;其次,其用PEI介导的瞬时转染到HEK-293细胞表达合成抗体蛋白[17-19],结果表明,质量浓度为2~20 μg/mL的抗体均可明显抑制C6细胞增殖(P<0.05~0.01).标准品与相同剂量实验组的结果相似.
