乳腺癌术前空芯针穿刺活检与手术标本检测Ki-67表达的差异及影响因素
2019-11-28张永辉付芬芬张冬洁谢凌铎褚福涛王芹芹解云涛
张 春 禹 雪 张永辉 付芬芬 张冬洁 谢凌铎 褚福涛 栗 辰 王芹芹 徐 硕 解云涛
(北京大学国际医院乳腺外科,北京 102206)
超声引导空芯针穿刺活检(core needle biopsy,CNB)是乳腺癌新辅助治疗前获取乳腺癌病灶雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)、增殖细胞相关的核抗原Ki-67表达情况的主要方法[1],根据分子标记物的表达确定乳腺癌分子分型,从而选择进一步的系统治疗方案。乳腺癌Ki-67表达指数反映肿瘤细胞增殖活性,治疗前Ki-67表达水平可预测病灶对新辅助内分泌治疗及新辅助化疗的敏感性,治疗后水平降低者可获得更好的预后[2~4]。因此,CNB检测Ki-67表达的准确性至关重要。以往对CNB检测Ki-67表达准确性的研究结果存在较大差异。本研究选取我科2016年9月~2018年12月CNB病理为浸润性乳腺癌99例103个病灶,与手术切除的病理结果进行对比,分析CNB在检测乳腺癌Ki-67中的准确性。
1 临床资料与方法
1.1 一般资料
本组99例,均为女性,平均年龄54岁(25~88岁)。共103个病灶(1例为同侧3个病灶,2例为同侧2个病灶),乳腺超声提示病灶最大径中位数1.7 cm(0.6~6.3 cm),其中0.6~0.9 cm 10个,1.0~1.9 cm 50个,2.0~2.9 cm 26个,3.0~3.9 cm 11个,4.0~4.9 cm 2个,≥5 cm 4个。经CNB诊断为浸润性乳腺癌,未经任何新辅助治疗,间隔7~43 d(中位时间20 d)行手术治疗,包括乳腺癌保乳术59例,乳腺癌保乳术+腋窝淋巴结清扫术6例,乳腺癌全乳切除术26例(多病灶的3例均行乳腺癌全乳切除术),乳腺癌改良根治术3例,保留乳头乳晕皮下腺体切除+一期假体植入5例。术后病理,浸润性导管癌82个,浸润性小叶癌4个,黏液癌7个,浸润性微乳头状癌2个,小管癌1个,混合类型癌7个。
1.2 方法
1.2.1 CNB操作方法 仰卧位,病变侧上肢上举过头。常规消毒铺巾,2%利多卡因局部浸润麻醉。采用14G巴德穿刺活检枪进行穿刺活检,每个病灶向不同方向至少穿刺3针。为确保穿刺的准确性,要求保持活检枪位置,将超声探头先后平行和垂直于穿刺枪平面放置,2名乳腺外科医生核实穿刺枪穿过肿瘤,锁定屏幕,图像截屏保存。穿刺活检组织经10%甲醛液固定后送石蜡病理检查。
1.2.2 穿刺及手术病理结果分析 从CNB和手术切除的组织获得样本,通过免疫组织化学染色(En Vision法),试剂盒购自北京中杉金桥生物技术有限公司,操作按试剂盒说明进行。Ki-67表达指数为细胞核染色阳性的肿瘤细胞所占百分比。根据2011年乳腺癌Ki-67国际工作组推荐的检测标准[5],先评估整个切片的细胞分布,若肿瘤细胞中阳性细胞分布均匀,则随机选取≥3个癌细胞视野计数,计算平均Ki-67表达指数;若肿瘤细胞中阳性细胞分布不均匀,出现明显的Ki-67表达指数高表达区域(热点区),则选取视野时应包括热点区域在内的≥3个肿瘤细胞视野进行计数,计算平均Ki-67表达指数。每张切片至少计数500个肿瘤细胞。根据2011年St.Gallen乳腺癌共识[6],Ki-67<14%为低表达,≥14%为高表达。所有标本的病理诊断均通过2名乳腺专科病理医生复核,进行质量控制。

2 结果
CNB均顺利完成,未出现血肿、感染、气胸等并发症,穿刺点伤口愈合好。CNB与手术切除标本Ki-67表达指数的中位数分别为15%(2%~60%)、20%(1%~60%),CNB标本Ki-67指数低于手术切除标本(配对秩和检验,Z=-2.986,P=0.003)。
CNB标本中,Ki-67低表达病灶50个(48.5%),高表达病灶53个(51.5%);手术切除标本中Ki-67低表达病灶38个(36.9%),高表达病灶65个(63.1%),手术切除标本Ki-67高表达病灶增加,两者诊断一致率仅为74.8%(77/103),κ=0.491,一致性较差(表1)。

表1 穿刺及手术标本Ki-67表达状态比较
根据手术切除标本Ki-67表达指数与CNB标本Ki-67表达指数的差值进行分组,差值>0为手术切除标本Ki-67表达指数增高组(n=44),差值≤0为未增高组(n=59)。单因素分析结果显示,CNB距离手术的时间间隔、肿瘤PR表达状态在2组间差异具有统计学意义(P<0.05),2组年龄、肿瘤最大径、手术类型、术后病理类型、淋巴结转移、ER、HER2差异无显著性,见表2。
将单因素分析中有统计学差异的因素(PR表达状态、时间间隔)作为自变量,以手术切除标本Ki-67表达增高为因变量,进行logistic回归分析,结果表明CNB与手术时间间隔长是手术切除标本Ki-67表达增高的独立影响因素(OR=1.090,95%CI: 1.023~1.162,P=0.008),见表3。
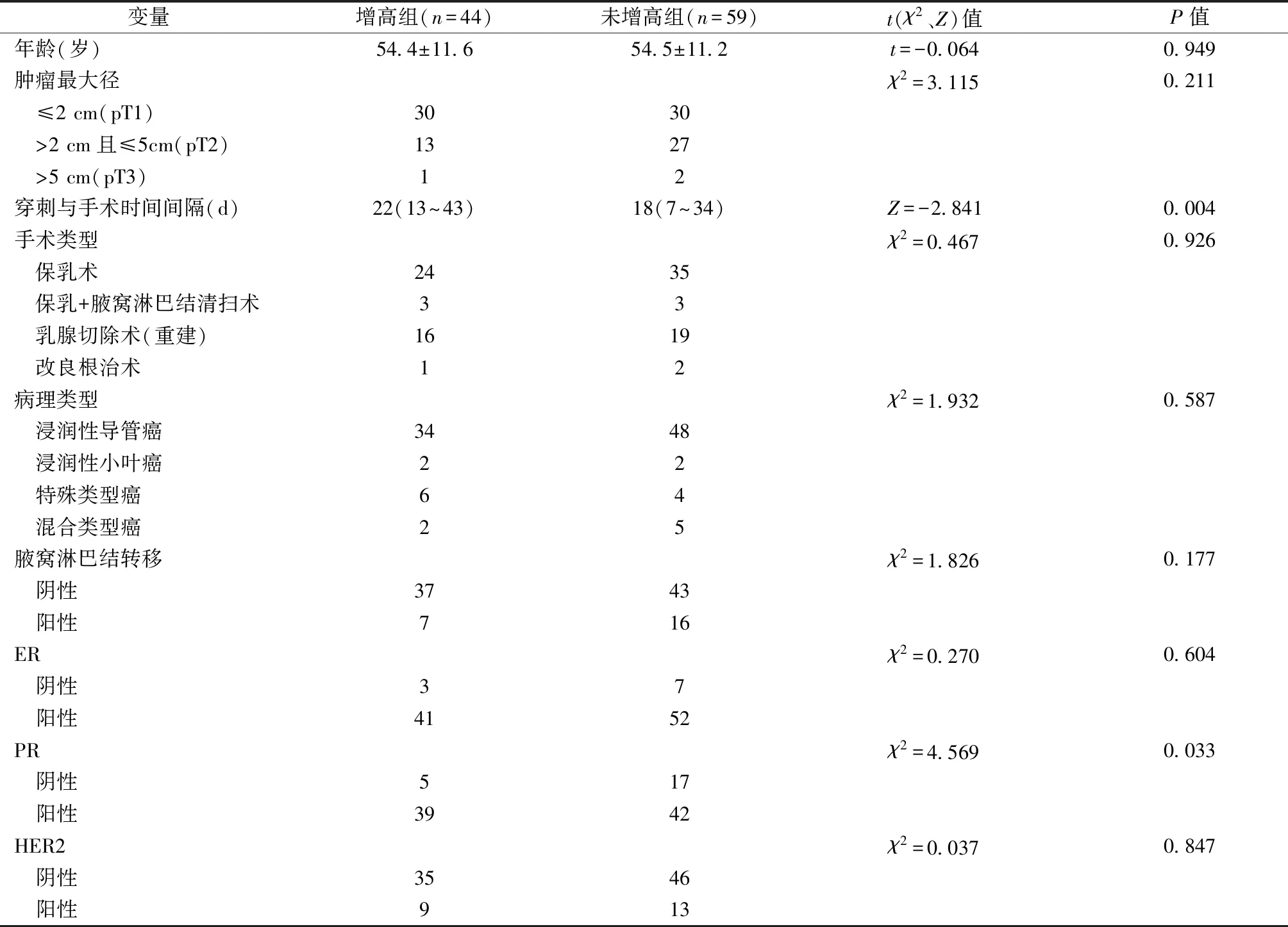
表2 手术切除标本Ki-67表达指数增高的单因素分析

表3 手术切除标本Ki-67表达增高的多因素分析
以CNB距离手术的时间间隔进行分组,将时间间隔<20 d为短时间间隔组(20 d是50例CNB病理Ki-67<14%的时间间隔的中位数),≥20 d为长时间间隔组,分析时间间隔对CNB病理为Ki-67低表达病灶的影响,结果2组术后高表达病灶分别为24%(6/25)、52%(13/25)。随着时间间隔的延长,Ki-67术后高表达比例增加,见表4。

表4 时间间隔对CNB病理为Ki-67低表达病灶的影响
3 讨论
Ki-67为增殖细胞表达的核抗原,表达指数高者肿瘤细胞的增殖速率快,其表达指数是区分乳腺癌激素受体阳性,HER-2阴性的Luminal A型与Luminal B型的重要指标。Luminal A型为Ki-67低表达(<14%),此类患者仅需内分泌治疗,很少从化疗中获益;后者为Ki-67高表达(≥14%),需要内分泌治疗,并考虑化疗[6]。meta分析表明[7],Ki-67高表达者更容易从新辅助化疗中获益,可获得更高的病理完全缓解。因此,Ki-67的准确检测对选择新辅助治疗具有重要作用。
CNB是微创组织活检方法,创伤小,时间短,并且可以提供恶性肿瘤生物标记物表达特征的信息,广泛应用于临床诊疗[8]。乳腺癌Ki-67国际工作组[5]建议CNB和手术标本均可用于Ki-67表达指数的评估,但目前的研究结果认为,两者对于Ki-67的检测存在差异[9~11]。Soomin等[12]的研究表明,穿刺活检的组织标本Ki-67表达指数显著高于手术标本(P<0.001),中位数分别为21%、17%,均值分别为26%、22%,此89例乳腺癌病灶中,Ki-67穿刺高表达而手术低表达者13例,穿刺低表达而手术高表达者3例。然而陈圣等[13]的研究分析188例穿刺与手术标本的Ki-67表达情况,Ki-67检测差异降低了乳腺癌分子分型的一致率,Ki-67的表达在手术标本中较CNB中升高,两者表达的一致性差(κ=0.149),一致率为73.4%(138/188)。本研究中,手术病理Ki-67表达指数较穿刺标本明显增高,50个穿刺为Ki-67低表达的病灶中19个(38%)术后病理显示为高表达,53个CNB标本为Ki-67高表达的病灶中7个(13.2%)术后病理为低表达,一致率为74.8%(77/103),与陈圣等的研究结果相近。
多数学者认为[9, 13],导致穿刺与手术病理Ki-67表达指数差异的主要原因为肿瘤细胞的异质性。乳腺癌肿瘤周边组织往往具有更强的侵袭性,热点区域通常位于肿瘤的外围[12]。相对于手术标本,穿刺活检取到的组织多从肿瘤的中央部分获得,获得肿瘤周边部分的细胞量少,因此导致术后Ki-67表达指数升高。此外,肿瘤本身的特征可能影响穿刺的准确性。Kim等[14]认为,肿瘤直径>1 cm、PR阴性、肿瘤组织学分级为Ⅲ级、年龄<35岁为两者检测不一致的影响因素。Chen等[15]的研究中,手术标本与穿刺标本Ki-67表达指数的均数分别29.1%、26.3%,穿刺与手术的时间间隔可影响术后Ki-67的表达:间隔1~2 d,Ki-67增高1.1%;间隔3~4 d,Ki-67增高2.1%;间隔>4 d,Ki-67增高5.6%。本研究中,时间间隔延长是术后Ki-67表达增高的独立影响因素(OR=1.090,95%CI:1.023~1.162),推测在等待手术的过程中,病灶本身可能发生了某些变化。Mathenge等[16]在乳腺癌小鼠模型中验证了这一想法,对CNB后将肿瘤完整切除与未行CNB直接行肿瘤切除进行比较,前者CD4+、CD8+T细胞和巨噬细胞减少,循环肿瘤细胞水平上升,肺转移例数增加,说明CNB可能引起肿瘤自身及肿瘤微环境向恶性程度提高的方向转变。此外,王崇杰等[17]对离体标本进行即刻穿刺取材,模拟术前CNB,并将穿刺结果与手术病理结果进行对比,观察到Ki-67表达指数差异无统计学意义,因此认为导致差异的原因可能是肿瘤在CNB后自身状态发生改变,而并非CNB结果不准确。
本研究的不足之处是穿刺距离手术的时间间隔较长,病灶是否在此段时间内进展,导致穿刺与手术标本的差异尚未明确,这也将是今后的研究方向。
综上,CNB与手术标本检测Ki-67表达指数存在差异,术后Ki-67表达指数高于CNB,临床工作中应注意这种差异。穿刺距离手术的时间间隔延长是术后Ki-67表达指数增高的独立影响因素,随着时间间隔的延长,术后Ki-67高表达病灶增加。
