他克莫司对人角质形成细胞蛋白酶活化受体2表达及功能的影响
2019-11-28王上上倪春雅邹颖李巍徐金华
王上上 倪春雅 邹颖 李巍 徐金华
复旦大学附属华山医院皮肤科,上海 200040
蛋白酶活化受体2(protease activated receptor 2,PAR-2)广泛分布于人体内各组织和细胞,可被多种内外源性丝氨酸蛋白酶激活,产生多种生物效应。PAR-2 在皮肤组织尤其是炎症性皮损的多种细胞(包括角质形成细胞、真皮血管内皮细胞、免疫细胞等)中均有显著表达,提示其可能参与皮肤炎症和免疫反应[1]。他克莫司是一种大环内酯类免疫抑制剂,其外用制剂已广泛应用于皮肤科各个领域,并且发现外用他克莫司可降低银屑病及特应性皮炎患者皮损中PAR-2 的表达[2-3],但其对人角质形成细胞PAR-2 表达及功能的影响目前尚缺乏体外实验证实。我们应用不同浓度他克莫司与人角质形成细胞共培养,观察PAR-2 mRNA和蛋白表达的变化及其对PAR-2 激动剂所引起的钙离子动员的影响。
材料与方法
一、材料
人角质形成细胞来源于华山医院泌尿外科21例16 ~30岁男性包皮环切术后组织,该研究已通过复旦大学附属华山医院伦理委员会批准(批件号2017-400),取材前患者或家属均签署知情同意书。二氧化碳培养箱(美国Thermo Fisher Scientific 公司),激光扫描共聚焦显微镜(日本Olympus公司),腔室玻片系统(美国Thermo Fisher Scientific公司),凝胶成像系统(美国Bio-Rad公司);DMEM培养基、胎牛血清产自美国HyClone 公司,反转录试剂盒、实时荧光定量PCR 试剂盒产自日本Takara 公司;PAR-2、甘油醛-3-磷酸脱氢酶(GAPDH)引物由生工生物工程(上海)股份有限公司合成;Trizol、Fluo-4钙检测试剂盒产自美国Invitrogen 公司,他克莫司冻干粉(分析纯,纯度99.9%)、胰蛋白酶产自美国Sigma 公司,鼠抗人PAR-2 单克隆抗体(PAR-2msIgG)、山羊抗小鼠IgG 产自美国Santa Cruz公司。
二、方法
1.细胞培养及处理:采用胰蛋白酶消化法分离表皮,在37 ℃、5%CO2条件下用含10%胎牛血清的DMEM培养基培养人角质形成细胞,以每孔105个细胞接种于无菌有盖24孔板。细胞生长达70%融合时给予无血清DMEM培养基同步化24 h,更换为含10%胎牛血清的DMEM培养基,加入不同浓度(分别为10-9、10-8、10-7、10-6、10-5mol/L,用二甲基亚砜稀释)他克莫司共培养,以未加他克莫司组作为对照组,继续培养24 h后收集细胞,进行后续实验。
2.半定量反转录-聚合酶链反应(RT-PCR)检测人角质形成细胞PAR-2 mRNA 的表达:Trizol 法提取经上述处理的人角质形成细胞RNA,逆转录合成cDNA,取cDNA行PCR反应。设计引物序列,PAR-2 上游引物 5′-GGCACCATCCAAGGAACCA-3′,下游引物 5′-CTGTTTCAACTGTAACTCCTTTTC CA-3′;GAPDH 上游引物 5′-CCACTCCTCCACCTTT GAC-3′,下游引物5′-ACCCTGTTGCTGTAGCCA-3′。PCR 反应体系 25 μl,反应条件为 94 ℃变性 30 s,60 ℃退火30 s,72 ℃延伸40 s,共40 个循环。反应结束后,取5 μl PCR产物,琼脂糖凝胶电泳,溴化乙锭显色,拍照,ImageJ 软件分析目的基因片段的灰度值与相应GAPDH 灰度值,以其比值表示PAR-2 mRNA表达水平。
3.Western印迹检测人角质形成细胞PAR-2蛋白的表达:使用蛋白裂解液将经上述处理的人角质形成细胞裂解后收集上清液,用BCA 法定量,调整蛋白浓度。应用半干转法转膜,使用0.45 μm孔径聚偏氟乙烯膜,恒流200 mA转膜1.5 h,转膜后用丽春红染色试剂对膜染色;加针对PAR-2的鼠抗人抗体,4 ℃孵育过夜后,加辣根过氧化物酶标记山羊抗鼠IgG 室温孵育1 h,ECL 发光法检测反应条带。以β肌动蛋白为内参,凝胶成像系统观察拍摄电泳凝胶成像照片,ImageJ 软件分析蛋白条带的灰度值,以目的蛋白与β肌动蛋白的灰度比值表示蛋白表达水平。
4.免疫荧光检测人角质形成细胞PAR-2 的表达:24 孔板内铺圆形盖玻片,接种人角质形成细胞,生长融合达50%时,无血清培养24 h,与不同浓度(0、10-9、10-8、10-7、10-6、10-5mol/L)他克莫司分别共培养24 h 后弃培养基,制备细胞爬片,加入一抗PAR-2 msIgG孵育,4 ℃过夜,加入二抗异硫氰酸荧光素标记山羊抗小鼠IgG 孵育,冲洗后用4′,6-二脒基-2-苯基吲哚封片剂封片,激光扫描共聚焦显微镜观察PAR-2的表达,每标本取5个独立高倍视野测量PAR-2的平均吸光度(A值),取均值。
5.Fluo-4 检测他克莫司对PAR-2 激动剂引起的人角质形成细胞内钙离子动员的影响:将人角质形成细胞接种于腔室玻片系统,生长融合达50%时,无血清培养24 h,与不同浓度(0、10-9、10-8、10-7、10-6、10-5mol/L)他克莫司分别共培养24 h;每孔加入含Fluo-4 的染色液,37 ℃孵育30 min,室温孵育30 min。激光扫描共聚焦显微镜下观察,选择488 nm氩激光为激发波长,设定各项参数,记录背景荧光;加入PAR-2激动剂胰蛋白酶,激光扫描共聚焦显微镜下动态扫描细胞内荧光强度变化,每5 秒记录1次,测量100 s,Olympus Fluoview 系统软件记录和数据化细胞的荧光强度图像和曲线。
6.数据处理和统计分析:采用SPSS 14 统计软件,方差齐性检验后,采用单因素方差分析比较组间人角质形成细胞PAR-2表达和细胞内钙离子浓度,不同组别与对照组间比较采用LSD-t检验。P<0.05认为差异有统计学意义。
结 果
一、PAR-2在人角质形成细胞中的表达
免疫荧光染色显示,PAR-2在人角质形成细胞中呈中低水平表达,位于细胞膜和细胞质,呈颗粒状均质分布(图1)。
二、他克莫司对人角质形成细胞PAR-2 mRNA表达的影响
半定量RT-PCR 检测显示,各浓度他克莫司组与对照组间PAR-2 mRNA 表达水平差异有统计学意义(F= 18.99,P< 0.001);与对照组相比,10-9、10-8、10-7、10-6、10-5mol/L 他克莫司组表达水平均显著下降(t值分别为2.93、3.28、4.41、4.85、10.48,P<0.05 或 0.01)。PAR-2 mRNA 表达水平与他克莫司浓度呈负相关(r=-0.962,P=0.009)。见图2。
三、他克莫司对人角质形成细胞PAR-2蛋白表达的影响
Western印迹检测显示,共培养24 h后,各浓度他克莫司组人角质形成细胞与对照组间PAR-2 蛋白表达水平差异有统计学意义(F= 5.672,P=0.001)。与对照组相比,10-5和10-6mol/L他克莫司组PAR-2蛋白水平显著下降,t值分别为3.149、3.255,P值分别为0.014、0.012,而10-9、10-8、10-7mol/L他克莫司组下降不显著(t值分别为0.518、0.907、0.499,P值分别为0.618、0.391、0.631)。见图3。
免疫荧光法分析结果显示,人角质形成细胞与不同浓度他克莫司共培养24 h后,各组间PAR-2蛋白的表达差异有统计学意义(F= 2.851,P=0.037)。与对照组比较,10-5、10-6和10-7mol/L 他克莫司组PAR-2 表达水平显著下降(t值分别为3.217、2.542、2.587,P值 分 别 为 0.012、0.035、0.032),10-9和 10-8mol/L 他克莫司组无明显变化(t值分别为0.870、1.647,P值分别为0.409、0.138)。见图4。

图1 免疫荧光检测人角质形成细胞蛋白酶活化受体2(PAR-2)表达 PAR-2 表达于胞膜和胞质,呈颗粒状均质分布(× 600)DAPI:4′,6-二脒基-2-苯基吲哚

图2 半定量RT-PCR检测人角质形成细胞蛋白酶活化受体2(PAR-2)mRNA的表达 2A: RT-PCR产物电泳结果;2B:各组PAR-2 mRNA相对表达水平统计比较。M:DNA标准参照物;1:对照组;2 ~ 6:分别为10-9、10-8、10-7、10-6、10-5mol/L他克莫司组。与对照组比较,a:P < 0.05,b:P < 0.01,c:P < 0.001

图3 Western印迹检测人角质形成细胞蛋白酶活化受体2(PAR-2)蛋白表达 3A:Western印迹图谱;3B:各组PAR-2相对表达水平统计比较。1:对照组;2 ~ 6:分别为10-9、10-8、10-7、10-6、10-5 mol/L他克莫司组。与对照组比较,a:P < 0.05
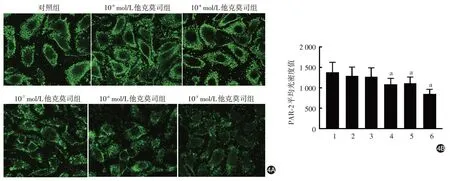
图4 免疫荧光半定量检测人角质形成细胞蛋白酶活化受体2(PAR-2)的表达 4A:免疫荧光染色图(×400);4B:各组PAR-2平均光密度值比较。1:对照组;2 ~ 6:分别为10-9、10-8、10-7、10-6、10-5 mol/L他克莫司组。a:与对照组(未加他克莫司组)比较,P < 0.05
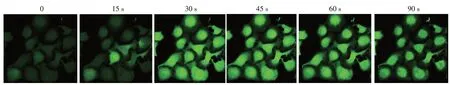
图5 胰蛋白酶刺激后人角质形成细胞内钙离子动员情况 激光扫描共聚焦显微镜(×400)下观察发现,加入胰蛋白酶后,细胞内钙离子浓度迅速升高,30 ~45 s达到峰值
四、他克莫司对人角质形成细胞PAR-2活化引起的细胞内钙离子动员的影响
激光扫描共聚焦显微镜下观察发现在角质形成细胞中加入胰蛋白酶后,细胞内钙离子浓度一过性增高,胰蛋白酶引起细胞内钙离子动员的达峰时间是30 ~ 45 s(图5)。
与不同浓度的他克莫司共培养24 h后,角质形成细胞中胰蛋白酶引起的细胞内钙离子动员的达峰时间均为30 ~45 s,且钙离子浓度在90 s时明显下降,各组间在上升速度、达峰时间和下降速度方面无明显区别。各组间细胞内钙离子峰浓度比较差异有统计学意义(F= 4.953,P= 0.003);与对照组比较,10-5、10-6和 10-7mol/L 他克莫司组钙离子动员的峰浓度显著降低(t值分别为2.582、2.821、2.923,P值分别为0.032、0.022、0.019),10-8和10-9mol/L 他克莫司组无明显变化(t值分别为0.846、0.462,P值分别为0.422、0.657)。见图6。

图6 他克莫司对胰蛋白酶引起的细胞内 钙离子动员的影响1:对照组;2 ~ 6:分别为10-9、10-8、10-7、10-6、10-5mol/L 他克莫司组。a:与对照组比较,P < 0.05
讨 论
PAR-2是蛋白酶激活受体家族中的一员,属于典型的G蛋白偶联受体,具有七次跨膜结构和独特的激活方式,广泛分布于人体内各组织和细胞(包括皮肤),参与皮肤感染、瘙痒和肿瘤等多个病理生理过程[4]。PAR-2激活后可引起各种细胞因子如白细胞介素6、8和粒细胞-巨噬细胞集落刺激因子及趋化因子的分泌和释放[5],调节皮肤的免疫应答和炎症反应。实验诱导的过敏性和刺激性接触性皮炎的炎症反应在PAR-2 基因敲除小鼠中均明显减弱,提示PAR-2 在皮肤炎症过程中发挥重要作用[6]。角质形成细胞和真皮血管内皮细胞是PAR-2的主要效应细胞[7],在炎症性皮肤病如特应性皮炎和银屑病皮损中,角质形成细胞和血管内皮细胞PAR-2 表达均显著增加[2-3]。所以,角质形成细胞PAR-2 的前炎症效应可能作为治疗皮肤炎症的一个新靶位。
他克莫司的作用机制与环孢素相似,均通过抑制细胞增殖的信号转导通路来发挥作用。他克莫司的主要靶细胞是淋巴细胞,通过抑制早期淋巴细胞相关基因的表达,抑制淋巴细胞的免疫活性[8]。除了淋巴细胞,他克莫司还可直接作用于特应性皮炎样皮损中的角质形成细胞,促进转化生长因子β释放,下调可诱导性一氧化氮合酶mRNA和蛋白表达,并通过调节核因子κB 来抑制角质形成细胞分泌肿瘤坏死因子α[9]。
本研究显示,体外培养的角质形成细胞与一定浓度的他克莫司共培养后,PAR-2 mRNA和蛋白表达均受到抑制,其中10-9mol/L 他克莫司即可使PAR-2 mRNA表达显著降低,而PAR-2蛋白的表达下降在他克莫司浓度>10-7mol/L 时才有统计学意义,表明他克莫司对PAR-2 mRNA 的抑制更显著。出现这一现象的原因可能是他克莫司主要通过与FKBP12蛋白结合抑制转录因子活化T细胞核因子(NFAT)而发挥作用,它所阻断的主要是转录过程,但基因的转录和翻译发生的时间和位点存在时空间隔,基因在转录后,还要经历转录后加工和转录产物降解、翻译以及翻译后加工及修饰等,因此导致他克莫司对PAR-2基因转录水平和翻译水平影响并不完全一致的现象。由此推测他克莫司可能通过抑制PAR-2 基因的表达来抑制PAR-2 在细胞表面的表达,不过他克莫司影响PAR-2基因表达的信号转导通路尚需进一步明确。
钙离子作为第二信使在细胞中广泛参与各种生命活动,多种炎症因子的分泌及表达均需要钙离子参与。PAR-2 激动剂胰蛋白酶可识别并裂解PAR-2的N末端的特殊部位,引发细胞内钙离子动员,使细胞内钙离子浓度一过性升高[10]。因此细胞内钙离子动员可以作为PAR-2活化的一项指标,用以衡量PAR-2的功能。本研究显示,胰蛋白酶能引起人角质形成细胞内钙离子浓度一过性升高,其达峰浓度受他克莫司的影响,他克莫司浓度>10-7mol/L时峰值钙离子浓度显著降低,而对于细胞内钙离子动员的上升速度、达峰时间和下降速度则无影响。由于角质形成细胞中PAR-2 蛋白表达水平亦表现出与他克莫司浓度的相关性,即当他克莫司浓度大于10-7mol/L 时才出现PAR-2 蛋白表达的下降,所以他克莫司对人角质形成细胞PAR-2 活化引起的Ca2+峰值浓度的变化与PAR-2 表达量的变化具有一致性,提示他克莫司可能并不影响蛋白酶激活PAR-2 的过程,PAR-2 整体功能的下降可能是由PAR-2表达量的下降引起。
综上所述,本研究结果表明,他克莫司可抑制角质形成细胞PAR-2的功能性表达,可能通过抑制PAR-2基因的表达来实现,推测外用他克莫司可能通过直接抑制皮肤角质形成细胞PAR-2 的表达来治疗炎症性皮肤病。但是,本研究主要为体外实验,他克莫司在体内炎症状态下发挥的具体作用还有待进一步深入研究。
利益冲突所有作者均声明不存在利益冲突
