肌腱干细胞的生物学特性及应用
2019-11-28刘友杰王华军郑小飞
刘友杰,王华军,郑小飞
肌腱损伤是骨科常见疾病,据统计,每年全球有将近3000万患者出现肌腱损伤[1],美国60岁以上老年人群肩袖损伤发病率超过30%,其中每年有超过5 万名患者需要手术治疗[2]。而随着老龄化程度的加剧以及体育运动的普及,肌腱损伤的发病率正在逐年增长。在芬兰,跟腱损伤每十万人群发病率由1979 年的2.1 人增加到2011 年的21.5 人,33 年间上升了十多倍[3]。与此同时,肌腱损伤也给社会医疗带来巨大负担,在美国,每年造成的卫生健康经济负担就高达300亿美元[4]。
近年来随着各种药物及修复材料的不断开发和更新,肌腱损伤的治疗技术逐步提高。但由于肌腱损伤后再生能力较弱,存在瘢痕增生和肌腱黏连等因素,其生物力学性能往往只能达到正常肌腱的40%[5]。如何获得良好的肌腱再生及满意的功能恢复,是目前肌腱损伤修复亟待解决的临床难题。
肌腱干细胞(tendon-derived stem cell,TDSC)又称肌腱祖细胞(tendon stem progenitor cell,TSPC),是肌腱组织来源的新型多能干细胞,具有自我更新及多向分化潜能,临床应用前景广阔[6]。然而,TDSC除了腱系分化外,还具有成脂分化、成软骨分化、成骨分化潜能,影响因素错综复杂。甚至有研究发现,肌腱损伤与TDSC 的某些分化潜能存在联系[7],也就是说,TDSC 很可能是一把双刃剑,因此有必要对其特性作进一步深入探索。本文综述近年来有关TDSC 生物学特性、培养与鉴定、调控TDSC 增殖及多向分化因素等方面的研究进展,介绍TDSC 在肌腱损伤实验研究中的应用,旨在为肌腱相关疾病的临床治疗提供新的思路。
1 TDSC生物学特性
2007年Bi等[6]首次由人腘绳肌腱及小鼠髌腱组织中分离获得TDSC,之后相继有研究从大鼠、兔、火鸡等动物肌腱组织中获取[8-10]。从细胞形态学上来看,TDSC 的细胞群落形似鹅卵石,与肌腱细胞相比,体积更小、核仁更大[9]。其细胞外基质主要由双糖链蛋白聚糖(biglycan,Bgn)、纤维调节素(fibromodulin,Fmod)等成分组成[7],其所构成的干细胞微环境对TDSC的增殖和分化具有重要意义。当干细胞微环境改变时,TDSC会出现致病的可能。有研究将干细胞微环境中去除Bgn 和Fmod 的TDSC 与正常TDSC 相比较,结果发现其分化胶原纤维排列混乱,具有更大的成骨潜力,结局更易形成病理骨化,进而引发钙化性肌腱病[6-7]。
TDSC 的细胞数量与肌腱组织供体的年龄密切相关,随着供体年龄的增大,TDSC 的增殖能力逐步降低。Zhou 等[11]对比研究3~4 月龄和24~26月龄雄性大鼠髌腱组织TDSC,对培养8 d后的细胞数量进行计数,年老组TDSC 数量明显少于年轻组,其占总肌腱细胞的比例显著降低,年老组供体表达CD44亦显著高于年轻组。而CD44基因是调控肌腱损伤修复的重要基因,Ansorge等[12]对比CD44 基因敲除小鼠与野生型小鼠的髌腱损伤愈合效果,6 周后CD44 敲除组小鼠胶原纤维组织增加,组织学形态更接近正常组织,小鼠髌腱组织强度亦优于对照组。以上结果提示,实际应用中选取更年轻的供体组织来源,可能会获得更好的治疗效果。TDSC 表型在不同物种肌腱组织中也存在差异(表1)[13]。
2 TDSC鉴定与培养
2.1 TDSC鉴定
TDSC 的准确鉴定是其培养和分化的前提。目前并未发现TDSC的特征性免疫表型,因TDSC属于肌腱来源的间充质干细胞(mesenchymal stem cell,MSC),故现阶段主要利用MSC 共有免疫表型,如CD44、CD90、CD105 等干细胞标志物进行鉴定[14]。Liu等[10]通过检测MSC标志物CD90、CD44 和CD105 来鉴定火鸡TDSC;Yang 等[15]在分离培养猪跟腱组织时,利用其高度表达的干细胞标志物CD90、CD105等来鉴定培养TDSC。
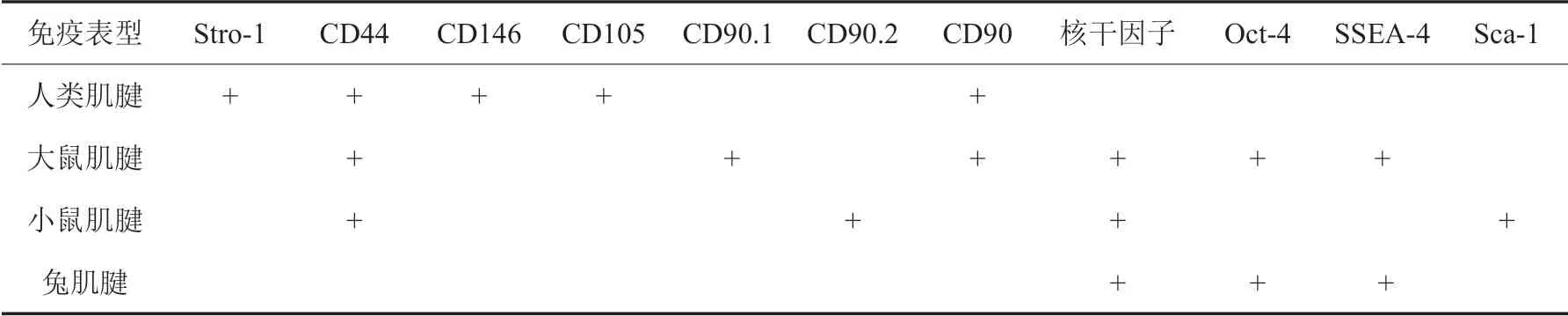
表1 不同物种肌腱组织供体的免疫表型[13]
随着研究的不断深入,学者们发现TDSC 与MSC存在许多不同之处[7]:人和小鼠的TDSC表型中不存在CD18,但骨髓间充质干细胞(bone marrow mesenchymal stem cell,BMSC)却存在这一表型;60%的小鼠TDSC 表达CD90.2,而小鼠BMSC 却未检测到CD90.2。除此之外,TDSC 鉴定还需考虑供体种属及培养时间等因素,甚至同一供体的TDSC 都可能存在表型差异。Asai 等[16]将小鼠跟腱分离获得的TDSC异体移植到小鼠跟腱损伤模型中,发现小鼠TDSC 免疫表型存在CD105 阳性、CD105 阴性两个亚群,其TDSC 的生物学特性存在显著差异,与CD105 阳性组相比,CD105 阴性组表现出优异的软骨形成潜力,在小鼠肌腱中可诱导出更为严重的软骨样变性损伤。总之,在TDSC鉴定和表型方面,目前还没有形成统一的认识,探索TDSC 鉴定的特征性标志因子是未来研究的一个主要方向。
2.2 TDSC培养
目前常用的分离培养方法主要包括酶消化法和低密度接种法。相对于其他细胞的培养,TDSC的主要问题是获得数量少,培养和扩增时容易失去其细胞干性,因此学者们围绕这些问题展开进一步研究。
2.2.1 加快增殖速度,提高细胞数量Lee等[17]分别将人TDSC在2%氧浓度和20%氧浓度下培养4、8和10 d,结果发现TDSC在2%氧浓度条件下(低氧组)比20%氧浓度(高氧组)增殖速度更快,尤其是10 d 时,低氧组TDSC 数量较高氧组增多25%,比最初培养时扩增450倍;低氧组TDSC的腱系分化水平也更高。人们还发现,细胞因子对TDSC 的增殖具有促进作用。Yang等[15]将猪TDSC培养基分为3 组,表皮生长因子(epidermal growth factor,EGF)组、EGF+碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)组和EGF+干细胞因子(stem cell factor,SCF)+bFGF组,结果发现EGF组与EGF+bFGF 组平均传代时间均为5~7 d,而EGF+SCF+bFGF 组传代时间明显低于前两组,提示联合应用EGF+SCF+bFGF可有效提升TDSC的增殖速度。亦有学者发现训练等外界刺激有助于提高肌腱干细胞的增殖数量,Zhang等[18]将10只雌性小鼠随机分为跑步机运动组(训练1周,15 min/d,速度13 m/min)与空白对照组,干预实施后从两组小鼠中分离TDSC,体外测量其增殖数量,最终发现运动组小鼠肌腱干细胞的增殖数量较空白对照组几乎翻了一倍。
有学者利用大鼠TDSC 对比早期(P5)、中期(P10)和晚期(P20、P30)的子代细胞,培养5 d后发现早、中、晚期TDSC增殖速度依次加快,3组间比较,差异均有统计学意义,提示TDSC的集落生成能力与增殖潜能随代数增加而提升;然而,与其他各代细胞相比,晚期P30细胞表面衰老标志物β-半乳糖苷酶最高,其干细胞表面特异性标志物与多向分化能力也显著降低[19]。由此可见,在TDSC传代培养的子代细胞中,其干细胞特性与增殖潜力呈负相关,如何选择兼顾两方面特性的次代细胞培养,值得深入研究。
2.2.2 保持干性、减少污染 在体外培养过程中,保持良好的细胞干性、避免其他系统细胞污染是需要重点解决的问题。Zhang 等[20]发现在常规塑料细胞培养皿上,体外扩增的TDSC 很容易失去其干细胞特性,于是基于脱细胞肌腱组织开发出工程化肌腱基质(engineered tendon matrix,ETM),相对于普通塑料培养基,ETM干细胞基因(Oct-4、SSEA-1、SSEA-4 等)和肌腱细胞相关基因(Ⅰ型、Ⅲ型胶原蛋白和tenomodulin 等)均显著上调,这一结果提示ETM 极大促进了TDSC 干性的保持,同时具有调控TDSC腱系分化的功能。
进一步的研究发现,低水平的前列腺素(prostaglandin,PGE)2 可以很好地维持TDSC 的干性。Zhang和Wang[21]从人髌腱组织中分离培养TDSC,将其分为6组并加入6种不同浓度的PGE2(0、0.01、0.1、1、10 和100 ng/mL),最终结果显示,加入0.01 ng/mL PGE2 的实验组干细胞标志物(SSEA-4和Stro-1)表达含量最高。
在TDSC 提纯方面,目前的方法均无法对肌腱组织予以彻底过滤除杂,导致原代细胞杂质较多。秦胜男等[22]采用传统酶消化法分离培养人髌腱TDSC,结果显示MSC特征性表型CD29、CD44和CD105 的表达量分别为99.63%、99.73%和99.34%,但同时也检测出造血系统细胞特征性表型CD14 和CD45,表达量分别为5.63%和2.02%,说明这一过程受到造血系统细胞的污染。张立岩等[23]采用改良分次酶消化法(0.25%胰酶和3 mg/mLⅡ型胶原酶分次消化),避免了杂质细胞过多的问题,干细胞纯度较高。但以上两种提纯方法均无法彻底避免污染问题,仍需探索更为理想的提纯方案。
3 TDSC多向分化的影响因素
TDSC 的多向分化潜能包括腱系分化与非腱系分化,如何在体内诱导TDSC 定向分化是发挥其临床效果的关键环节。就调控TDSC分化的相关因素及其机制,目前国内外学者已经开展了初步的探索。
3.1 应力刺激
肌腱在发育形成、成熟和退变过程中不断接受机械力学刺激,而力学刺激目前被认为是调控TDSC 分化的重要因素之一。王继宏[24]对新西兰家兔跟腱TDSC 分别施加2%、4%和6%的应力刺激,结果显示4%应力刺激组肌腱分化相关基因和蛋白表达水平显著高于2%组和6%组,提示TDSC在4%应力刺激下可以更有效地向腱系分化。
不同的力学性质对TDSC 的分化也有不同的影响。Xu等[25]对TDSC分别施加不同频率和强度的力学刺激,结果发现在0.5Hz 4%的循环拉伸应力下,TDSC腱系分化的相关基因(Ⅰ型胶原蛋白、腱生蛋白C、腱调蛋白及Scx)表达均高于其它条件的力学刺激,因此认为0.5Hz 4%力学刺激可能是TDSC成腱分化的最佳力学条件。
3.2 细胞因子
细胞因子具有调节细胞生成代谢、免疫反应及修复等生物学作用,是体内生理病理反应的重要调控因子。目前相关研究已证实,细胞因子对TDSC的分化方向具有重要的调节作用。
转化生长因子-β1(transform growth factor-β1,TGF-β1)是机体生长发育、损伤修复的重要调节因子。Holladay 等[26]将浓度为1、10 和100 ng/mL 的TGF-β1分别与肌腱干细胞共培养,结果发现1 ng/mL浓度组的骨黏连蛋白表达上调,硫酸氨基葡萄糖染色阳性,表明该组TDSC成软骨样分化;而随着浓度的升高,Scx、TEN-C、Ⅰ型和Ⅱ型胶原蛋白的表达显著上调,提示TDSC成肌腱细胞分化。
骨形态发生蛋白(bone morphogenetic protein,BMP)具有抑制TDSC胞腱系分化的作用,Rui等[27]在含有BMP-2 的培养基中培养大鼠TDSC,对照组不做特殊处理,结果显示,3、14、21 d 三个时间点实验组TDSC腱系分化标志物(Ⅰ型胶原蛋白、Scx,TNMD)的表达与培养时间呈负相关,提示BMP-2对TDSC腱系分化具有抑制作用。
3.3 药物作用
部分药物可诱发肌腱损伤,其作用机制可能与调控TDSC分化有关。Chen等[28]发现因自身免疫性疾病长期应用糖皮质激素的患者跟腱断裂发生率明显升高,病理结果显示其跟腱纤维结构紊乱,Ⅰ型胶原蛋白表达显著下降;他们在加入地塞米松的培养基中培养大鼠TDSC,3 d 后TDSCⅠ型胶原蛋白、TNMD 及肌腱特异性转录因子scleraxis的表达明显降低,揭示TDSC的腱系分化受到抑制。
部分中药对TDSC 的分化也有一定的作用。Zhou 等[29]的研究结果表明,PGE2 可以促进大鼠TDSC 成骨基因OSX、BMP-2、OCN、Runx2 的表达,而厚朴酚科能显著抑制PGE2诱导的肌腱干细胞成骨分化,这一过程可能通过下调PGE2介导的PI3K/aKT/β-catenin 信号通路来实现。Wu 等[30]发现南蛇藤醇可以促进TDSC 的非踺系分化,研究将TDSC与南蛇藤醇共同培养,结果发现TDSC的成脂基因PPARγ、成骨基因Runx2、成软骨基因Sox9均出现上调。
3.4 代谢紊乱
糖尿病、高胆固醇血症等多种疾病引起的代谢紊乱等病理生理改变可能会影响TDSC的分化方向。Shi 等[31]建立大鼠糖尿病模型,成模后第1周髌腱就出现微小撕裂及TDSC 的形态学改变,第2 周TDSC BMP-2、ALP、OPN、OCN、Ⅱ型胶原蛋白和SOX9 的表达明显升高,而其腱系分化标志Ⅰ型胶原蛋白及腱调蛋白明显下降,TDSC形态呈多突纺锤形,提示糖尿病可导致TDSC成骨、成软骨能力明显增强,而腱系分化能力下降。
为阐明胆固醇对TDSC的作用,Li等[32]用不同浓度胆固醇(0、1、10、100 mg/dL)培养TDSC,3 d后肌腱细胞标志物腱调蛋白及Ⅰ型胶原蛋白的表达随胆固醇浓度的增高而下降,Scx、Col3、Lum、Egr1、Fmod等基因的表达水平也有所下降,表明高胆固醇血症同样抑制了TDSC的腱系分化能力。
4 TDSC在肌腱损伤中的应用
4.1 腱-腱愈合
Komatsu 等[33]将TDSC 移植到大鼠跟腱损伤模型中,培养4周后发现TDSC组跟腱损伤处新生出更加丰富的肌腱纤维组织,胶原纤维排列更加有序,细胞狭长、呈纺锤形;其跟腱最大拉力亦显著优于对照组,这一结果从生物力学角度为TDSC移植治疗髌腱损伤提供了基础研究支持。Lee等[34]将含有结缔组织生长因子(connective tissue growth factor,CTGF)的纤维蛋白凝胶移植于大鼠离断髌腱模型(实验组)以富集内源性TDSC,对照组移植不含CTGF的纤维蛋白凝胶,1周后实验组TDSC 数量增加约20 倍,而对照组TDSC 增殖缓慢;实验组表达更多的肌腱相关标志基因如Ⅰ型胶原、Ⅲ型胶原、TNC、TNMD 和Scx 等;实验组最大负载力亦显著高于对照组;4周时对照组髌腱愈合处瘢痕样组织紊乱,而实验组再生肌腱表现出致密且有序排列的胶原结构,上述结果均证实TDSC在腱-腱愈合中的治疗作用。
4.2 腱-骨愈合
以肩袖损伤愈合和前交叉韧带(anterior cruciate ligament,ACL)损伤愈合为代表的腱-骨愈合一直是肌腱损伤治疗的难点,研究人员也尝试探索TDSC的治疗作用。有学者建立兔肩袖损伤模型,实验组植入针织丝-胶原海绵+含同种异体兔TDSC 胶原凝胶支架于损伤处,对照组植入针织丝-胶原海绵+含PBS 胶原凝胶支架,4 周时TDSC组可观察到更多的成纤维细胞,8周时植入部位开始形成连续纤维,排列更加整齐紧凑;WB检测显示TDSC 组Ⅰ型、Ⅲ型胶原蛋白含量在4、8、12 周时均高于对照组[35]。随后Lui 等[36]将TDSC 细胞片包裹在ACL 移植物表面后植入大鼠ACL 损伤模型中,2 周后该组骨隧道骨密度增加42.3%,最大机械负荷增加52.5%,促进了腱骨愈合。
4.3 肌腱炎
TDSC 应用于肌腱炎动物模型也取得良好的治疗效果。Durgam等[37]将TDSC注射于马肌腱炎模型前肢屈肌腱病灶,12 周后病理结果显示TDSC组肌腱胶原排列明显优于生理盐水组,肌腱最大拉力亦显著高于生理盐水组。Chen等[38]将跟腱炎模型大鼠随机分为富血小板血浆(plateletrich plasma,PRP)治疗组、TDSC 治疗组、PRP 与TDSC联合治疗组、损伤模型对照组以及假手术组(正常肌腱对照),于4、8周时收集肌腱组织,通过组织学和生物力学评估肌腱质量,结果发现这两个时间点PRP治疗组治疗效果优于损伤模型对照组,而TDSC 联合PRP 治疗组对组织学结果和生物力学功能的改善更为明显,疗效更佳,进一步检测还表明,联合治疗组肌腱组织表达了更多的肌腱细胞相关基因(Ⅰ型胶原、Scx、肌腱蛋白C),揭示了TDSC 在促进腱系分化、加速肌腱炎康复过程中的重要作用。
5 TDSC与其他干细胞的比较
一直以来,干细胞疗法是肌腱损伤治疗的研究热点,其中BMSC、脂肪来源干细胞(adipose-derived stem cell,ADSC)、胚胎干细胞(embryonic stem cell,ESC)等都是肌腱损伤潜在的治疗手段。目前尚未有TDSC与上述干细胞治疗效果的对比研究,但通过各类实验,将TDSC与其他干细胞间接对比后,我们仍可发现TDSC 的一些优势。
相较于其他干细胞,TDSC主要组织相容性复合物Ⅱ的表达较低,提示其不易出现免疫反应[39]。而相对于BMSC,TDSC取材方便,来源广泛,数量众多,基本上无副作用。Bi等[6]研究发现来源于小鼠髌腱和人腘绳肌腱的TDSC 培养8~10 d 后,TDSC 占细胞总数的3%~4%。而BMSC 主要来源于骨髓,取材过程较为痛苦,数量更为稀少,约占骨髓有核细胞的0.01%~0.001%[40-41]。Tan等[39]对大鼠TDSC 和BMSC 的增殖能力进行对比分析,结果发现TDSC 表现出更强的克隆和增殖能力,肌腱分化标志基因Scleraxis、Ⅰ型胶原蛋白和tenomodulin 等的表达也显著高于BMSC 组,提示TDSC可能在修复肌腱损伤时更具优势。
ADSC 也被用于肌腱损伤的修复研究中,与TDSC 同样具有获取方便[42]、获取量大、患者痛苦小等特点,有研究表明每30 mL 脂肪组织可获得2×108~6×108个有核细胞[43]。Uysal和Mizuno[44]将ADSC联合PRP植入兔髌腱组织,4周后发现相对于PRP 对照组,实验组肌腱细胞分化率更高,约为11.54%。Chen 等[45]在大鼠肩袖损伤模型中注射ADSC,结果发现肌腱最大拉力显著增强,提示ADSC 可促进胶原纤维的重新组建,利于愈合和功能恢复。但其治疗机制还不明确,与TDSC 治疗效果的比较目前也无研究;其修复作用是由于ADSC 本身定向分化成肌腱组织,还是因ADSC促进原位TDSC 腱系分化继而加速肌腱愈合,需要进一步研究。
ESC 作为拥有多向分化潜能的干细胞之一,目前未有与TDSC 治疗效果直接对比的研究报道,但其在肌腱损伤治疗方面,与TDSC同样具有研究前景,2009年Chen等[46]首次通过ESC分步诱导技术,利用hESC 预先分化为MSC,再诱导腱系分化,显著促进了Ⅲ型胶原蛋白和肌腱标志基因scleraxis、six1、eya2、和epha4 等的表达,肌腱分化能力强。但由于一直存在伦理学争议[47],ESC 的基础研究和临床应用受到限制。而与来源于胚胎组织的ESC 不同,TDSC 来源于肌腱组织,未来真正用于临床的可能性更大。此外,ESC具有成瘤倾向,若缺乏合理的控制和诱导,可能形成畸胎瘤,诱发新的疾病。TDSC目前未有成瘤倾向的报道,有待于深入探究。
6 小结与展望
目前对于TDSC 的研究尚处于起步阶段,其生物学特性、鉴定培养及治疗应用等方面仍知之甚少,现阶段可通过已证实的部分生物学特性成功鉴定培养TDSC,但仍存在诸多表型不同、生物学特性各异的TDSC。利用多系分化潜能,TDSC在肌腱损伤治疗中大有可为,但如利用不好,TDSC 造成的非腱系分化反而可能致病。明确TDSC的特征性免疫表型,调控TDSC定向腱系分化,挖掘与筛选最优的TDSC促分化因素,高效提纯干细胞并维持干性,避免各类细胞污染,这些都需要进一步探索研究,为TDSC 的临床应用奠定理论基础。
