两种桑树病毒的形态观察与检测
2019-11-27孙勋勋周轶楠黄吉雷
孙勋勋 周轶楠 黄吉雷


摘要 桑树病毒病一直是影响蚕桑产业发展的重要因素之一,但其病原也尚未完全确认。本研究收集全国不同桑园、不同时间和不同品种的皱缩状和花叶状桑叶样品,分离病毒后使用透射电子显微镜观察病毒形态特征。结果在桑病叶中分离获得两种病毒,一种为双联体形态病毒,长(27.84±1.71)nm,宽(17.05±1.13)nm,形态特征与双生病毒属的病毒形态特征一致;另一种为球状体病毒(80~100 nm),形态特征与番茄斑萎病毒属的病毒形态特征一致;桑叶切片观察,发现同一桑叶材料中存在这两种病毒。通过高通量测序发现其存在桑花叶型萎缩病相关病毒Mulberry mosaic dwarf associated virus (MMDaV)和桑脉带相关病毒Mulberry vein banding associated virus (MVBaV)。设计上述病毒的特异引物,对158份桑病叶进行PCR检测,MMDaV的检出率为93.04%;而MVBaV为60.13%,同时检出率为57.59%。结果表明,MMDaV和MVBaV在桑病叶中普遍存在,且同时存在。本研究首次在桑树病叶中同时观察并检测到MMDaV和MVBaV,二者在桑皱缩状和花叶状的桑叶中存在混合感染的现象,研究结果将为今后深入研究桑病毒病及防控奠定了基础。
关键词 桑树病毒病; 桑花叶型萎缩病相关病毒; 桑脉带相关病毒; 形态特征; PCR检测
中图分类号: S 432.4+1 文献标识码: A DOI: 10.16688/j.zwbh.2018419
Abstract Mulberry viral disease is one of the most important factors affecting the development of sericultural industry, but the pathogens of mulberry viral disease have been long unclear. In this study, two viruses were isolated from the diseased mulberry leaf samples with crinkle or mosaic leaf symptoms collected from different varieties and different sericultural regions in China at different time and further examined by transmission electron microscope. One virus showed similar morphological features to geminivirus, and the length of virus particles was (27.84±1.71)nm and width was (17.05±1.13)nm. Another was a globular virus with the length between 80 and 100 nm and showed similar morphological features to Tospovirus. Both virus particles were observed in one mulberry leaf, and Mulberry mosaic dwarf associated virus (MMDaV) and Mulberry vein banding associated virus (MVBaV) were detected through high-throughput sequencing. Furthermore,158 diseased mulberry leaf samples of mulberry leaf were detected by specific identification PCR.The detection rates of MMDaV and MVBaV were 93.04% and 60.13%, respectively, and the detection rate of both was 57.59%. This was the first report that MMDaV and MVBaV were detected to coexist in the diseased mulberry leaf, which will provide a foundation for future study of mulberry viral diseases.
Key words mulberry viral disease; Mulberry mosaic dwarf associated virus; Mulberry vein banding associated virus; morphological character; PCR detection
桑树为木本植物,属蔷薇目Rosales、桑科Moraceae、桑属Morus。随着蚕桑产业的转型发展,桑树从传统的单一养蚕植物,逐渐成为多功能、多产品的植物资源[1-2],因此桑叶质量也越来越被关注。桑树病害是影响桑叶质量的重要因素之一,其中植物病毒对桑树的危害也一直未被解决。至今,已报道的桑树病毒有桑环斑病毒Mulberry ringspot virus、桑花叶病毒Mulberry mosaic virus、桑坏死病毒Mulberry necrosis virus、桑潜隐病毒Mulberry latent virus、桑脉带相关病毒Mulberry vein banding associated virus、桑花叶型萎缩病相关病毒Mulberry mosaic dwarf associated virus、桑花叶卷叶相关病毒Mulberry mosaic roll leaf associated virus和桑桿状DNA病毒1 Mulberry badnavirus 1等。其中,只有桑环斑病毒、桑花叶卷叶相关病毒、桑花叶型萎缩病相关病毒和桑杆状DNA病毒1四种被国际病毒分类委员会(ICTV)收录,但它们与桑树症状之间的确切关系尚未确定。
有关桑树病毒病的报道最早出现于1936年,当时统称为桑花叶病。20世纪60年代后,随着病毒分离、分子生物学等技术的发展,有关桑树病毒的分离和鉴定的研究报道才逐渐多了起来。1971年,Tsuchizaki 等在带有环斑状和丝叶状的病叶中分离并在切片中观察到一种球状病毒(直径22 nm)[3]。1976年,Tsuchizaki 等又从花叶等系统性褪绿斑的病叶中分离出另一种线型病毒(长约700 nm)[4]; 1983年,舒秀珍等从系统性褪绿褐色环斑状的桑叶中分离到一种球形病毒(直径约26 nm)[5]。1988年,陳俊英等连续三年从丝状和花叶状的桑叶中分别分离出一种线形病毒(长600~700 nm,宽11~12 nm)[6]; 1988年,张月季等从表现大斑块花叶的桑叶中分离一种球形病毒(直径25~30 nm)[7]; 2014年,Marei等从花叶、黄叶和畸形等症状的桑叶中发现一种双生病毒(双联体长57 nm)[8]。虽然在桑树中分离并观察到各种不同的病毒,但很难鉴定病毒的种类,即使电镜观察也不能完全反映病毒的真实特征。
分子生物学手段是研究桑树病毒病的重要方式。近5年来,利用分子生物学手段,桑树中的病毒不断被发现。2013年,Elbeaino等从花叶状和脉带状的桑叶中分离观察到一种桑杆状DNA病毒1(150 nm×30 nm),并通过简并寡核苷酸引物PCR(DOP-PCR)检测到DNA杆状病毒1的序列[9]。2014年,卢全有在桑病毒病叶片中分离到桑花叶卷叶病相关病毒(28~30 nm),并结合各种分子生物学方法鉴定该病毒属于线虫传多面体病毒属[10]。2015年,Meng 等在花叶和丝叶状的桑叶中观察到一种球状病毒,并通过高通量测序发现桑脉带相关病毒[11]。2015年,Ma 等通过高通量测序等分子手段在带有花叶和皱缩状的桑叶中检测桑花叶型萎缩病相关病毒[12],Lu 等也在皱缩的桑叶中检测到桑花叶型萎缩病相关病毒[13]。2016年,Chiumenti等通过高通量测序在带有环斑及黄脉的病叶中发现桑杆状DNA病毒1[14]。分子生物学手段结合形态学观察的方法已经被广泛应用于桑树病毒的研究上,并且高通量测序已经广泛应用于快速检测木本植物病毒上[15]。本文结合病毒显微观察、高通量测序和PCR检测技术对桑树病毒进行研究。
1 材料和方法
1.1 材料
收集的桑病叶主要有3种症状类型(图1): 1)叶片表现为皱缩畸形(图1a)。2)叶片花叶,带有褪绿斑(环斑的图1b和大斑块的图1c)。3)叶片表现为褪绿和畸形两种症状的花叶皱缩状(图1d)。
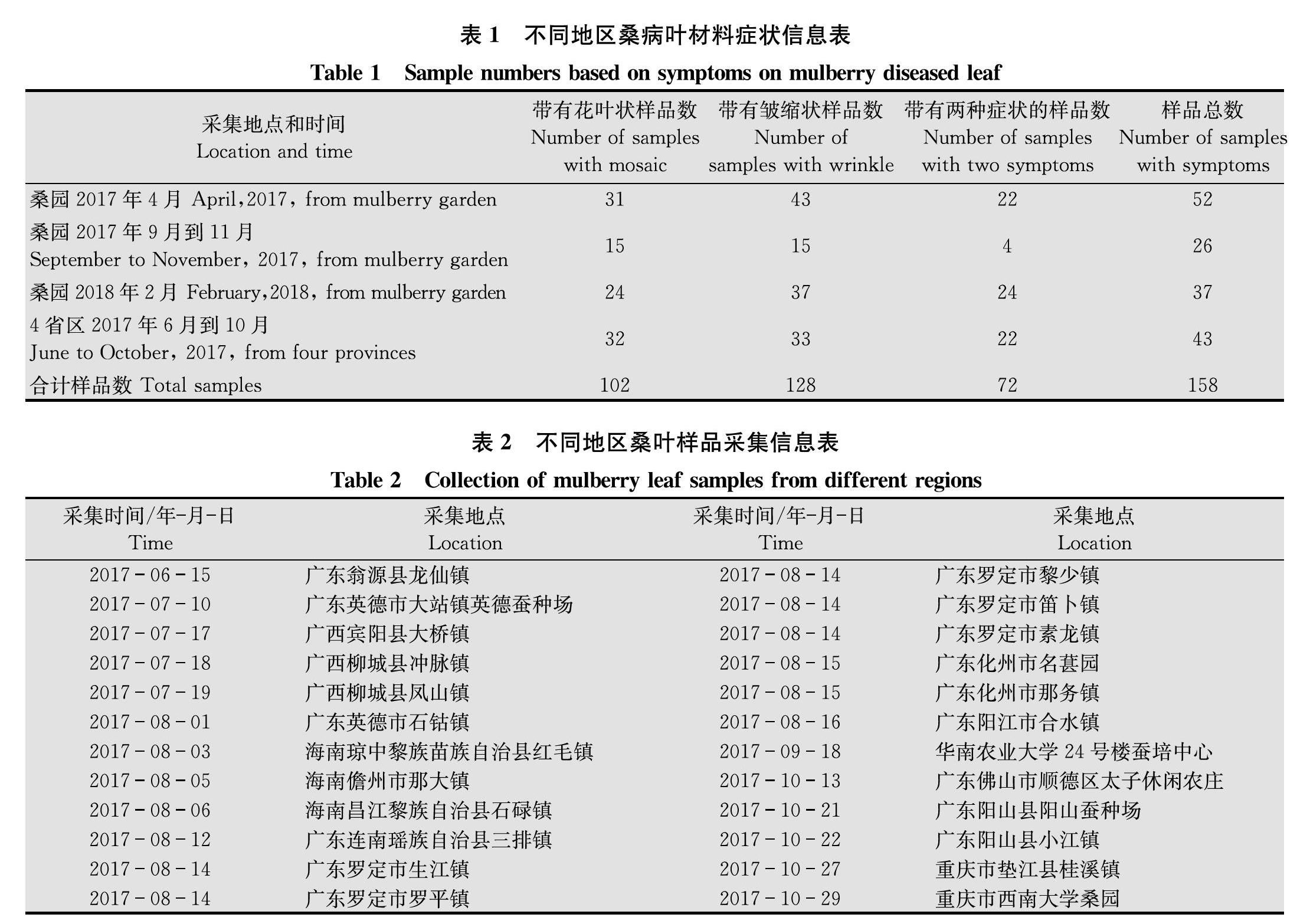
供试的桑病叶材料采集地点主要有两类。一类收集于华南农业大学蚕桑教学实践园(简称桑园),包括不同时间从不同桑品种上采集的桑病叶样品,共计115份,其中2017年4月采集52份、2017年9月到11月采集的26份,2018年2月采集的37份。另一类为采集于广东、广西、海南和重庆4个省区共16个县市(图2)收集的43份桑病样。各地采集的具体时间、地点和症状信息见表1~2。
1.2 方法
1.2.1 病毒的分离纯化及超薄切片的制作
桑花叶型萎缩病相关病毒的分离纯化方法: 1) 桑病叶50 g,加入2 mL/g的缓冲溶液(0.1 mol/L的柠檬酸缓冲液,pH 6.0,5 mL/L β-巯基乙醇),打碎过滤。2) 滤液氯仿乳化(1 mL/3 g叶片),10 000 g离心10 min,取上清。 3) 加入固体聚乙二醇6000 (70 g/L)和氯化钠(0.2 mol/L),4℃下搅拌3 h,10 000 g离心25 min,去上清。4) 加入0.1 mol/L柠檬酸缓冲液悬浮,4℃放置24 h。5) 10 000 g离心30 min,取上清,重复两次。6) 加入10%氯仿,混匀,10 000 g离心30 min,取上清。加入到10%~40%的蔗糖密度梯度离心,300 000 g离心1 h。取悬浮病毒带,302 000 g沉降离心1.5 h,悬浮沉淀,获得纯的病毒悬浮液,放置于4℃备用。
桑脉带相关病毒粗悬液的制备: 1) 桑病叶50 g,加入3 mL/g的缓冲液(0.1 mol/L磷酸钠缓冲溶液,pH 7.0,5 mL/L β-巯基乙醇),打碎过滤。2) 滤液10 000 g离心15 min。3) 去上清,加入3 mL/g的缓冲液,使用小研杵和磁力搅拌器将沉淀物轻轻混匀30 min。4) 8 000 g离心15 min澄清,收集上清液100 000 g离心30 min,去上清。5) 沉淀中加入2.5 mL缓冲溶液,加入到10%~40%蔗糖梯度离心,70 000 g离心45 min,收集含有病毒颗粒的乳白色带。6) 加入1∶1的缓冲液稀释,100 000 g离心1 h浓缩。7) 将病毒颗粒的沉淀以约1 mg/mL的浓度重悬浮于无菌双蒸水中。
桑病叶超薄切片观察: 1)桑病叶样品切片,使用0.1 mol/L pH 7.0的磷酸缓冲液漂洗4次,每次15 min,注射器抽出叶片中的空气。2)桑病叶样品用5%戊二醛4℃固定过夜,用磷酸缓冲液(0.1 mol/L,pH 7.0)漂洗4次,每次15 min。3)1%的锇酸固定过夜,磷酸缓冲液漂洗4次,每次15 min。4)依次使用30%、50%、70%、80%、90%乙醇脱水各10 min、100%乙醇脱水两次,每次15 min,100%的丙酮脱水两次,每次15 min。5)丙酮/树脂不同比例渗透(3∶1 4 h,1∶1 17 h,1∶3 8 h,纯树脂24 h),70℃聚合24 h。6)包埋块切成70 nm的超薄切片。
1.2.2 桑树中病毒的形态学观察
病毒离心液负染观察: 碳膜铜网吸附病毒悬浮液5 min,再用2%的醋酸双氧铀负染2 min,样品干燥后置于120 kV透射电镜下观察。
超薄切片观察: 超薄切片经醋酸铀和柠檬酸铅双染色,样品干燥后置于120 kV透射电镜下观察。
1.2.3 桑叶总DNA的提取
采用改良的CTAB法抽提植物基因组DNA。将研磨后的材料0.05 g粉末加入1.5 mL EP管中,加入2% CTAB(含0.1% β-巯基乙醇)缓冲液600 μL重悬,振荡混匀,65℃水浴3~4 h; 冷却后,加入等体积酚/氯仿,振荡混匀5 min,12 000 r/min,离心5 min,取水相上清; 加入400 μL氯仿抽提1次,取上清; 加入等体积的異丙醇,颠倒混匀数次,4℃放置1 h以上,将全部液体吸入到核酸纯化吸附柱套件中,12 000 r/min,30 s过滤,弃滤液; 用70%乙醇500 μL洗涤,12 000 r/min,30 s过滤两次,最后空离1次; 将吸附柱放置一新的EP管中,加30 μL ddH2O溶解DNA,使用核酸微量分光光度计检测核酸质量,检测合格后,置于-20℃冰箱保存备用。
1.2.4 桑叶总RNA的提取及反转录合成cDNA
使用Magen的RNA提取试剂盒(HiPure Plant RNA Mini Kit)提取桑叶总RNA,并使用核酸微量分光光度计检测质量,检测合格使用TaKaRa反转试剂盒合成cDNA置于-20℃备用,总RNA置于-80℃储藏。
1.2.5 高通量测序及PCR检测
将皱缩状和花叶状桑叶分别送广州瑞科基因科技有限公司进行转录组高通量测序和基因组DNA高通量测序。
桑脉带相关病毒的RT-PCR检测,根据桑脉带相关病毒核壳体蛋白核苷酸序列(KM819701.1)设计筛选获得引物: 上游引物S2776F: 5′-CATAGCATCAGCCTCAA-3′; 下游引物S3225R: 5′-GT-CTACCGTCCGTCAGC-3′。反应体系20 μL,包括2×Taq Master Mix 10 μL,ddH2O 7 μL,桑病叶总DNA模板2 μL,上、下游引物各0.5 μL。PCR条件为95℃预变性5 min,95℃变性30 s,60℃退火30 s,72℃延伸20 s,35个循环,最后72℃延伸10 min。
桑花叶型萎缩病相关病毒的PCR检测,检测特异引物为MCP746F/MCP1148R[16]。上游引物MCP746F:5′-CGAGTTTGGCAAGAAGGAAGAG-3′;下游引物MCP1148R: 5′-TTGGCTCCCACTAA-ATGAAAGG-3′。反应体系20 μL,包括2×Taq Master Mix 10 μL,ddH2O 7 μL,桑病叶总DNA模板2 μL,上、下游引物各0.5 μL,PCR条件为95℃预变性5 min,95℃变性30 s,61℃退火30 s,72℃延伸20 s,35个循环,最后72℃延伸10 min。
2 结果与分析
2.1 桑树病毒的形态特征
分别从不同症状的桑叶中分离纯化病毒,病毒悬浮液复染后在透射电子显微镜下观察(图3),从皱缩、花叶和携带两种症状的三类桑叶中均能分离到双联体形态的病毒粒子(图3a~b箭头所示);随机选取其中20个单病毒粒子以及20个双联体病毒粒子,使用明美显微数码分析系统测量病毒大小,20个双联体病毒粒子的平均直径为(27.84±1.71)nm,20个单体平均直径为(17.05±1.13)nm。另外,从花叶状和携带两种症状的桑叶中还分离到一种被囊泡包裹的球状病毒(图5a),其大小约为(80~100)nm。
对不同症状的桑叶组织切片的电镜观察显示(图4a~c、图5b),在带有皱缩和花叶两种症状的桑叶中观察到双联体病毒和球状病毒。桑叶细胞如同自噬般萎缩成葫芦状,难以分辨细胞器及组成,细胞内所有的黑色范围均聚集大量的病毒颗粒,放大观察,多个颗粒聚集一起,也存在明显的双联体结构,大小约为17 nm×28 nm(图4a~c),该结果与分离的双联体病毒粒子形态一致。另外,还有些细胞无明显的细胞器结构,且分布着一些被200~400 nm囊泡包裹的球状体,大小约为80~100 nm,这与分离的球状病毒粒子形态相同。
2.2 桑病叶高通量测序分析
高通量检测结果(表3)所示,在皱缩样品中检测到的DNA病毒序列,对比到的DNA病毒仅有桑花叶型萎缩病相关病毒(MMDaV),占所有可读序列的0.001 8%;在花叶样品中检测到的RNA病毒序列,对比到的RNA病毒仅有桑脉带相关病毒(MVBaV),占所有可读序列的0.490 8%,未发现其他病毒。
2.3 PCR检测桑树中的病毒
2.3.1 两种桑树病毒的PCR检测结果
利用特异性引物MCP746F/MCP1148R,对桑花叶型萎缩病相关病毒(MMDaV)进行PCR检测,结果显示:桑病叶样品总DNA中均存在大小约为400 bp的条带(图6:泳道1~9),空白对照则没有出现反应条带(图6),说明PCR反应体系没有污染,但泳道10没有出现目的条带,可能该样本不存在MMDaV病毒基因(图6)。将PCR阳性结果送上海生工生物工程有限公司测序,测序结果与DNA病毒MMDaV序列相似度高达97%,说明桑病叶材料中存在MMDaV。
利用特异性引物S2776F/S3225R对桑脉带相关病毒(MVBaV)进行RT-PCR检测,结果(图7)显示,泳道3~9桑病叶样品总DNA存在大小为450 bp左右的条带,空白对照11号泳道无条带,说明不存在污染,泳道1、2和10均无条带,可能样品中不存在目的病毒。将450 bp左右的RT-PCR结果送上海生工生物工程有限公司测序,测序结果与RNA病毒MVBaV相似度高达99%,说明桑病叶样品中存在MVBaV。
2.3.2 不同桑叶样品中MMDaV和MVBaV检出率分析
对采集于不同时间、不同品种和不同地理位置的桑病叶中两种病毒进行检测,检测结果(图8)显示,158份桑病叶样品MMDaV的检出率为93.04%(147/158), MVBaV的检出率为60.13%(95/158),共同检出率达57.59%(91/158)。102份表现花叶的桑叶中桑花叶型萎缩病相关病毒(MMDaV)的检出率为95.10%(97/102),桑脉带相关病毒(MVBaV)的检出率为65.69%(67/102),共同檢出率高达64.71%(66/102); 128份表现皱缩的桑叶中MMDaV的检出率为92.97%(119/128), MVBaV的检出率为61.72%(79/128),共同检出率达58.59%(75/128)。72份同时携带两种症状的桑叶中MMDaV检出率为95.83%(69/72),MVBaV的检出率为70.83%(51/72),共同检出率达69.44%(50/72)。
3 讨论
Ma等在桑叶中发现桑花叶型萎缩病相关病毒(MMDaV),并通过分子生物学分析认为该病毒属于双生病毒科病毒,但不属于现有的分类属[12],但他并未观察到病毒的形态特征。本研究首次从皱缩状、花叶状和携带两种症状的三种桑叶中分离到双联体形态的病毒粒子,长(27.84±1.71) nm,宽(17.05±1.13) nm,该病毒粒子与双生病毒科病毒(20 nm×30 nm)的大小和形态特征[17-18]一致。另外,从花叶和携带花叶及皱缩两种症状的桑叶中还分离到一种被囊泡(200~400 nm)包裹的球状病毒,其大小约为(80~100) nm,这与Meng等在桑叶组织切片中观察到的球状体病毒类似[11],与番茄斑萎病毒属的病毒形态一致[19],后者也存在明显的囊泡结构。对桑叶进行切片观察,在带有花叶和皱缩两种症状的桑叶中同时观察到双联体形态病毒和球状病毒。对两种桑病叶中的DNA及RNA进行高通量测序,发现皱缩症状的桑叶中检测到MMDaV,而花叶症状的桑叶中检测到MVBaV,通过高通量测序也进一步确定了桑病叶中存在这两种病毒。PCR检测均能在桑叶样品中发现这两种病毒,并且这两种病毒能在同一桑树病叶材料中被检测到。
分析不同时间、品种和地理位置的桑病叶中MVBaV和MMDaV两种病毒的检测结果,发现在158份桑病叶中,MMDaV的检出率为93.04%;MVBaV的检出率为60.13%;两种病毒同时检出率为57.59%。这表明MMDaV和MVBaV在桑病叶中普遍存在,并且同一桑叶中存在这两种病毒的现象也很普遍。Meng等[11]在2015年从脉带、环斑和丝叶等花叶症状的桑叶中发现MVBaV,并获得MVBaV的全基因组[11],我们的结果进一步表明MVBaV与桑病毒病有关。2015年,马宇欣采自陕西安康学院的92份桑病样中MMDaV的检出率高达92.4%,线虫传多面体病毒为52.17%,两种病毒存在混合感染的现象[20],并且在辣椒[21]、甜瓜[22]、番茄[23]等经济作物上均存在混合感染的情况,说明病毒的混合感染非常普遍。本研究也发现了桑叶中两种病毒混合感染的现象。
本研究首次从华南农业大学桑园及来自4个省区不同桑园的桑病叶中检测到MMDaV和MVBaV两种病毒,这两种病毒普遍存在于花叶和皱缩症状的桑叶中,且存在混合感染现象。因此在桑树病毒的研究中,需要考虑多种病毒混合感染情况;在病毒防治方面,也需要考虑对多种病毒进行防治,以加强防病和治疗的效果。
参考文献
[1] 封槐松,李建琴.我国蚕桑产业发展“十二五”回顾与“十三五”展望[J].中国蚕业,2016,37(1):4-10.
[2] 向仲怀.立桑为业 拓展提升[J].蚕业科学,2015,41(1):1-2.
[3] TSUCHIZAKI T,HIBINO H,SAITO Y.Mulberry ringspot virus isolated from mulberry showing ringspot symptom [J].Annals of the Phytopathological Society of Japan,1971,37(4):266-271.
[4] TSUCHIZAKI T.Mulberry latent virus isolated from mulberry (Morus alba L.)[J].Annals of the Phytopathological Society of Japan,1976,42(3):304-309.
[5] 舒秀珍,胡伟贞,沈淑琳,等.侵染大豆和桑的烟草坏死病毒(TNV)的鉴定[J].植物保护学报,1983,11(1):71-73.
[6] 陈俊英,洛海学.桑花叶病病原研究初报[J].广东蚕桑通报,1988(4):63-64.
[7] 张月季,洪健,徐正,等.浙江省桑树两种花叶病的初步报道[J].科技通报,1988(2):43-44.
[8] MAREI E M,ELBAZ R M,ELMAGHRABY I,et al.Occurrence of mulberry mosaic virus in Egypt [J].International Journal of Microbiology,2014,6(2):575-580.
[9] ELBEAINO T,CHIUMENTI M,DE STRADIS A,et al.Identification of a badnavirus infecting mulberry[J].Journal of Plant Pathology,2013,95(1):201-210.
[10] 卢全有.桑树中一种新病毒和一种小分子环状RNA的研究[D].福州:福建农林大学,2014.
[11] MENG Jiaorong,LIU Pingping,ZHU Liling,et al.Complete genome sequence of mulberry vein banding associated virus,a new tospovirus infecting mulberry [J/OL].PLoS ONE,2015,10(8):e0136196.
[12] MA Yuxin,NAVARRO B,ZHANG Zhixiang,et al.Identification and molecular characterization of a novel monopartite geminivirus associated with Mulberry mosaic dwarf disease[J].Journal of General Virology,2015,96(8):2421-2434.
[13] LU Quanyou,WU Zujian,XIA Zhisong,et al.Complete genome sequence of a novel monopartite geminivirus identified in mulberry (Morus alba L.)[J].Archives of Virology,2015,160(8):2135-2138.
[14] CHIUMENTI M,MORELLI M,DE STRAD A,et al.Unusual genomic features of a badnavirus infecting mulberry [J].Journal of General Virology,2016,97(11):3073-3087.
[15] 马宇欣,李世访.高通量测序技术在鉴定木本植物双生病毒中的应用[J].植物保护,2016,42(6):1-10.
[16] 孙勋勋,杨宏宇,刘吉平.桑花叶型萎缩病相关病毒的初步检测[C]∥中国蚕学会.中国蚕学会第九届青年学术研讨会会议论文集,2017.
[17] 龚祖埙,沈菊英,郑巧兮,等.我国第一例双联病毒——烟草曲叶病病毒的分离及电镜检定[J].科学通报,1982,27(22):1393.
[18] MUNIYAPPA V,SWANSON M M,DUNCAN G H,et al.Particle purification,properties and epitope variability of Indian tomato leaf curl geminivirus [J].Annals of Applied Biology,1991,118(3):595-604.
[19] 張仲凯.番茄斑萎病毒属病毒粒体在寄主植物中的装配与运动机制研究[D].北京:中国农业科学院,2015.
[20] 马宇欣.桑花叶型萎缩病病原的鉴定[D].北京:中国农业科学院,2015.
[21] 左琳彧,雍容婧,袁雯,等.北京地区辣椒上黄瓜花叶病毒和甜菜西方黄化病毒复合侵染的分子鉴定[J].植物保护,2016,42(3):181-183.
[22] 杨世安,李战彪,秦碧霞,等.广西三种甜瓜病毒分离物的分子检测与鉴定[J].植物保护,2017,43(3):83-89.
[23] 刘微,史晓斌,唐鑫,等.云南番茄褪绿病毒和番茄黄化曲叶病毒复合侵染的分子鉴定[J].园艺学报,2018,45(3):552-560.
(责任编辑: 杨明丽)
