稻纵卷叶螟成虫日龄的判定指标
2019-11-27樊茹静郭嘉雯张洁
樊茹静 郭嘉雯 张洁


摘要 本研究旨在明確稻纵卷叶螟成虫生化和形态指标与其日龄之间的关系,为建立稻纵卷叶螟成虫日龄判定的数学模型和预测预报提供理论依据。通过提取稻纵卷叶螟成虫头部生化物质和解剖其生殖器官,研究了羽化后1~6日龄雌雄成虫头部褐脂质、蝶啶含量的变化以及雌蛾卵巢小管和雄蛾精巢的发育状况。研究表明:(1)不同日龄间雌、雄成虫头部褐脂质、蝶啶含量均无显著差异。(2)不同日龄间雌蛾卵巢小管长度、雄蛾精巢大小均具有显著差异(P<0.05)。雌蛾1~3日龄、3~6日龄卵巢小管长度与日龄的线性相关系数(R2)分别为0.615 2和0.128 4。雄蛾精巢长半轴、短半轴长度与日龄的线性相关系数(R2)分别为0.578 4和0.579 6。(3)利用卵巢小管长度对低日龄雌蛾日龄的估计表明:1 d估计误差平均为±0.56 d,2 d估计误差平均为±0.47 d。利用精巢长半轴对雄蛾日龄的估计表明:1~6 d估计误差平均为±1.28 d、±1.48 d、±1.43 d、±1.32 d、±1.53 d和±1.29 d。利用精巢短半轴对雄蛾日龄的估计表明:1~6 d估计误差平均为±1.15 d、±1.04 d、±0.97 d、±1.12 d、±1.46 d和±1.21 d。综上,头部褐脂质和蝶啶不能准确反映稻纵卷叶螟成虫日龄的变化,不能作为其日龄判定的指标。而雌蛾卵巢小管和雄蛾精巢形态稳定,其大小变化与日龄具有一定的对应关系,卵巢小管和精巢在稻纵卷叶螟成虫日龄的判定中具有较大的应用潜力。
关键词 稻纵卷叶螟; 褐脂质; 蝶啶; 内生殖系统; 日龄
中图分类号: S 435.112.1 文献标识码: A DOI: 10.16688/j.zwbh.2018390
Abstract This study was carried out to clarify the relations of the age to biochemical and physiological indexes of Cnaphalocrocis medinalis, so as to establish a mathematical model for the determination of the adult age and provide a theoretical basis for the prediction and forecast. The lipofuscin and pteridine were extracted and the internal reproductive organs were dissected to study the lipofuscin and pteridine concentrations and the morphologies of the ovaries and testes in 1-6-day-old moths. The following results were obtained: (1) There were no significant differences in lipofuscin and pteridine concentrations between ages.(2)The length of ovariole of the females and the size of testis of the males had significant differences between ages (P<0.05). Linear relationships of ovarioles and testes between different ages were also analyzed. The correlation coefficients of ovarioles were 0.615 2 in 1-3 day-old females and 0.128 4 in 3-6 day-old males. The correlation coefficients of the length of testes were 0.578 4 in semi-major axis and 0.579 6 in semi-minor axis.(3)The analysis of age estimation determined by the length of ovarioles showed that the mean errors of estimated age were±0.56 d in 1 day-old females and±0.47 d in 2 day-old. The mean errors of estimated age determined by the semi-major axis length of testes were±1.28 d in 1 day-old males,±1.48 d in 2 day-old,±1.43 d in 3 day-old,±1.32 d in 4 day-old,±1.53 d in 5 day-old and ±1.29 d in 6 day-old. The mean errors of estimated age determined by the semi-minor axis length of testes were±1.15 d in 1 day-old males,±1.04 d in 2 day-old,±0.97 in 3 day-old,±1.12 d in 4 day-old,±1.46 d in 5 day-old and±1.21 d in 6 day-old. It is concluded that lipofuscin and pteridine in the head can not accurately reflect the age of C.medinalis. Stable morphology of female moth ovariole and male moth testis is related to the adult age and has great potential for application in determination of adult age of C. medinalis.
Key words Cnaphalocrocis medinalis; lipofuscin; pteridine; internal reproductive organ; day-age
稻纵卷叶螟Cnaphalocrocis medinalis 为一种可多次夜间飞行和白昼停息的重大农业迁飞性害虫,飞行过程极为复杂。对其有效防控的前提是及时准确地监测预警。对该类害虫的监测预警主要依赖异地预测,而异地预测首先要弄清虫源地所在,这主要借助于轨迹分析,而轨迹分析需明确其具体迁飞次数。王凤英等[1]、杨帆等[2]先后利用飞行磨装置在室内条件下测定了稻纵卷叶螟成虫的再迁飞能力,并提取出飞行的各项行为参数。但田间情况极其复杂多变,稻纵卷叶螟在自然状态下到底能再迁飞几次,这个问题尚不得而知。明确稻纵卷叶螟日龄,根据其夜间飞行白昼停息的迁飞特点可有效推测出灯下可见蛾已迁飞多久,即迁飞次数。因此,生产中稻纵卷叶螟迁飞种群监测预警,需要找出明确判定日龄的判断依据来为其迁飞轨迹分析提供参数。
昆虫年龄分级的理论基础是昆虫在其生长发育过程中必然会发生一系列有规律的变化,其中一些因子可以作为昆虫年龄的指标,例如体内特定组分(褐脂质和蝶啶)和生殖系统(卵巢和精巢)。
褐脂质,又称脂褐素、老年色素或蜡样物,存在于老化细胞。Kodama等指出,褐脂质的年龄估计是相当有效的年龄估计法,在很多具有生态和经济价值的甲壳动物中得到应用[3]。褐脂质随年龄的增加在各种昆虫、甲壳类动物、鱼类中均有记载[4-6]。迄今为止只有邹运鼎等[7]对稻纵卷叶螟成虫头部褐脂质和日龄的关系进行过初步研究,但其报道只是简单提及两者的关系,且试验重复量太少,其结果有很大的局限性。因此需重新明确褐脂质和日龄的关系。
蝶啶是嘌呤降解产生的一类生物色素,广泛存在于昆虫中。很多研究表明,蝶啶的含量与年龄有关,例如,Mail等[8]发现厩螫蝇Stomoxys calcitrans成虫头壳蝶啶含量随日龄的增长而显著线性增加,并据此提出了蝇类成虫日龄推断的一种生化方法—蝶啶荧光分析法。Rinkevich等[9]采用分光光度计测定蝶啶荧光强度,比较蝶啶浓度、头重和蜜蜂日龄三者的关系。表明蜜蜂头部蝶啶含量随日龄的增长呈线性增长。关于蝶啶和稻纵卷叶螟日龄关系的研究目前未见报道,因此进行本试验明确两者的关系以判定昆虫年龄。
张孝羲等[10]划分出了稻纵卷叶螟卵巢发育进度分级标准,大体上将稻纵卷叶螟分为5个级别,但其分级标准比较笼统不能精确到日龄。陈庆华等[11]对稻纵卷叶螟1~8日龄精巢长半轴长度进行划分,明确了精巢长半轴可作为稻纵卷叶螟雄蛾日龄判定指标。但利用该划分指标推测的估计日龄与实际日龄相差多少,即估计日龄的误差是多少,陈庆华等未对此部分做研究,因此无法判断利用精巢长半轴长度估计稻纵卷叶螟日龄的准确性。
因此本研究拟通过稻纵卷叶螟雌雄蛾体内相关组分(褐脂质和蝶啶)含量的变化和生殖系统(卵巢和精巢)的发育状况来开展该类迁飞害虫的迁飞日龄判定研究,以找出比较稳定的能反映日龄的指标。确定灯下稻纵卷叶螟成虫日龄,以期为预测预报提供理论依据。
1 材料与方法
1.1 供试虫源
幼虫参照朱阿秀等[12]的小麦饲养法饲养。具体方法如下:蛹放在铺有湿润脱脂棉的塑料盒内(附自制尼龙纱网罩),所有试虫于恒温(26±1)℃、RH 80%~90%、光周期L∥D=14 h∥10 h的人工气候箱(RXZ-380C-LED;宁波江南仪器厂)中饲养繁殖。成虫以雌雄2×2配对,转移至500 mL的塑料杯中,定期饲喂5%蜂蜜水。收取1~6日龄雌雄成虫为供试昆虫。
1.2 提取体内生化物质
1.2.1 褐脂质
褐脂质的提取参照Robson等[13]和范青松[14]的方法并加以改进如下:取出冷冻的稻纵卷叶螟雌雄成虫,区分性别后切取头部并称重,后转移至1.5 mL离心管中,每管加入100 μL氯仿-甲醇溶液(2∶1)匀浆,充分匀浆后再加入上述溶液1.4 mL,混匀,然后4 000 g(4℃)离心20 min。取上清液于2 mL离心管中,加入500 μL去离子水,再次离心后取下层溶液待测。用多功能酶标仪以激发光360 nm、发射光450 nm测定荧光强度(整个过程在较暗的环境下进行操作)。以硫酸奎宁为标准物,制作标准曲线并计算每mg头壳中褐脂质的含量。
1.2.2 蝶啶
蝶啶的提取参照Rinkevich等[9]的方法并加以改进如下:取出冷冻的稻纵卷叶螟成虫,区分性别后切取头部并称重,后转移至1.5 mL离心管中,进行蝶啶的提取。每管加入1.5 mL氯仿-甲醇溶液(2∶1)匀浆,混匀后超声波放置15 s讓其溶解,冰上放置>1 min,之后再超声波溶解15 s,重新放回冰上操作,加入0.75 mL 0.1 mol/L 甘氨酸-氢氧化钠溶液(pH=10),漩涡10 s,然后5 000 g(4℃)离心5 min。取上清液用于测定蝶啶荧光强度。在发射光450 nm、激发光355 nm的条件下测定荧光强度(蝶啶提取和测定过程均在冰上和较暗的环境下操作)。以硫酸奎宁为标准物,制作标准曲线并计算每mg头壳中蝶啶的含量。
1.3 解剖内生殖系统
1.3.1 卵巢和精巢解剖
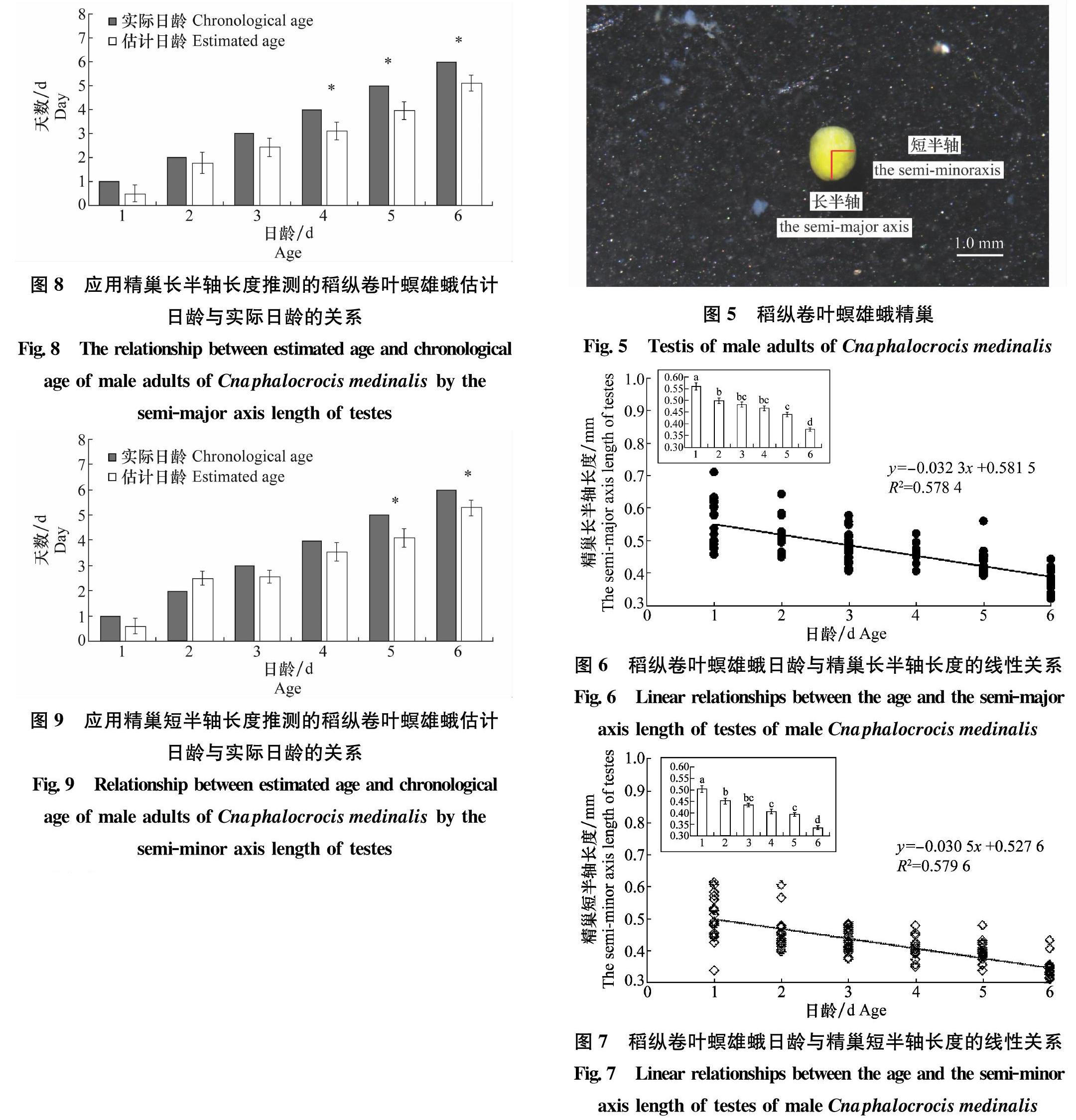
卵巢解剖对虫体新鲜度要求较高,因此本试验采用未经冷藏和药剂处理的新鲜虫体进行解剖。收取1~6日龄雌蛾,去除翅后将剩余部分固定至含10 mmol/L PBS缓冲液(pH=7.2)的蜡盘中,在显微镜下将试虫腹部朝上,用昆虫针固定,左手用镊子固定雌蛾尾部,右手用昆虫针沿尾部方向划开腹背交界线,撕开表皮,分离出卵巢。用昆虫针剔除卵巢周围的脂肪粒,使卵巢小管清晰可见,以待拍照。雄蛾的精巢解剖方法同卵巢。
1.3.2 拍照测量
采用体视荧光显微镜(Nikon SMZ25;日本尼康)拍照,拍照分辨率:4 908×3 264;OBJ:1.0;ZOOM:1.0;MRG总变率:1.0。拍照时将卵巢和精巢轻贴在蜡盘中,避免卵巢小管和精巢出现漂浮现象而造成测量结果不准。拍照保存后,测量卵巢小管长度、精巢长半轴和短半轴长度,各参数都分别测量3次取平均值。
1.4 数据统计与分析
采用SPSS 18.0统计软件进行试验数据的统计分析。对不同性别和不同日龄的稻纵卷叶螟头部褐脂质和蝶啶含量进行双因子方差分析;对不同日龄雌蛾的卵巢小管、雄蛾的精巢长半轴和短半轴长度之间进行单因子方差分析;对估计日龄和实际日龄的关系进行t检验。此外,不同日龄之间用Tukeys HSD检验进行处理间差异显著性检验(P<0.05)。
2 结果与分析
2.1 稻纵卷叶螟成虫头部褐脂质和蝶啶含量
双因子方差分析表明,性别(褐脂质:F=0.43, P=0.52;蝶啶:F=0.55, P=0.46)、日龄(褐脂质:F=0.76, P=0.58;蝶啶:F=1.03, P=0.40)及两者的交互作用(褐脂质:F=0.37, P=0.87; 蝶啶:F=0.40, P=0.85)对稻纵卷叶螟成虫头部褐脂质和蝶啶含量均无显著影响(表1)。
2.2 卵巢小管
2.2.1 稻纵卷叶螟雌蛾各日龄卵巢级别比例
稻纵卷叶螟的卵巢发育共分为5个等级(图1)。各日龄稻纵卷叶螟卵巢级别所占比例(图2)为:1日龄的Ⅰ级和Ⅱ级卵巢分别占92.86%、7.14%,2日龄中Ⅰ级和Ⅱ级卵巢分别占10.81%、89.19%,3日龄中Ⅱ、Ⅲ和Ⅳ级卵巢的占比分别为2.94%、70.59%和26.47%,4日龄中Ⅲ和Ⅳ卵巢分别占73.33%和26.67%,5日龄中Ⅲ、Ⅳ和Ⅴ级卵巢分别为29.41%、32.35%和38.24%,6日龄中Ⅲ、Ⅳ和Ⅴ级卵巢分别占比37.5%、6.25%和56.25%。
2.2.2 雌蛾卵巢小管长度及其与日龄的关系
单因子方差分析结果表明,稻纵卷叶螟各日龄间卵巢小管长度具有显著性差异(F=39.12, df=5,203, P<0.05)。随着日龄的增加,卵巢小管长度呈现先增后减的变化规律,以3日龄达到最大。1、2、3、6日龄间存在显著差异,3日龄之后,两相邻日龄间卵巢小管长度无显著差异。对卵巢小管长度与日龄进行线性相关分析(图3),结果表明,3日龄之前,随着日龄增加,卵巢小管长度不断增加,其线性相关系数R2=0.615 2,3日龄之后,随着日龄增加,卵巢小管长度逐渐减小,其线性相关系数R2=0.128 4。
2.2.3 利用卵巢小管长度和卵巢级别推测的估计日龄与实际日龄相互关系分析 结合上述卵巢小管长度和卵巢级别,将1~6日龄进行人为区间划分:将1日龄和2日龄归类为低日龄区间;将卵巢级别为Ⅱ级的3日龄归类为过渡区间;将4日龄、5日龄、6日龄以及卵巢级别为Ⅲ级的3日龄归类为高日龄区间。
卵巢小管长度随日龄增长呈先增后减的趋势,3~6 d的变化与日龄的相关性较差,仅1~3 d随日龄增加呈显著线性增长,故利用前3日龄的线性方程判断低日龄稻纵卷叶螟的年龄。判定方法如下:(1)将卵巢级别为Ⅲ级、Ⅳ级和Ⅴ级的稻纵卷叶螟归类为高日龄区间,即3日龄(含)之后(3 d之后相邻日龄间卵巢小管长度无显著差异,故不进行日龄估计);(2)将卵巢级别为Ⅰ级和Ⅱ级的稻纵卷叶螟卵巢小管长度带入线性方程y =2.759 1x+2.683 3中,得出估计日龄,即1、2 d和少数卵巢级别为Ⅱ级的3 d。t检验比较估计日龄与实际日龄的显著性。由于试验样本中3日龄只有一头雌虫卵巢为Ⅱ级卵巢,无法比较其估计日龄与实际日龄的关系,因此只进行1 d和2 d的比较(图4)。结果表明1 d估计日龄与实际日龄有显著差异(t=-6.82, P<0.01),估计误差平均为±0.56 d。2 d估计日龄与实际日龄无显著差异(t=0.89, P=0.38>0.01)。估计误差平均为±0.47 d。
2.3 精巢
2.3.1 雄蛾精巢长、短半轴长度及其与日龄的关系
解剖并测量1~6日龄雄蛾精巢(图5),单因子方差分析结果表明:随着生长发育,雄蛾精巢的长、短半轴长度均呈下降趋势。1、2、5、6日龄之间精巢长半轴长度均具有显著差异(F=32.88, df=5, 105, P<0.01),而2、3、4日龄之间精巢长半轴长度无显著差异,精巢长半轴长度与日龄线性相关系数R2=0.578 4(图6);1、2、5、6日龄之间精巢短半轴长度也具有显著差异(F=32.30,df=5,107,P<0.01),2、3、4日龄之间精巢短半轴长度无显著差异,精巢短半轴长度与日龄线性相关系数R2=0.579 6(图7)。
2.3.2 利用精巢长半轴长度推测的估计日龄与实际日龄相互关系分析 利用精巢长半轴与日龄的线性关系对雄蛾日龄进行估计(图8),1(P=0.16>0.05)、2(P=0.62>0.05)、3日齡(P=0.16>0.05)雄蛾的估计日龄与实际日龄之间均无显著差异,估计值比实测值分别小1.28、1.48和1.43 d;而4(P=0.03<0.05)、5(P=0.01<0.05)和6日龄(P=0.01<0.05)雄蛾的估计日龄与实际日龄之间均具有显著差异,估计误差分别为1.32、1.53和1.29 d。
2.3.3 利用精巢短半轴长度推测的估计日龄与实际日龄相互关系 利用精巢短半轴与日龄的线性关系,对雄蛾日龄进行估计(图9)。t检验表明1(P=0.21>0.05)、2 (P=0.08>0.05)、3 (P=0.10>0.05)和4 日龄(P=0.26>0.05)雄蛾的估计日龄与实际日龄均无显著差异,估计误差平均分别为±1.15 d、±1.04 d、±0.97 d和±1.12 d。5 日龄(P=0.008<0.05)和6 日龄(P=0.019<0.05)估计日龄与实际日龄均具有显著差异,估计误差平均分别为±1.46 d和±1.21 d。
3 讨论
3.1 褐脂质、蝶啶不能准确反映稻纵卷叶螟成虫日龄变化 本文通过比较稻纵卷叶螟雌、雄蛾日龄与褐脂质和蝶啶含量的关系,发现不同性别和日龄的稻纵卷叶螟成虫头部褐脂质和蝶啶含量均无显著性差异。因此褐脂质和蝶啶不能作为判定稻纵卷叶螟成虫日龄的指标。关于褐脂质与日龄关系的报道,Sohal等的研究表明家蝇Musca domestica[15]头部褐脂质含量随家蝇日龄增加而增加。范青松采用组织切片和透射电镜技术研究口虾蛄Oratosquilla oratoria脑部褐脂质分布和形态结构特征,建立了褐脂质含量与口虾蛄[14]年龄相关方程。有些报道表明甲壳类动物体内褐脂质和年龄具有较高的相关性[16-17]。关于蝶啶与日龄关系的报道,采采蝇Glossina morsitans morsitans[18]、 淡足舌蝇G.pallidipes Austen[18]和秋家蝇Musca autumnalis[19]头壳蝶啶含量随日龄增加呈显著线性增长,丝光绿蝇 Lucilia sericata[20]、家蝇Musca domestica[21]蝶啶含量随日龄增加呈非线性增长,有些蚊类如斯氏按蚊Anopheles stephensi[22]蝶啶含量随日龄增加呈线性减少。可见不同昆虫其体内蝶啶含量变化规律不同。昆虫体内特定组分含量与日龄关系的研究中,主要报道了甲壳类动物和蝇类、蚊类等双翅目昆虫,关于鳞翅目昆虫的报道很少,关于稻纵卷叶螟成虫日龄与特定组分含量关系的研究更是少之又少。可能不同物种之间体内特定组分含量变化规律不同,导致了稻纵卷叶螟头壳褐脂质和蝶啶含量变化规律与已报道双翅目及其他昆虫不同。
3.2 卵巢小管作为判断稻纵卷叶螟雌蛾日龄的指标 本研究结果发现,稻纵卷叶螟卵巢级别与卵巢小管长度具有关联性,这与张孝羲等的报道一致[10]。3日龄之前,卵巢小管逐渐伸长,且变化速率较快,1~3日龄雌蛾的卵巢小管长度有显著差异,且卵巢小管长度与日龄具有良好的线性关系。而3日龄之后卵巢小管不断萎缩,但变化过程较慢,相邻日龄间卵巢小管长度无显著差异。结合卵巢小管长度变化规律和各日龄卵巢级别所占比例,制定出判定日龄方法。最终能判定出低级别卵巢的稻纵卷叶螟日龄。通过比较1 d和2 d估计日龄与实际日龄的关系表明,1 d平均估计日龄为1.56 d,估计日龄的平均误差为±0.56 d。2 d平均估计日龄为1.88 d,估计日龄的平均误差为±0.47 d。卵巢小管作为判断稻纵卷叶螟雌蛾日龄,具有一定的优势:对于低日龄区间(3 d之前),能进行有效估计,且估计日龄平均误差较小,且解剖技术投入成本少、受外来因子干扰小,是一个稳定的检测指标。卵巢小管长度用于判断雌蛾日龄,也存在不足:对于高日龄区间(3 d之后)只能大概判断其日龄范围。由于卵巢结构复杂,卵巢小管、交配囊等各器官交织在一起,且周围充斥着脂肪粒,解剖操作难度较大,且费时费力。
3.3 精巢作为判断稻纵卷叶螟雄蛾日龄的指标
目前关于蛾类雄性生殖系统状况的判断主要通过区分射精管的颜色、形态,如斜纹夜蛾Spodoptera litura[23]、二化螟Chilo suppressalis[24]、茶尺蠖Ectropis obliqua[25]。但由于射精管太细且容易变形,其颜色在不同条件下会发生改变,难以形成标准化指标。本文通过解剖稻纵卷叶螟雄蛾,发现雄蛾精巢长、短半轴随日龄的增加而有规律地显著减小。陈庆华等[11]以相邻日龄精巢长半轴的平均值作为两相邻日龄的分界点,得到1~8 d稻纵卷叶螟雄蛾日龄的划分指标,并利用该划分指标进行1日龄反演。但未对该划分方法进行验证,因此无法得知此方法的准确率。与相邻日龄精巢长半轴平均值划分指标不同,本文采用精巢长半轴长度和日龄的相关关系式进行日龄估计。雄蛾羽化第1天,精巢长半轴平均值为0.558 8 mm,随日龄的增加,长半轴逐渐变短,第6天精巢长半轴平均为0.376 mm,比第1天减小了32.7%。陈庆华等的结果为:羽化第1天,精巢长半轴平均值为0.443 3 mm,第6天为0.327 9 mm,比第1天减小了26.03%。虽然与陈庆华的结果略有不同,这可能是地域差异导致,但精巢长半轴变化规律是一致的,均表现为随着日龄的增加精巢长半轴变短。本文也对精巢短半轴进行了研究,其结果表明,羽化第1天,短半轴平均值为0.504 4 mm,随日龄的增加,短半轴逐渐变短,第6天精巢短半轴为0.335 1 mm,比第1天减小了33.6%。可见,随日龄的增加,精巢逐日递减。利用长半轴推测日龄,1~6 d的估计日龄分别为0.47、1.77、2.42、3.11、3.96和5.10 d。利用短半轴推测日龄,1~6 d的估计日龄分别为0.6、2.49、2.55、3.54、4.08和5.28 d。本试验中,精巢大小随日龄增加发生相應的变化,精巢大小在一定程度上能反映日龄变化。但利用精巢判定日龄的方法也存在不足:估计日龄均比实际日龄偏低。在接下来的工作中,可通过寻找其他影响精巢大小的因子,选择同类或近似环境的稻纵卷叶螟进行判定,以便较好地控制判定误差。
找出明确判定日龄的判断依据可为迁飞轨迹分析提供参数,从而为预测预报提供理论依据。目前关于稻纵卷叶螟日龄的研究所知甚少,本研究从体内特定组分和生殖系统两方面进行了研究,明确了褐脂质和蝶啶不能作为稻纵卷叶螟成虫日龄的判定指标,而生殖系统作为稻纵卷叶螟判定日龄方法,虽有不足之处,但已初步确定卵巢小管长度和精巢长、短半轴与日龄的相关关系,卵巢小管和精巢在稻纵卷叶螟成虫日龄的判定中具有较大的应用潜力。
参考文献
[1] 王凤英, 张孝羲, 翟保平. 稻纵卷叶螟的飞行和再迁飞能力[J]. 昆虫学报, 2010, 53(11): 1265-1272.
[2] 杨帆. 稻纵卷叶螟迁飞和再迁飞的生态机制[D]. 南京: 南京农业大学, 2014.
[3] KODAMA K, YAMAKAWA T, SHIMIZU T, et al. Age estimation of the wild population of Japanese mantis shrimp Oratosquilla oratoria,(Crustacea: Stomatopoda) in Tokyo Bay, Japan, using lipofuscin as an age marker [J]. Fisheries Science, 2010, 71(1):141-150.
[4] MCARTHUR M C, SOHAL R S. Relationship between metabolic rate, aging, lipid peroxidation, and fluorescent age pigment in milkweed bug, Oncopeltus fasciatus (Hemiptera) [J]. Journal of Gerontology, 1982, 37(3): 268.
[5] BLUHM B A, BREY T. Age determination in the Antarctic shrimp Notocrangon antarcticus (Crustacea: Decapoda), using the autofluorescent pigment lipofuscin[J]. Marine Biology, 2001, 138(2): 247-257.
[6] STRAUSS R E. Brain-tissue accumulation of fluorescent age pigments in four poeciliid fishes (Cyprinodontiformes) and the estimation of “biological age” [J]. Growth Development & Aging: GDA, 1999, 63(4): 151.
[7] 邹运鼎, 李红兵, 马飞, 等. 褐飞虱和稻纵卷叶螟成虫的日龄研究[J]. 安徽农业大学学报, 1992(4): 295-302.
[8] MAIL T S, CHADWICK J, LEHANE M J. Determining the age of adults of Stomoxys calcitrans (L.) (Diptera: Muscidae)[J]. Bulletin of Entomological Research, 1983, 73(3): 501-525.
[9] RINKEVICH F D, MARGOTTA J W, PITTMAN J M, et al. Pteridine levels and head weights are correlated with age and colony task in the honey bee, Apis mellifera[J]. PeerJ, 2016, 4(6): e2155.
[10] 张孝羲,陆自强,耿济国.稻纵卷叶螟雌蛾解剖在测报上的应用[J].昆虫知识,1979,16(3):97-99.
[11] 陈庆华,曾娟,曾伟,等.稻纵卷叶螟雄蛾内生殖系统形态指标在性诱测报中的应用[J].昆虫学报,2017,60(8):927-935.
[12] 朱阿秀,钱秋,刘向东.利用小麦苗饲养稻纵卷叶螟的方法[J].應用昆虫学报,2015,52(4):883-889.
[13] ROBSON S K A, CROZIER R H. An evaluation of two biochemical methods of age determination in insects (pteridines and lipofuscins) using the ant Polyrhachis sexpinosa Latrielle (Hymenoptera: Formicidae)[J]. Australian Journal of Entomology, 2009, 48(2): 102-106.
[14] 范青松. 口虾蛄年龄鉴定和种群动态研究[D]. 大连: 大连海洋大学, 2015.
[15] SOHAL R S, DONATO H. Effect of experimental prolongation of life span on lipofuscin content and lysosomal enzyme activity in the brain of the housefly, Musca domestica[J]. Journal of Gerontology, 1979, 34(4): 489-496.
[16] SHEEHY M R. Role of environmental temperature in aging and longevity: insights from neurolipofuscin[J]. Archives of Gerontology & Geriatrics, 2002, 34(3): 287-310.
[17] BELCHIER M, EDSMAN L, SHEEHY M R J, et al. Estimating age and growth in long-lived temperate freshwater crayfish using lipofuscin [J].Freshwater Biology, 2010, 39(3): 439-446.
[18] LEHANE M J, HARGROVE J. Field experiments on a new method for determining age in tsetse flies (Diptera: Glossinidae) [J]. Ecological Entomology, 2010, 13(3): 319-322.
[19] MOON R D, KRAFSUR E. Pterin quantity and gonotrophic stage as indicators of age in Musca autumnalis (Diptera: Muscidae) [J]. Journal of Medical Entomology, 1995, 32(5): 673-684.
[20] WALL R, LANGLEY P A, MORGAN K L. Ovarian development and pteridine accumulation for age determination in the blowfly Lucilia sericata[J]. Journal of Insect Physiology, 1991, 37(12): 863-868.
[21] MCINTYRE G S, GOODING R H. Pteridine accumulation in Musca domestica[J]. Journal of Insect Physiology, 1995, 41(4): 357-368.
[22] EDALAT H, AKHOUNDI M, BASSERI H. Age-dependance of pteridines in the malaria vector, Anopheles stephensi[J]. Pteridines, 2017, 28(3/4):157-161.
[23] 徐博.斜紋夜蛾前胸腺与性腺的形态结构和发育研究[D].广州:中山大学,2012.
[24] 宋俊元,胡阳,傅强,等.二化螟雄虫内生殖系统结构的解剖[J].浙江农业科学,2012(5):686-688.
[25] 张家侠,孙钦玉,赵强,等.茶尺蠖雄成虫生殖系统形态学与组织学观察[J].茶叶科学,2015,35(6):527-533.
(责任编辑: 田 喆)
