不同ELISA系统检测人血清百日咳IgG抗体的比较研究
2019-11-27王丽婵
卫 辰,晁 哲,吴 燕,骆 鹏,王丽婵,马 霄
(中国食品药品检定研究院/卫生部生物技术产品检定方法及其标准化重点实验室,北京 102629)
我国和大多数发达国家如美国、欧盟、日本等国都在使用不良反应小的无细胞百日咳、白喉和破伤风联合疫苗(DTaP)。与西方国家使用的将百日咳鲍特氏菌有效抗原分别层析纯化、精确配比的组分无细胞百白破疫苗(DTacP)不同,占DTaP市场95%的国产疫苗仍然是使用传统的蔗糖密度梯度离心混合提纯,抗原成分复杂且各组分占比不固定的共纯化DTaP。DTacP各抗原的纯度在95%以上,根据配方不同包括1~5种百日咳鲍特氏菌抗原蛋白[1-2],而共纯化DTaP要求蛋白总纯度在85%以上,通常只包括百日咳毒素(PT)和丝状血凝素(FHA),偶尔也包括少量黏附素(PRN)和微量的菌毛Fim2/3型。目前我国10多家企业均在研发新纯化工艺的DTacP和以DTacP为基础的多联疫苗[1],众多研发中的DTacP多联疫苗和已上市产品都需要进行临床试验,检测血清中抗百日咳鲍特氏菌抗原的IgG抗体以判定疫苗有效性。百日咳疫苗临床试验使用酶联免疫吸附试验(ELISA),以WHO百日咳抗血清国际标准品(06/140)和从国际标准品溯源的第1代人源百日咳抗血清国家参考品为标准,对血清样品进行酶标抗体单位值测定,结果由酶标IgG抗体值和转阳率判定。目前,我国临床血清百日咳抗体ELISA试验的检测用抗原并没有国际和国家统一的参考品,以往临床试验多由厂家自己提供临床检测用抗原[3]。随着临床试验设计更加复杂和完善,可能需要多组对照疫苗。疫苗临床试验不再是2个厂家之间样品免疫效果的比较,而是多个厂家、多个工艺、多种抗原构成的样品之间的比较。ELISA包被抗原的选择可能会影响到临床试验检测结果,进而影响到整个临床试验的成功与否。并且在百日咳疑似病例的临床血清学诊断中,不同来源包被的百日咳抗原也将影响到血清阳性结果的判定,继而影响百日咳疾病的确诊和发病率统计。本研究参考之前有关ELISA系统比较的文献,使用3组不同来源共10个百日咳鲍特氏菌有效组分抗原PT、FHA和PRN对同一组国产共纯化DTaP临床基础免疫血清进行ELISA检测[4-7],并对结果进行比较研究,也是国内首次对共纯化DTaP的PRN抗体进行检测研究。现报道如下。
1 试剂与方法
1.1样品 中国食品药品检定研究院保存的共纯化DTaP基础免疫临床血清样本164对,包括免疫前和免疫后血清。
1.2试剂与仪器
1.2.1ELISA包被抗原 国内公司A提供3种液体保存抗原,以A表示:PT(A1-201701)、FHA(A2-201702)、PRN(A3-201703);国际公司B提供3种液体保存抗原,以B表示:PT(B1-200603)、FHA(B2-200401)、PRN(B3-200601);中国食品药品检定研究院提供4种冻干抗原,其中FHA 2种抗原,以C表示:PT(C1-200701)、FHA(C2-200702)、FHA(C3-20140524)、PRN(C4-201606001)。
1.2.2标准血清 WHO百日咳抗血清国际标准品(06/140),每支单位值(PT335 IU,FHA130 IU,PRN65 IU)。
1.2.3其他主要试剂耗材及仪器 PBS(MP 0218054991);吐温20(MP 103168);酶标山羊抗人IgG结合物(Invitrogen A24524);显色底物OPD(Sigma P9187);96孔酶标板(Greiner,655080);血清稀释板(Greiner公司);酶标仪(Molecular SPECTRA MAX LPOS)。
1.3方法 3种抗原均以3 μg/mL的浓度用pH 9.6的碳酸盐缓冲液包被酶标板,每孔100 μL,4 ℃过夜。PBST洗板3次,加入0.5%的BSA稀释液,将预先稀释20倍的免疫后样品血清,以1/20的比例加入酶标板第一行的A1-A11孔中,免疫前血清不稀释直接加入孔中,A12孔中加入200倍稀释的标准血清,酶标板自上而下倍比稀释,37 ℃,1 h;洗板,加入已稀释好的二抗,37 ℃,1 h;再次洗板,加入底物液,室温避光15 min;2 mol/L硫酸终止,在450 nm读取吸光度值。采用酶标仪分析软件,运用四参数法绘制标准曲线,计算每份血清中PT、FHA、PRN的抗体值。免疫前免疫后血清使用全部抗原进行检测。
1.4统计学处理 以免疫前血清为基准,对3种抗原检测的免疫后血清计算转阳率。阳转标准为PT的IgG抗体>20 IU/mL,FHA的IgG抗体>20 IU/mL,PRN的IgG抗体为免疫后4倍增长;PT及FHA免疫后IgG抗体未达到20 IU/mL的样品若达到免疫后抗体四倍增长也判定为阳转[3]。对不同抗原包被的抗体检测结果转阳率采用χ2检验。对3组免疫后数据抗体几何均值(GMC)采用SPSS22.0软件进行统计学分析,用单因素方差分析进行多组差异比较,进一步两两比较采用LSD-t检验,检验水平α=0.05。以P<0.05为差异有统计学意义。
2 结 果
2.1试验的有效性 10种抗原包被的酶标板阳性血清稀释度符合四参数方程分析要求,R2>0.95,各个系统试验结果有效。
2.2人抗百日咳IgG抗体测定结果分析
2.2.1免疫前抗体水平及不同ELISA抗原检测的抗体转阳率及保护率比较 基础免疫前血清抗体水平及阳性率极低,不同抗原检测转阳率一致。免疫前血清PT和FHA的IgG抗体分别有1例和2例阳性,阳性率PT为0.6%,FHA为1.2%,PRN为0.0%。在免疫后的164份血清中,PT抗体用A1检测为100.0%阳性,用B1和C1检测均有1例未到达20 IU/mL且没达到4倍增长,转阳率为99.4%;FHA抗体用A2、B2、C3检测为100.0%阳性,用C2检测有8例未到达20 IU/mL且没达到4倍增长,转阳率为95.1%;PRN抗体A3和B3检测为100.0%阳性,用C4检测有2例未达到4倍增长,转阳率为98.78%。对转阳率做χ2检验,PT和PRN的转阳率差异无统计学意义(χ2=1.004,P=0.605;χ2=4.016,P=0.134)。FHA的转阳率经χ2检验,FHA抗体转阳率差异有统计学意义(χ2=24.296,P=0.000)。见表1。
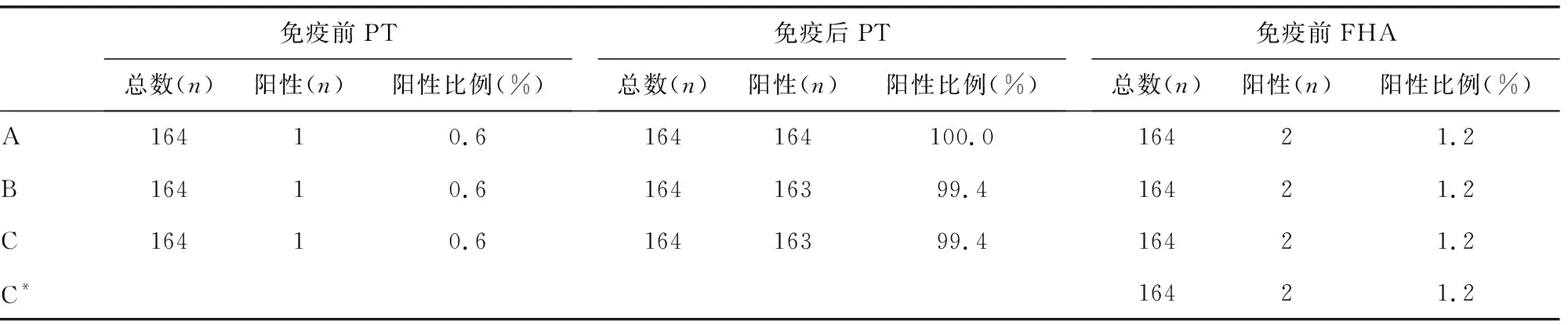
表1 不同ELISA体系检测转阳率比较
注:*表示有C2和C3 2个FHA抗原,C3抗原的FHA抗体检测结果单独列出
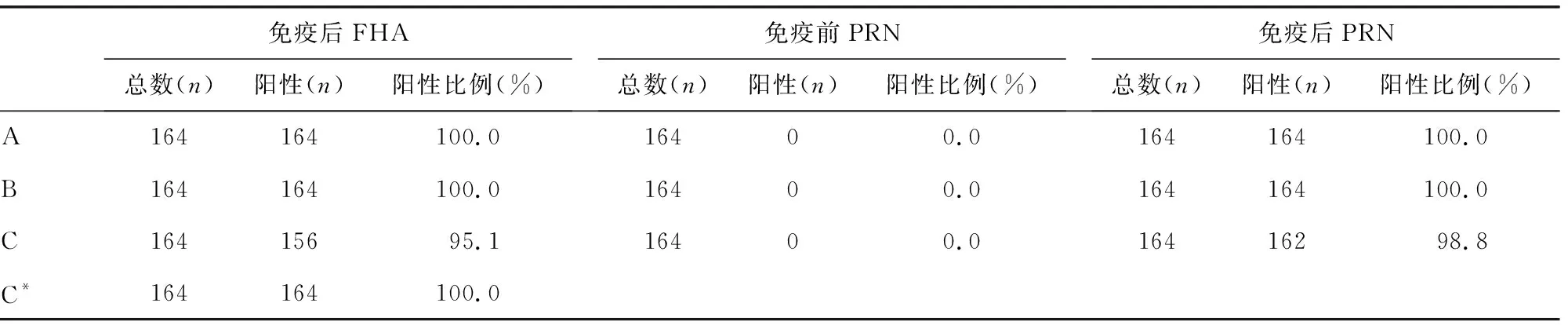
续表1 不同ELISA体系检测转阳率比较
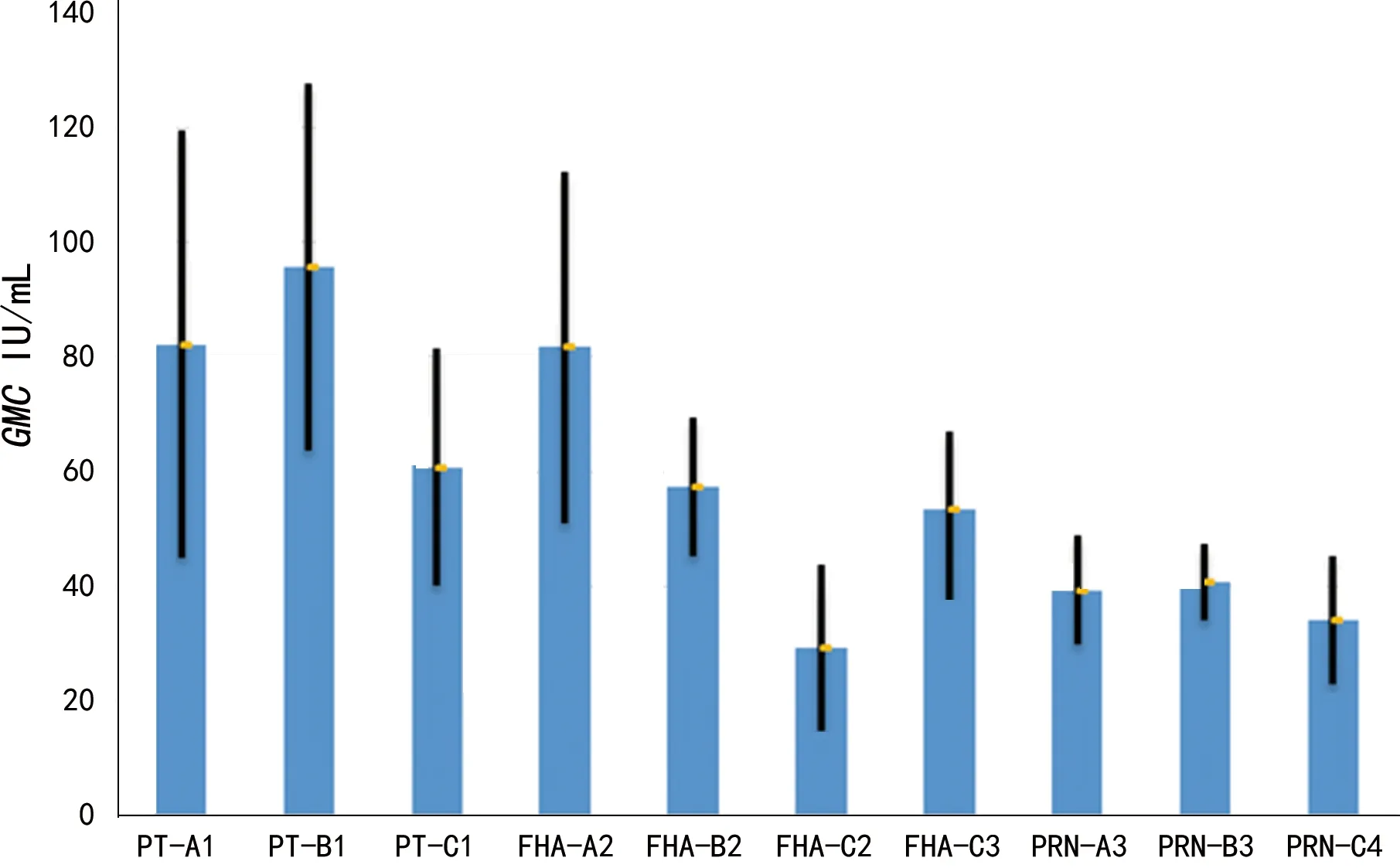
图1 不同ELISA检测体系GMC及置信区间
2.2.2不同抗原检测的抗体GMC水平及相关性分析 免疫前血清PT、FHA、PRN的GMC分别为2.52 IU/mL、2.09 IU/mL和1.17 IU/mL。免疫后血清PT抗体检测结果为A1(82.19 IU/mL)、B1(95.59 IU/mL)和C1(60.74 IU/mL)。免疫后血清FHA抗体检测结果为A2(81.66 IU/mL)、B2(57.39 IU/mL)、C2(29.33 IU/mL)和C3(53.32 IU/mL)。免疫后血清PRN抗体检测结果为A3(39.34 IU/mL)、B3(40.76 IU/mL)和C4(34.05 IU/mL),见图1。对免疫后血清PT、FHA和PRN结果分别进行方差分析。3组PT抗体检测结果之间差异有统计学意义(F=65.09,P<0.05),事后LSD-t检验两两结果之间差异有统计学意义(P<0.05)。4组FHA抗体检测结果之间差异有统计学意义(F=218.49,P<0.05),事后LSD-t检验B2和C3结果差异无统计学意义(P>0.05),其余两两结果之间差异有统计学意义(P<0.05)。3组PRN抗体检测结果之间差异有统计学意义(F=21.28,P<0.05),事后LSD-t检验A3和B3结果差异无统计学意义(P>0.05),其余两两结果之间差异有统计学意义(P<0.05)。
3 讨 论
国内共纯化DTaP疫苗生产均使用来源于中国食品药品检定研究院的百日咳CS株,国外DTacP疫苗生产使用百日咳Tohoma株,2种百日咳菌基因序列有一定区别[8]。公司A和中国食品药品检定研究院的ELISA检测用百日咳抗原均由CS株发酵后层析纯化得到,公司B ELISA检测用抗原由Tohoma株发酵后层析纯化得到。菌株、发酵条件、纯化工艺的不同意味着抗原结构可能有所不同。共纯化工艺中百日咳鲍特氏菌抗原混合脱毒,会导致不同抗原蛋白在戊二醛作用下互相交联形成复杂结构,其抗原表位与DTacP生产工艺中分别纯化脱毒的组分抗原的表位有着较大区别。抗原结构、抗原含量和佐剂含量的区别通常会导致共纯化百日咳疫苗临床血清与未经脱毒处理的纯化抗原结合,通常会弱于DTacP临床血清。本次临床血清检测使用的包被抗原中,A公司抗原为2017年新制备的液体保存抗原;B公司为2004-2006年制备的液体保存抗原;中国食品药品检定研究院PT-C1和FHA-C2均为2007年制备的冻干保存抗原,由于剩余量不足,FHA试剂已更换为2014年制备C3冻干抗原,PRN-C4为2016年制备的冻干抗原。使用中国食品药品检定研究院2种FHA试剂抗原检测临床血清结果和转阳率有显著性差异,表明FHA-C2与其他FHA抗原结构有较大区别,分析原因可能是我国10年间的纯化工艺改变导致FHA的结构发生了一定变化,对抗原抗体结合有一定影响。3组抗原在检测PT、FHA和PRN 3种抗体GMC之间差异有统计学意义。本研究结果说明同样的临床血清,同样的试验方法,同样的酶标二抗和显色底物的前提下,不同来源的PT、FHA、PRN抗原检测的IgG抗体GMC结果有显著性差异。因此,不同来源的百日咳抗原检测的人百日咳血清IgG抗体结果不具备直接可比性,转阳率略有差别,各个公司产品用本公司ELISA检测系统会得到更高的抗体结果和转阳率。为了使不同公司产品临床检测血清的检测结果更加客观、公平、公正和具有可比性,应统一推广使用中国食品药品检定研究院的C组ELISA系统进行检测。
2007年以来已发表的DTaP临床研究文献表明,以往采用ELISA方法检测不同公司在国内的临床血清样本时,国内公司通常使用中国食品药品检定研究院统一的包被抗原的试剂,而国外公司则使用本公司包被抗原[9-14]。共纯化DTaP只检测PT和FHA抗体,故未有PRN抗体相关的报道,PT抗体为33~97 IU/mL,FHA抗体为25~59 IU/mL。本研究结果显示PRN抗体为34.05 IU/mL,该结果可以对未来我国DTacP的临床试验提供参考数据。与国外公司DTacP临床结果相比,共纯化百日咳疫苗FHA抗体普遍存在较大差距,提示国内DTacP研发企业对此需要足够关注。
我国有10余家公司在研发DTacP和以此为基础的多联疫苗,已有5家公司取得临床批件。除了临床试验以外,基层医院和疾病预防控制中心部门都急需人百日咳血清抗体的检测以协助临床确诊病例。随着主动监测向县一级疾病预防控制中心部门的扩大,需要统一的百日咳组分标准抗原,配合我国己制备的人源百日咳抗血清国家参考品[15-16]。
4 结 论
建立标准化的人百日咳血清IgG抗体检测ELISA体系,将使我国临床试验和疾病监测结果更具有真实性和可比性,使百日咳血清诊断更加科学和规范。
