大豆分离蛋白及其不同酶法水解产物的特性对植脂末乳化稳定性的影响
2019-11-27梁贵江曾茂茂何志勇
梁贵江,曾茂茂,何志勇,秦 昉,陈 洁
(江南大学食品科学与技术国家重点实验室,江南大学食品安全国际合作联合实验室,江苏无锡 214122)
大豆蛋白作为一种常见的植物性蛋白,因其营养价值很高,同时价格低廉,从而成为人类重要的营养来源和工业原料。它具有乳化性、起泡性、凝胶性、热稳定性等重要性质,可用来制造传统食品及新型食品,使这些产品具有良好的组织结构及外观。植脂末是一种利用微胶囊技术将油脂用水溶性壁材包埋形成的粉末状产品,其具有制作工艺简单、稳定性好、营养丰富等特点,因而被广泛应用于配方奶粉、固体饮料、冰淇淋等食品体系中。
大豆分离蛋白(SPI)的乳化性质在许多食品中已有应用,但与食品工业中常用的酪蛋白酸钠相比,其乳化活性和乳化稳定性与酪蛋白酸钠相差甚远。提高大豆蛋白的乳化性,使其能够在植脂末等体系中应用,是大豆蛋白改造的一个热点方向之一。大量研究发现,结构改造例如大豆蛋白组分分离、热变性、有限水解等有利于提高大豆分离蛋白的乳化性[1-3]。报道显示,7S蛋白的乳化性质明显好于11S蛋白[4],7S蛋白疏水性较大,分子量较小,形成的乳状液比11S蛋白更加稳定[5-6]。研究发现,热处理过程中蛋白浓度、加热温度及时间对产物的结构和功能性质有很大影响,当热处理温度大于85 ℃时,大豆蛋白溶液经过短时间热处理后产物乳化性质提高[7]。木瓜蛋白酶等酶处理对大豆蛋白进行酶解,酶解产物的乳化能力和乳化稳定性明显提高[8]。胃蛋白酶由于在酸性条件下可以选择性水解11S蛋白,保留高表面活性的7S,11S水解产物也具有一定的表面活性,这种组合被认为有助于提高水解产物的乳化性[9]。然而,迄今为止,很少有人研究大豆分离蛋白和不同酶水解方式对其酶解产物乳化性以及在实际体系应用中的效果。
本论文对比研究了大豆分离蛋白及其不同酶法水解产物的组成和乳化性,并探讨了大豆分离蛋白及其不同酶法水解产物分别制备植脂末产品的微观结构以及乳状液稳定性。旨在为食品工业开发低成本、乳化性好的植脂末产品提供一定的理论和依据。
1 材料与方法
1.1 材料与仪器
东北大豆 黑龙江庆美种业有限公司;胃蛋白酶(3000 U/mg)、木瓜蛋白酶(2000 U/mg)生工生物工程(上海)股份有限公司;30%聚丙稀酰胺溶液(29∶1)、四甲基乙二胺(TEMED)、Nile Blue、Nile Red和考马斯亮蓝R250 Sigma-Aldrich公司;正己烷、无水乙醇、十二烷基硫酸钠(SDS)、氢氧化钠、三羟甲基氨基甲烷、甘氨酸、过硫酸铵、正己烷、无水乙醇、甲醇、冰乙酸和甘油 国药化学试剂有限公司。
JZ7114型粉碎机 上海朝阳微电机厂;RW20D型搅拌器、IKAT18型高速乳化均质机 德国IKA实验技术公司;UV-2800H型紫外可见光分光光度计 尤尼柯(上海)有限公司;Avanti J-26 XP高速离心机 美国Beckman公司;LGJ-25C型冷冻干燥机 北京四环科学仪器厂有限公司;601超级恒温水浴 江苏金坛市新航仪器厂;Mini-PROTEAN 3 Cell凝胶电泳仪 美国 Bio-Rad公司;TCS SP8激光扫描共聚焦显微镜 德国Leica公司;ATS AH-basic高压均质机 加拿大ATS公司;S3500激光粒度分析仪 美国Microtrac公司;Nano-ZS动态光散射仪 英国 Malvern公司;B-290小型喷雾干燥机 瑞士步琦(Buchi)公司;扫描电子显微镜(SU1510型) 日本日立公司。
1.2 实验方法
1.2.1 大豆分离蛋白(SPI)的制备 将大豆去皮、粉碎,在豆粉中加入3倍质量的正己烷搅拌浸提2 h,抽滤后得到脱脂豆粉。根据Puppo等[10]的方法用脱脂豆粉制备大豆分离蛋白(SPI)。脱脂豆粉加入蒸馏水(1∶10,w/v),使用2 mol/L NaOH将分散体调节至pH8,在室温下搅拌2 h,离心(10000×g,20 min)。用2 mol/L HCl将上清液调节至pH4.5静置30 min并离心(3300×g,10 min)。将离心获得的沉淀用蒸馏水(1∶5,v/v)复溶,并用2 mol/L NaOH调节至pH7.0,冷冻干燥即为大豆分离蛋白。
1.2.2 大豆分离蛋白(SPI)水解产物的制备 参照李伟伟[11]的方法,将大豆分离蛋白(SPI)溶于水,溶液浓度调节至7%(w/v),用2 mol/L HCl将SPI溶液调节至pH2.0,并在37 ℃下保温30 min。然后,将0.8%(w/w)的胃蛋白酶加入到溶液中,开始酶水解反应,在37 ℃下酶解3 h。通过用2 mol/L NaOH调节pH至7.0来终止反应,120 ℃加热20 s灭酶灭菌,冷却后用3300×g离心10 min,收集上清液即为水解产物,该产物用HPE表示。
将大豆分离蛋白(SPI)溶于水,溶液浓度调节至7%(w/v),调节 pH7.0,并在55 ℃下保温30 min,然后加入0.5%(w/w)木瓜蛋白酶,进行酶反应,反应过程中利用0.2 mol/L的 NaOH 溶液滴定来控制pH至7,酶解1 h后,沸水浴加热10 min终止反应,冷却后3300×g离心10 min,收集上清液即为水解产物,该产物用PA表示。
1.2.3 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE) 根据Liu等[12]的方法测定蛋白样品(SPI、HPE、PA)的电泳亚基组成,其中浓缩胶浓度4%,分离胶浓度12%,pH8.0 样品缓冲液,含有0.01 mol/L Tris-HCl,2% SDS,10%甘油和0.02%溴酚蓝。调节蛋白样品浓度为2 mg/mL,与等体积样品缓冲液混合,沸水浴加热3 min,冷却,上样量20 μL至上样槽,电泳结束后取出凝胶染色并脱色,用凝胶成像仪拍摄图片,并做电泳条带扫描分析。
1.2.4 分子量分布测定 参照He等[13]的方法,用高效液相色谱法来测定蛋白样品(SPI、HPE、PA)的分子量分布,使用KW-804蛋白凝胶柱(排阻极限106Da)和紫外检测器(检测波长280 nm)。流动相是0.05 mol/L pH7.0的磷酸盐缓冲液(含0.3 mol/L的NaCl),洗脱速率为1 mL/min。细胞色素c(12 kDa)、碳酸酐酶(29 kDa)、白蛋白(66 kDa)、醇脱氢酶(150 kDa)、淀粉酶(200 kDa)和甲状腺球蛋白(669 kDa)作为分子量标记用于校准曲线。样品浓度均为10 mg/mL,取10 μL进样分析。以出峰时间为横坐标,分子量取对数为纵坐标,标准曲线的方程为y=-0.4708x+6.6162,R2=0.9856。
1.2.5 乳化活性和乳化稳定性的测定 乳状液的制备 用待测样品蛋白(SPI、HPE、PA)浓度调节为5 mg/mL,再与大豆油以4∶1体积混合,用分散器13500 r/min分散2 min。在离烧杯底部0.5 cm处取20 μL新鲜制备的乳状液,加入到5 mL 0.1% SDS溶液中,混合均匀后在500 nm处测定吸光值,记为A0,乳状液静置30 min后采用相同的方法测定吸光值,记为A30,用0.1% SDS溶液作空白对照。根据Molina和Guo等人[14-15]的方法,乳化活性指标(EAI)和乳化稳定性指标(ESI)按照如下公式进行计算:
EAI(m2/g)=(2×T×A0×N)/[c×Φ×104];
ESI(%)=A30/A0×100
其中,T=2.303,N为稀释倍数,c为乳状液形成前蛋白质的浓度(g/mL),Φ为乳状液中油相的体积分数,Φ=25%。
1.2.6 植脂末的制备 主要原料为SPI、HPE、PA、氢化椰子油、葡萄糖浆和水。其中,蛋白含量8%(w/w),油脂含量为30%(w/w),葡萄糖含量为22%(w/w),纯水含量40%(w/w)。用分散器13500 r/min分散2 min,再经过高压均质机均质两遍,均质压力为30 MPa,最后进行喷雾干燥。喷雾干燥条件:进口温度180~200 ℃,出口温度90~95 ℃。
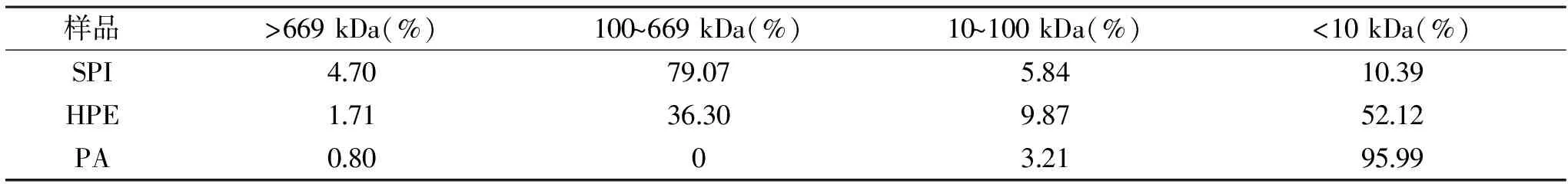
表1 大豆分离蛋白及其水解产物分子量分布Table 1 Molecular weight distribution of SPI and its hydrolysates
1.2.7 扫描电子显微镜 参照李伟伟[11]的方法,利用扫描电子显微镜观察植脂末粉末的微观结构,通过对颗粒的形状、分布进行分析,加速电压为5 kV,放大倍数1200倍。
1.2.8 共聚焦激光扫描显微镜(CLSM) 将制好的植脂末复溶于60 ℃的热水,配制2%(w/v)植脂末溶液,参照Zhang等人[16]的方法,将20 μL荧光染料(0.1% Nile Blue,0.01% Nile Red,乙醇配制)加入到 5 mL的植脂末溶液中,取10 μL乳状液滴到载玻片上,盖上盖玻片,指甲油密封,避光保存,用激光扫描共聚焦显微镜观察乳状液的微观结构,激发波长为633 nm。
1.2.9 平均粒径和ζ-电位的测定 参照程宇[17]的方法,将制好的植脂末复溶于60 ℃的热水,配制2%(w/v)植脂末溶液,样品用10 mmol/L pH7.0磷酸盐缓冲液稀释到浓度为0.001 wt%,采用激光粒度分析仪的Bluewave模式和马尔文Nano ZS型动态光散射仪的SOP模式分别测定样品的平均粒径和ζ-电位。
1.2.10 咖啡稳定性测试 将制好的植脂末粉末加入到200 mL的1%浓度的咖啡溶液中,其中混合温度为75 ℃,植脂末粉末与咖啡粉的比例为1∶2,分别观察0 h和放置24 h后的咖啡溶液的稳定性。
1.3 数据分析
每个样品设三个重复,采用Statistix 9.0软件对实验数据进行处理和分析,以P<0.05为差异显著。
2 结果与分析
2.1 大豆分离蛋白及其不同酶法水解产物的亚基组成
图1为大豆分离蛋白及其不同酶法水解产物亚基的组成。7S蛋白主要由α′,α和β三种亚基组成,11S蛋白主要由酸性亚基A和碱性亚基B组成。从电泳图可以看出,原始大豆蛋白大分子聚集体含量比较高,AB亚基聚集体含量也比较高;胃蛋白酶优先水解11S蛋白,胃蛋白酶水解产物中保留更多7S蛋白,同时产物中还保留了部分碱性亚基;木瓜蛋白酶水解产物主要为小部分碱性亚基条带和大量的小分子肽。

图1 大豆分离蛋白及其水解产物亚基组成的SDS-PAGE图Fig.1 SDS-PAGE patterns ofSPI and its hydrolysates subunits注:MW:分子量标记(Da);α′(86 kDa),α(66 kDa)和β(51 kDa);A,酸性亚基(34~43 kDa),B,碱性亚基(17~26 kDa)。
2.2 大豆分离蛋白及其不同酶法水解产物的分子量分布
表1表示大豆分离蛋白及其不同酶法水解产物的分子量分布。分子量分布与电泳结果比较吻合,SPI有少量聚集体,大部分的分子量集中在100~669 kDa,这个区间分布的主要是7S蛋白和11S蛋白。HPE只剩下7S蛋白,碱性亚基和小分子多肽,分子量主要集中在100~669 kDa和小于10 kDa。PA只剩下小部分碱性亚基和大量的小分子肽,分子量大部分集中在10 kDa以下区间。
2.3 大豆分离蛋白及其不同酶法水解产物的乳化活性和乳化稳定性
图2表示大豆分离蛋白及其不同酶法水解产物的乳化活性和乳化稳定性。从图2可知,HPE的乳化性质均比SPI有显著提高(P<0.05),乳化活性和乳化稳定性分别提高了22.7%和14.1%,而PA的乳化活性大幅度提高,但乳化稳定性显著低于SPI(P<0.05),乳化稳定性下降了17.6%。SPI的乳化活性较差,这是可能由于SPI中11S蛋白是由二硫键连接酸性亚基和碱性亚基而成的六聚体[18],结构紧凑,分子量较大,蛋白分子灵活性和表面疏水性较低,蛋白分子吸附到水-油界面上的速度慢,降低界面张力的能力弱。蛋白吸附到油-水界面的速度越快,并在界面上展开、重排和暴露疏水集团的能力越大,乳化活性就越强,乳化稳定性则与蛋白能否在油滴外围形成强度较大的刚性结构有关[19]。HPE乳化活性大幅度提高可能是由于其组成主要7S和碱性亚基,11S被水解后,蛋白的紧密结构展开、分解,促使疏水性基团的暴露,增加小分子量多肽,提高了分子灵活性,蛋白质分子能更迅速转移至油-水界面,有效降低表面张力,且大量存在的7S蛋白和碱性亚基可以在油滴外围形成高强度的刚性结构,有利于乳化稳定性的提高。PA的7S和11S蛋白都水解后,水解会释放出疏水基团,增加蛋白疏水性,有利于乳化性的提高,但由于小分子肽含量过多,分子量过小的蛋白在油-水界面无法形成刚性结构,所以乳化稳定性较差,形成的乳状液不稳定[20]。

图2 大豆分离蛋白及其水解产物的乳化活性和乳化稳定性Fig.2 Emulsifying activity and emulsionstability of SPI and its hydrolysates注:对于同一测定指标,不同字母表示差异显著(P<..05)。
2.4 大豆分离蛋白及其不同酶法水解产物对植脂末粉末及植脂末复水后乳液微观结构的影响
图3表示大豆分离蛋白及其不同酶法水解产物对植脂末粉末微观结构的影响。从图3可以看出,SPI和PA制备的植脂末颗粒粘结聚集现象较严重,而用HPE制备的植脂末颗粒都是球形,壁材完整,基本没有粘结聚集现象发生,颗粒分布较为均匀,这将有利于粉末在水中进行分散。

图3 植脂末粉末的扫描电子显微镜图Fig.3 SEM pattern of non-dairy creamer powder注:(a)SPI;(b)HPE;(c)PA。放大倍数1500倍。
图4表示大豆分离蛋白不同酶法水解产物对植脂末复水后乳液微观结构的影响。从图4可以看出,SPI形成的乳状液粒径较大,且容易发生絮凝和液滴聚集,这与Chen等报道的类似[21]。HPE形成的乳状液液滴很小,且分布均匀,没有发生絮凝,这与其很好的乳化活性和乳化稳定性非常吻合。PA形成的乳状液液滴虽然有少量的聚集,但优于SPI形成的乳状液,这也与PA乳化活性优于SPI但不如HPE的性质相吻合。

图4 复水乳液的激光共聚焦显微镜图Fig.4 CLSM pattern of emulsion after rehydration emulsion注:(A)SPI;(B)HPE;(C)PA。

图5 复水乳液的平均粒径和ζ-电位Fig.5 Average particle size andζ-potential of rehydration emulsion注:对于同一测定指标,不同字母表示差异显著(P<0.05)。
2.5 大豆分离蛋白及其不同酶法水解产物对植脂末复水后乳液的平均粒径和ζ-电位的影响
图5表示大豆分离蛋白及其不同酶法水解产物对植脂末复水后乳液的平均粒径和ζ-电位的影响。将制成的植脂末溶液放置0 h和6 h分别测量乳状液平均粒径的变化,复水后乳液HPE的平均粒径最小(SPI>PA>HPE),且6 h后的平均粒径几乎无变化,说明形成的乳状液很稳定。而SPI和PA的乳状液粒径6 h后变化较大,说明乳状液稳定性较差。复水乳液0 h和6 h后HPE的ζ-电位绝对值最大(HPE>PA>SPI),ζ-电位绝对值越高,粒子间排斥力越大,乳状液体系稳定性越高[22],ζ电位结果也进一步说明HPE形成的乳状液最稳定。
2.6 大豆分离蛋白及其不同酶法水解产物制备的植脂末对咖啡稳定性影响
图6表示大豆分离蛋白及其不同酶法酶解物制备的植脂末对咖啡稳定性影响。将不同酶法水解产物制备的植脂末加入热咖啡中,24 h后SPI最上层出现少量白色悬浮物,而HPE和PA呈现稳定的均一状态,上述结果暗示,两种酶解物可以有效提高产物乳化活性,未来可用于液态或者粉末态咖啡伴侣等体系的应用。

图6 植脂末加入咖啡中的稳定性Fig.6 Stability of adding non-dairy cream to coffee注:从左到右依次是SPI,HPE,PA。
3 结论
SPI胃蛋白酶水解产物中含有较多7S蛋白和小分子多肽,乳化活性和乳化稳定性比SPI均有显著提高;而木瓜蛋白酶水解物含有少量碱性亚基和大量小分子多肽,乳化活性比SPI显著提高但乳化稳定性显著下降;制备的植脂末微观结构和植脂末溶解后乳状液的微观结构也进一步证实了SPI胃蛋白酶水解产物制备的产品具有最好的乳化效果,咖啡稳定性结果显示,两种酶解物均可用于咖啡伴侣。如果酶解物中存在过多小分子肽,尽管分子柔性增加有利于界面快速成膜从而提高乳化活性,但由于难以形成刚性膜、界面膜强度不足,会不利于乳化稳定性;如果能够保留相对较多的7S蛋白和碱性亚基,则有助于形成更高强度的界面膜,从而使得乳化活性和乳化稳定性同步提高,从而有利于乳状液更加稳定。本研究为大豆蛋白在植脂末产品以及其他高乳化性需求产品中的应用提供了基础。
