高强UV/SO32-体系高效降解一氯乙酸
2019-11-27顾玉蓉董文艺董紫君唐建军
顾玉蓉,董文艺,董紫君*,唐建军
高强UV/SO32-体系高效降解一氯乙酸
顾玉蓉1,董文艺2,董紫君1*,唐建军1
(1.深圳职业技术学院建筑与环境工程学院,广东 深圳 518055;2.哈尔滨工业大学(深圳)土木与环境工程学院,广东 深圳 518055)
为有效解决饮用水中卤代乙酸(HAAs)污染问题,选取水中典型HAAs一氯乙酸(MCAA)作为目标污染物,系统研究了高强UV/SO32-体系对其降解效能及影响因素.结果表明,高强UV/SO32-体系可高效降解MCAA,50s内初始浓度为50 μmol/L的MCAA可被完全降解.与已报导的还原法降解MCAA的文献相比,本研究中MCAA降解速率提高了1000倍以上.提高SO32-浓度、溶液初始pH以及紫外光强均有利于体系中MCAA降解率的提高.水中共存物质研究表明,NH4+可促进MCAA降解,而NO3-、HCO3-、NOM均会抑制MCAA降解,其中,HCO3-影响较小.
卤代乙酸;一氯乙酸;SO32-
我国饮用水消毒以氯消毒为主,氯消毒可有效抑制致病微生物,同时伴随有消毒副产物(Disinfection By-products, DBPs)的产生.卤代乙酸(Haloacetic acids, HAAs)是DBPs的重要组成部分,其主要特征是羧酸链上含有1~3个卤原子.随着工农业的快速发展,大量HAAs被排入大气、水体、土壤等各类环境介质中[1].毒理学研究表明,饮用水中痕量HAAs(ng/L或μg/L级别)可对人类及生态系统造成严重的危害,引起致癌性、致突变性以及肝毒性等[2-3].多国政府已经对饮用水中HAAs含量作出了规定,如美国EPA在DBPs章程中强制规定了包含一氯乙酸(MCAA)、二氯乙酸(DCAA)、三氯乙酸(TCAA)、一溴乙酸(MBAA)、二溴乙酸(DBAA)在内的5种HAAs的最大含量不超过60μg/L[4].因此,有效控制饮用水中HAAs具有重要意义.
前期研究中,不少学者利用生物法降解HAAs,但生物法存在反应时间长、培养微生物条件严格等缺点,使得其难以运用于大规模HAAs的降解[4-5].理化方法降解HAAs被广泛研究,主要有高级氧化法、电化学法以及光化学等.C―X键是造成HAAs具有持久性和生物毒性的主要原因,因而打断C—X键是降解HAAs的关键所在.羟基自由基很难打断C―X键,因此高级氧化法处理HAAs效果不佳[6];而电化学法降解效能受电极材料影响较大,相较而言,光化学法降解HAAs更具优势.光化学法是利用光解产生活性物种来实现污染物降解的一种方法,被广泛用于水体中有机污染物的降解[7-8].考虑到卤原子属于吸电子基团,光还原降解HAAs具有可行性.
水合电子(Hydrated electron, eaq-)是一种强还原性物种,还原电势高达-2.9V,阴离子的光电离或电子转移溶剂过程(CTTS)是产生eaq-的有效方式之一[9].光解I-和SO32-均可产生eaq-,但I-对人存在健康威胁[10],SO32-作为一种常见的抗氧化剂及漂白剂,被广泛用于各类食品工业领域[11],因此,UV/SO32-体系常被用于产生eaq-,且已被用于降解三氯生、阿替诺尔、全氟辛烷磺酸等有机污染物[12-14],但该体系中eaq-量子产率较低(<0.2)[15];另一方面, eaq-的强还原性使得它与很多水中共存物种(如DO、NO2-、NO3-、H+等)都有很快的反应速率[16],最终导致用于目标污染物降解的eaq-数量极其有限,进而影响到目标污染物的降解效率.在前期应用eaq-降解污染物的研究中,研究者需要控制较高的溶液初始pH值(pH>12)或严格的厌氧环境来减少eaq-参与副反应[17-19],使得该技术难以用于实际废水处理.已有研究表明,在光化学反应中提高光强可增加eaq-产量[20].与低压、中压汞灯相比,高压汞灯一般具有更高的发射光强和更宽的发光光谱[21],因而可用于提高eaq-产量.基于上述认识,本研究选用高压汞灯作为反应光源,将高强度紫外光和SO32-结合,构建高强UV/SO32-体系增加eaq-的绝对产量,以实现温和反应条件下目标污染物的高效降解.本研究选取MCAA作为典型HAAs,系统研究该体系对HAAs的降解效能及相关影响因素,研究成果将为eaq-相关工艺高效降解持久性有机污染物提供理论指导.
1 材料与方法
1.1 实验材料
1.1.1 仪器与设备 氯乙酸浓度检测采用离子色谱仪(Dionex ICS-5000),其配置为:色谱柱为Dionex AS19(4mm×250mm),自动进样器为AS40,自动再生膜抑制器ASRS400,电导检测器CD.采用100mmol/ L的KOH溶液为淋洗液,设置流速1mL/min,抑制器电流50mA.溶液pH值采用pH计(Sartorius,PB-10)测定.本研究中高强度紫外光由高压汞灯提供,其光强采用草酸铁钾化学露光计法测定[22].
1.1.2 标准物质与试剂 氯乙酸纳(C2H2ClNaO2, MCAA,98%),无水亚硫酸钠(Na2SO3,98%),硫酸(H2SO4,98%),氢氧化钠(NaOH,97%),乙酸铵(C2H7NO2,99%),硝酸钠(NaNO3,99%),碳酸氢钠(NaHCO3,³99.8%),腐殖酸(HA,³90%)上述试剂均购自阿拉丁试剂有限公司,购买后直接使用.
1.2 实验装置
高强紫外光引发的降解实验在图1所示的装置中进行.该反应所采用的光源由一个高压汞灯(Ushio Inc, Japan)和一个石英反射罩构成,其直径为2cm,这样更有利于用反射罩将其发光汇聚到一点,从而达到更高光强.将高压汞灯与石英反射罩相结合后,其焦点处的光强0可达到6.67×10-7einstein cm-2s-1.反应过程中光强可调节,主要通过不同孔径密度的光筛来实现.高压汞灯主要发射波段为200~ 600nm,在实验过程中为避免反应器中温度迅速升高,采用滤光片将大于400nm的光过滤掉[21].
为了与高压汞灯的处理效果进行比较,本实验还采用了另外两种光化学反应中常用的低压汞灯: 254nm紫外灯(10W,Philips)和185nm紫外灯(11W,Philips).其中,185nm紫外灯即真空紫外灯,其主要发射的也是254nm波长的光,185nm波长的光仅占发射光总量的10%左右[23].这两种低压汞灯引发的光降解实验均在如图2所示的密闭双层管式反应器内进行,最外层反应器外部用铝箔包裹住,以防止紫外光对人体造成伤害以及外部光线进入反应器而影响反应精度.两种反应器外部都设有冷凝套管以维持反应液温度恒定,反应过程中采用磁力搅拌器搅拌溶液,使其混合均匀.

图1 高压汞灯装置示意
1.高压汞灯;2.石英反射罩;3.滤光片;4.敞口烧杯;5.转子;6.磁力搅拌器; 7.带电子计时器的滑动挡板;8.不同密度的光筛;9.冷却控制系统(外连恒温冷却槽)
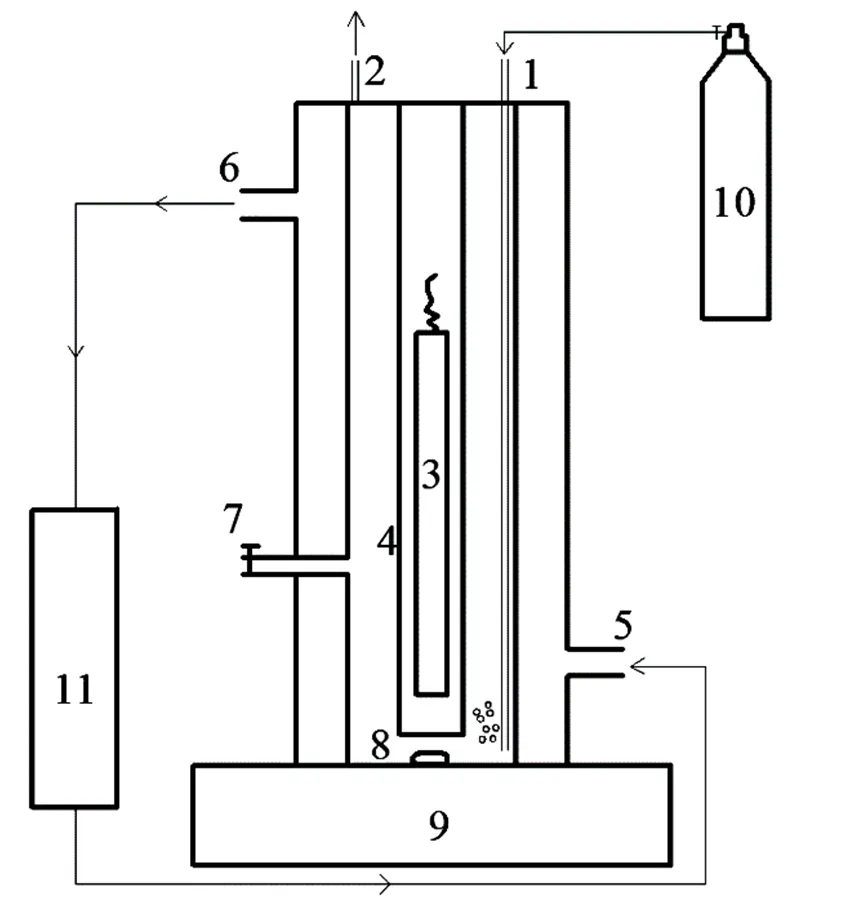
图2 低压汞灯装置示意
1.进气口;2.出气口;3.低压汞灯;4.石英套管;5.冷却水进口;6.冷却水出口;7.取样口;8.转子;9.磁力搅拌器;10.氮气瓶;11.恒温冷却槽
1.3 实验方法
MCAA降解实验在50mL的敞口烧杯中进行,实验过程中不控制DO(DO含量约5mg/L).反应开始前,向已配置完成的初始浓度为50μmol/L的1L MCAA溶液中加入0.252g Na2SO3(2.0mmol/L),搅拌30min.然后用H2SO4或NaOH调节反应溶液至所需pH值.准确量取25mL上述混合溶液至敞口烧杯中,并保持磁力搅拌器一直处于搅拌状态.反应开始前30min打开紫外灯电源进行预热,以便反应过程中紫外灯可提供稳定的发光.紫外光照实验开始并计时,按照预先设定的反应时间取样,待测.所有实验至少重复进行3次,水样平行检测,取平均值.
在光源的对比实验中,两种低压汞灯引发的MCAA光降解实验在如图2所示的反应器中进行.反应体积为800mL, MCAA和Na2SO3溶液的配置方法与上述一致.反应在N2气氛下进行, N2经内置进气口持续不断通入反应器中,气体流量设定为1.0L/min.
2 结果与讨论
2.1 MCAA光解体系比选
光解实验中MCAA的初始浓度为50μmol/L,溶液初始pH值为9.2,SO32-投加浓度为2.0mmol/L,溶液温度为(25±3)℃,实验结果如图3所示.
从图3可以看出,高压汞灯对MCAA的降解效果要远远强于两种低压汞灯,初始浓度为50μmol/L的MCAA经高压汞灯照射50s降解率可达100%,而185nm和254nm两种低压汞灯降解同样浓度的MCAA分别需要480s和600s.该实验结果表明,当eaq-激发剂相同时,高压汞灯体系可产生的eaq-数量要远远高于低压汞灯体系.两种低压汞灯的对MCAA的处理效果也存在差异.其中,185nm的低压汞灯处理效果略优于254nm的低压汞灯,这可能是由于185nm的VUV光解纯水也可产生部分eaq-[24],导致其总体eaq-产量高于254nm紫外光,因而处理效果更好.但是,185nm的低压汞灯主要发射的紫外光仍然是254nm,其中185nm的真空紫外光所占比例仅为10%左右[23],并且真空紫外光很容易被水吸收[24],因此,eaq-产量的提升并不特别明显.根据图3结果,确定选用高压汞灯作为反应光源,构建高强UV/SO32-体系降解MCAA,后续研究均采用该反应体系.

图3 紫外光源对MCAA降解的影响

表1 本研究与已报导的MCAA还原降解方法的比较
将本研究与之前报导的还原法降解MCAA的文献进行比较,如表1所示,本研究中MCAA的降解速率提高了1000倍以上,这充分说明本研究体系中产生了大量eaq-,再次验证了高强UV/SO32-体系可高效降解MCAA.
2.2 MCAA光解影响因素
2.2.1 SO32-浓度的影响 实验条件如下:MCAA浓度为50μmol/L,溶液初始pH为9.2,高压汞灯光强为6.67×10-7einstein/(s×cm2),溶液温度为(25±3)℃, SO32-投加浓度为0.5,1.0,1.5,2.0,3.0mmol/L,结果如图4所示.

图4 SO32-浓度对MCAA降解的影响
从图4可以看出,随着SO32-投加浓度的增加, MCAA的降解效果明显增强.当SO32-的投加浓度仅为0.5mmol/L时,经60s紫外光照,MCAA的降解率为30.2%;当SO32-浓度增加至2.0mmol/L时,反应50s后,50μmol/L的MCAA可以完全被降解;继续增加SO32-浓度至3.0mmol/L时,完全降解MCAA所需时间由50s进一步缩短至40s.增加SO32-浓度,经紫外光照反应产生的eaq-将随之增加,从而增大了eaq-与溶液中MCAA分子有效接触反应的几率(式(1)~(2)),因此MCAA的降解效果变得更好.后续实验中选择SO32-浓度为2.0mmol/L来考察其他水质条件对MCAA降解的影响.
SO32-+ hν → eaq-+ SO3∙-(1)
eaq-+ CH2ClCOO-→ ∙CH2COO-+ Cl-(2)
如表2所示,本研究的SO32-浓度范围内,eaq-对MCAA的降解反应符合假一级动力学模型(2> 0.90).MCAA降解的假一级反应速率常数obs也随着SO32-浓度的增加而增加.当SO32-浓度由0.5mmol/ L升高至2.0mmol/L,obs提高了近12倍,而MCAA降解的半衰期也相应的减小了一个数量级.
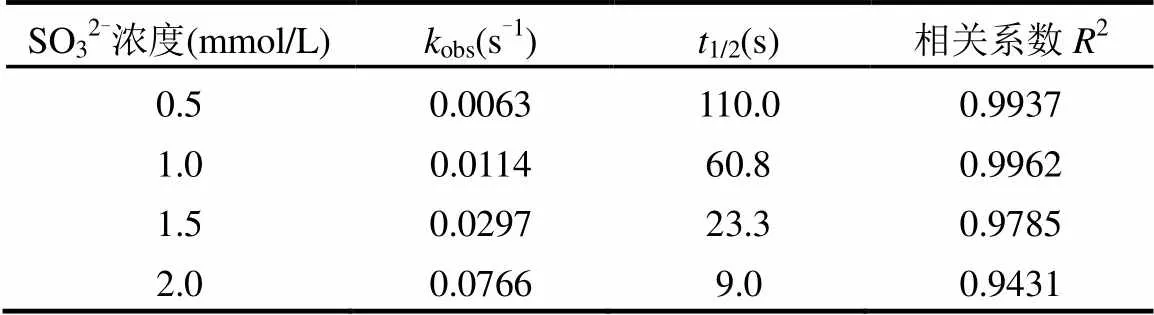
表2 不同SO32-浓度时MCAA降解的假一级反应参数
2.2.2 溶液初始pH的影响 亚硫酸(H2SO3)作为一种二元酸(H2SO3= HSO3-+H+,pa1= 1.76; HSO3-= SO32-+ H+,pa2= 7.20)[28],溶液pH值的不同必然会引起各离子组分的含量发生改变,进而影响到光解反应产生的eaq-产量.本节考察了不同溶液初始pH情况下MCAA的降解情况,具体实验条件如下: MCAA浓度为50 μmol/L, SO32-浓度为2.0mmol/L,高压汞灯光强为6.67×10-7einstein/s cm2,溶液温度为(25±3)℃,溶液初始pH值分别调节为6.0、7.0、8.0、9.2、10.2,实验结果如图5所示.
由图5可知,MCAA的降解效果随着溶液初始pH的升高而增强.当溶液初始pH值为6.0时, MCAA完全不降解; pH值由7.0升高至9.2时,经接触反应30s, MCAA降解率由3.4%显著提高至81.4%;继续增加溶液初始pH, MCAA的降解效果仅有微弱的上升趋势.
溶液初始pH对eaq-产量的影响主要源于其对亚硫酸盐组分分配的影响.利用Visual Minte软件计算出不同pH条件下亚硫酸盐溶液中的离子分布,结果如图6所示.由图可知,当溶液pH值小于2时,亚硫酸盐主要以H2SO3形式存在;pH值位于2~7之间时,亚硫酸盐主要以HSO3-形式存在;而当pH值大于7时,SO32-是最主要的存在形式.SO32-和HSO3-经紫外光照分别可发生式(1)和(3)的反应.由式(3)可知,HSO3-光照反应产物为∙H和SO3-.相关研究表明,∙H和SO3∙-均不能引起MCAA降解[21].因此,在本研究中,当溶液初始pH值小于7.0时, MCAA降解效果较差.随着pH值的增加,溶液中SO32-组分的比例有所提高,经式(1)产生的eaq-量也随之提高,因而MCAA的降解效果显著提高.当pH值达到9.2时,溶液中SO32-组分所占比例超过99%,继续增大pH值对亚硫酸盐组分的改变意义不大,因此,将pH值从9.2提高至10.2, MCAA降解效果仅有微弱的增强.
但图6中亚硫酸盐组分的分布不能很好的解释中性pH条件下MCAA的降解效果.按照图6中亚硫酸盐的组分分布, pH值为7.0时,SO32-组分所占比例约为pH值10.2时的一半,则MCAA处理效果应当为50%左右,而实际的MCAA降解率仅为3%.这主要是因为在中性pH条件下,大量的eaq-被转化为∙H(式4);而在碱性条件下,由于较低的H+含量以及式(5)的存在,∙H的生成量被大大的限制.Li等[29]经计算指出,pH为7.1时,52% eaq-会转化为∙H.
HSO3-+hν→∙H+SO3-(3)
eaq-+H+→∙H (4)
∙H+OH-→eaq-+H2O (5)

图5 溶液初始pH对MCAA降解的影响

图6 不同pH条件下亚硫酸盐的组分分布
溶液pH对反应中亚硫酸盐组分分配有重要影响,进而影响到MCAA降解效率,因此,实验对各初始pH条件下反应过程中的pH进行实时监测.由图7可知,当初始pH值低于7.0时,反应过程中pH几乎不变,而当pH值高于7.0时,反应过程中pH随时间增加而增加,特别在反应30s左右, pH显著增加.这可能与MCAA在体系中的降解机制相关.
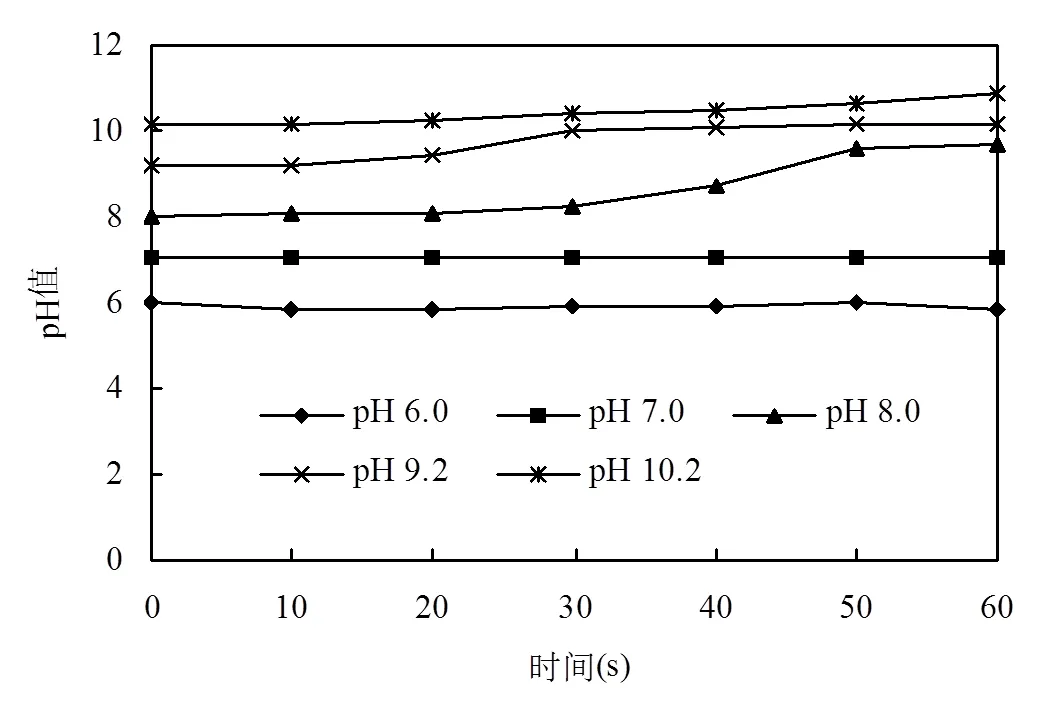
图7 不同溶液初始pH条件下体系中pH值变化
2.2.3 光强的影响 在光化学反应中,光强决定了单位时间内光源能提供的光子数,因而成为影响反应速率的重要因素之一.在MCAA浓度为50μmol/L,SO32-浓度为2.0mmol/L,溶液初始pH为9.2,溶液温度为(25±3) ℃,利用不同孔径密度的光筛调节高压汞灯的光强分别为15%0、30%0、50%0、75%0和100%0,其中,0表示高压汞灯可提供的最大光强[6.67×10-7einstein/(s×cm2)],实验结果如图8所示.
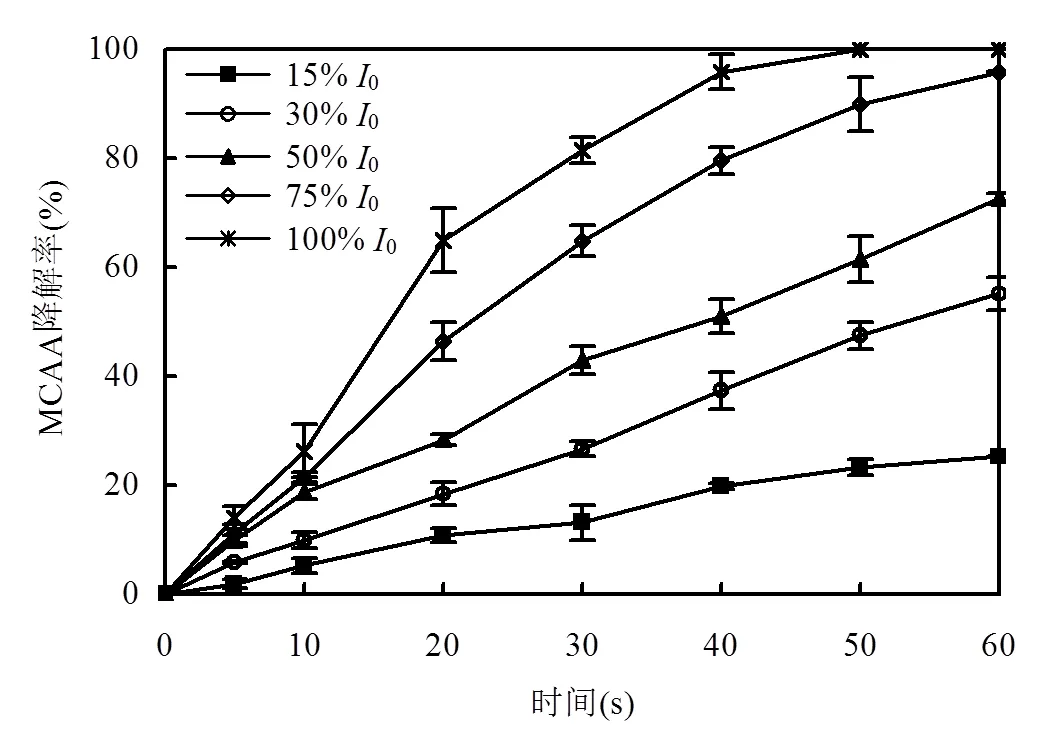
图8 光强对MCAA降解的影响
从图8中可以看出,MCAA的降解效果随着高压汞灯光强的提高而显著增强.当高压汞灯光强由15%0提高至100%0,经紫外光照30s, MCAA的降解率从13.1%逐渐提高至81.4%.Song等人通过模拟计算,发现当低压汞灯光照SO32-时,eaq-产量和光强成正比关系[30].
对MCAA的降解数据进行假一级动力学拟合,结果如表3所示.该拟合结果表明,随着高压汞灯光强的提高,MCAA的降解速率显著加快.当光强由15%0提高至75%0,MCAA降解的假一级反应速率常数obs提高了近8倍.另外,当反应光强位于15%0~50%0范围内时, MCAA的降解很好的符合假一级动力学模型;继续增加反应光强至100%0, MCAA的降解对假一级动力学模型的符合程度有所下降.Ollis等人发现在光催化反应中,光强与反应速率间存在三种关系:在低光强(0<25mW/cm2)范围内,光催化反应速率与光强成线性关系,即∝;当光强增加到一定值时,光催化反应速率与光强的平方根成线性关系,即∝0.5;当进一步提高反应光强,反应速率将不随光强的变化而变化,即∝0[31].类似的规律可能也适用于光还原反应体系,如本研究中的高强UV/SO32-体系.
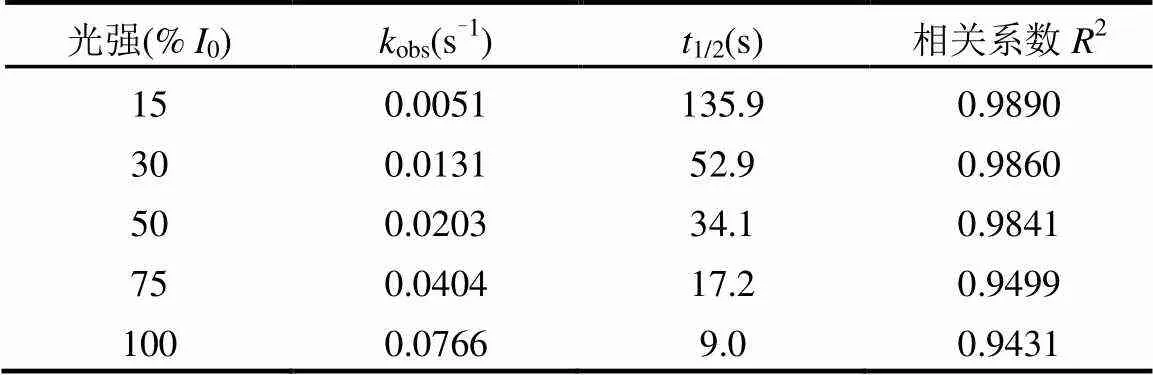
表3 不同光强时MCAA降解的假一级反应参数
本研究中获得的高光强是因为使用了高压汞灯作为反应光源.对普通低压、中压汞灯与高压汞灯进行对比,如表4所示,发现高压汞灯比低压、中压汞灯光强一般高出2~3个数量级.在本研究体系中,通过使用高压汞灯获得了高光强.
2.2.4 共存物质的影响 实际废水中往往各类物质共存,包括无机离子、有机物等.本节选取了水中常见的几种物质,包括NH4+、NO3-、HCO3-、天然有机物(NOM)等,考察它们对高强UV/SO32-体系降解MCAA的影响.实验条件为:MCAA浓度为50μmol/L, SO32-浓度为2.0mmol/L,溶液初始pH为9.2,溶液温度为(25±3)℃,高压汞灯光强为6.67×10-7einstein/(s×cm2),3种无机离子的投加范围均设定为0~ 1.0mmol/L,选取腐殖酸作为天然有机物(NOM)的代表,腐殖酸投加浓度以溶解性有机碳(DOC)计,浓度范围为0~5.4mg/L,实验结果如图9~10所示.
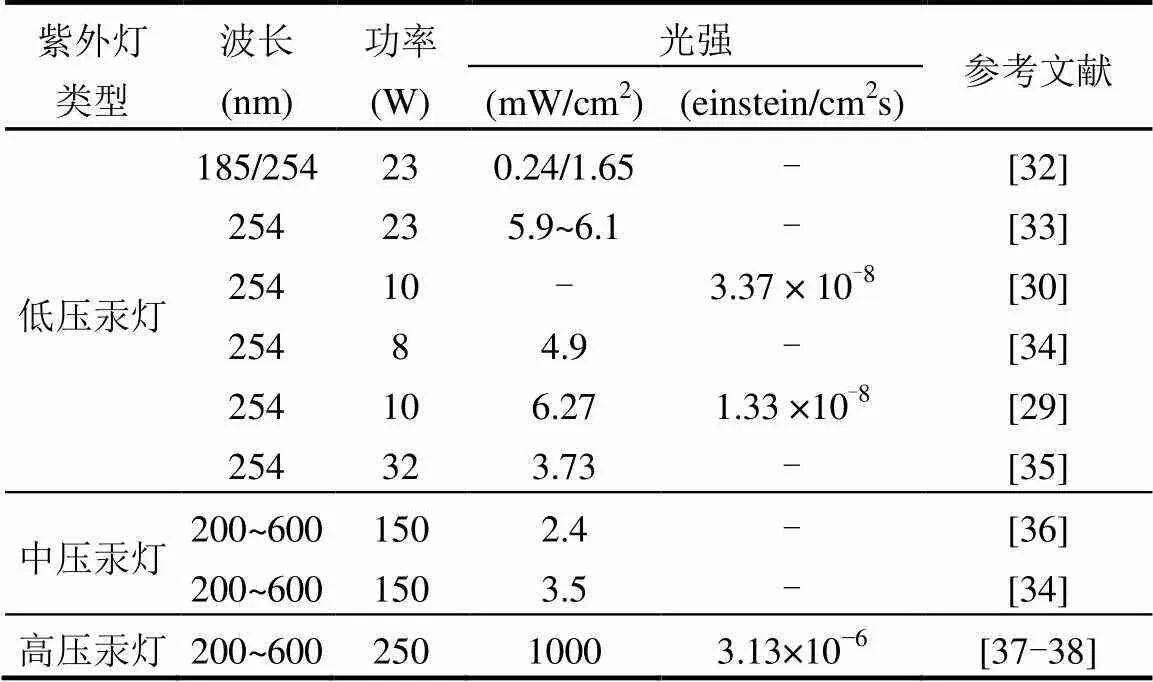
表4 低压、中压及高压汞灯各参数对比
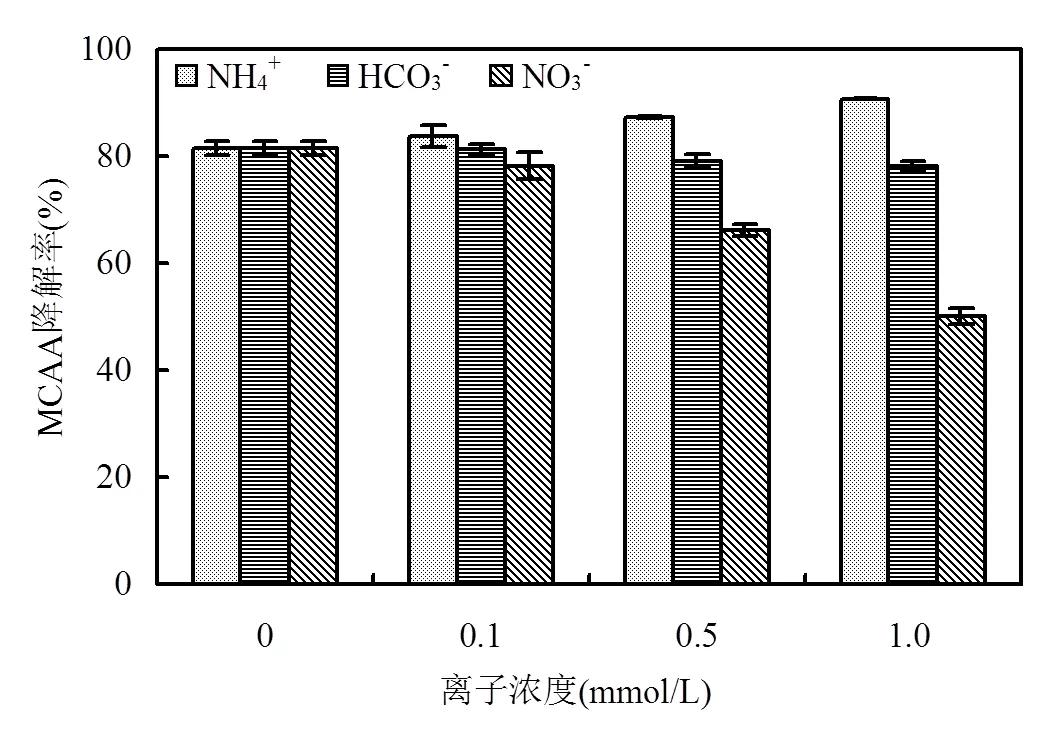
图9 无机离子对MCAA降解的影响
由图9可知,NO3-和HCO3-的投加均对MCAA的降解存在抑制作用,且随着投加浓度的增加,抑制效果更加显著.其中,NO3-的抑制作用较为明显, HCO3-的影响较小;此外,NH4+的投加可促进MCAA的降解.
当体系中有NO3-共存时,MCAA的降解受到明显抑制,这是因为NO3-与MCAA竞争eaq-造成的. NO3-对eaq-具有较强的捕获作用,与其反应生成(NO3∙)2-,继而发生一系列链式反应,如反应式(6)~(8)所示.且NO3-与eaq-的反应速率约为MCAA与eaq-反应速率的10倍[16],因此,NO3-的投加对MCAA的降解表现出明显的抑制作用.如图9所示,当NO3-投量从0增加至1.0mmol/L时, MCAA的降解率从81.4%下降至50.1%.
当体系中有HCO3-共存时, MCAA的降解受到微弱的抑制,其降解率始终保持在78.1%~81.4%范围内波动. MCAA降解受到的抑制作用可能也是因为HCO3-和MCAA对eaq-存在竞争作用.由图9可知, HCO3-的投加对MCAA的降解影响较小.这是因为HCO3-与eaq-的反应速率小于106L/(mol×s)[16],比MCAA与eaq-的反应速率小至少3个数量级,因而其影响可忽略不计.至于NH4+,有研究指出,水溶液中的铵类物质可以增强eaq-的瞬态吸收光谱[39],进而可能增加eaq-产量,使得有更多eaq-可用于污染物降解.因此,当NH4+投加浓度从0增加至1.0mmol/L, MCAA的降解率从81.4%逐渐升高至90.7%.
eaq-+NO3-→(NO3∙)2-=9.7×109L/(mol×s) (6)
(NO3∙)2-+H2O→(NO3H)∙-+OH-(7)
(NO3H)∙-→NO2∙+OH-(8)

图10 NOM对MCAA降解的影响
由图10可知,水中NOM的存在对MCAA降解有明显的抑制作用.当NOM投加浓度从0增加至5.4mg/L DOC时, MCAA的降解率下降了28.7%. NOM分子中的苯环上含有大量羟基、羧基和羰基等官能团,这些官能团易于吸收光子而发生光解反应. Thomas-Smith[40]及Zeep等[41]均指出,自然水体中的溶解性有机物在紫外光条件下可产生eaq-,但产率较低,一般处于10-4~10-6数量级.这也就造成了NOM与SO32-竞争光子,而NOM光解反应的eaq-产率远远低于SO32-[15],因此会造成反应体系中eaq总体产量减少.另一方面,NOM经光解反应可能会产生一些氧化性的活性物种,如∙OH、1O2和H2O2等,这些活性物种可能会氧化eaq-,甚至NOM自身也会与eaq发生反应[42],这些原因均会造成体系中eaq-产量减少,进而导致MCAA降解率有所下降.
3 结论
3.1 高压汞灯和SO32-的组合,即高强UV/SO32-体系,可高效降解MCAA.相较于普通的低压汞灯,高压汞灯体系中50μmol/L的MCAA完全降解所需时间由600s缩短至50s.
3.2 提高SO32-浓度有利于提高体系中MCAA降解速率,当SO32-浓度由0.5mmol/L增加至2.0mmol/L时,MCAA降解的半衰期减小了一个数量级.
3.3 增加溶液初始pH有利于提高体系中MCAA降解速率,主要由两方面原因引起:pH对亚硫酸盐组分分配的影响和对eaq-与∙H之间转化反应的影响.
3.4 提高光强有利于提高体系中MCAA降解速率,使用高压汞灯作为反应光源是本研究获得高光强的关键所在.
3.5 水中共存物质的研究表明,NH4+可促进MCAA降解,而NO3-、HCO3-、NOM均会抑制MCAA降解,其中,HCO3-影响较小.
[1] Hanson M, Solomon K. Haloacetic acids in the aquatic environment. Part I: macrophyte toxicity [J]. Environmental Pollution, 2004,130:371-383.
[2] Pals J, Ang J, Wagner E, et al. Biological mechanism for the toxicity of haloacetic acid drinking water disinfection byproducts [J]. Environmental Science & Technology, 2011,45:5791–5797.
[3] Attene-Ramos M, Wagner E, Plewa M. Comparative human cell toxicogenomic analysis of monohaloacetic acid drinking water disinfection byproducts [J]. Environmental Science & Technology, 2010,44:7206-7212.
[4] Grigorescu A, Hozalski R, la Para T. Haloaceticacid-degrading bacterial communities in drinking watersystems as determined by cultivation and by terminalrestriction fragment length polymorphism of PCR-amplifiedhaloacid dehalogenase gene fragments [J]. Journal of Applied. Microbiology, 2012,112:809-822.
[5] Pluchon C, Serodes J, Berthiaume C, et al. Haloacetic acid degradation by a biofilm in a simulated drinking water distribution system [J]. Water Science. Technology-Water Supply, 2013,13:447–461.
[6] Tang H, Xiang Q, Lei M, et al. Efficient degradation of perfluorooctanoic acid by UV- Fenton process [J]. Chemical Engineering Journal, 2012,184(3):156-162.
[7] 肖 扬,罗 敏,马玲玲,等.电子束辐照降解水体中的金霉素[J]. 中国环境科学, 2019,39(2):625-633. Xiao Y, Luo M, Ma L L, et al. Degradation of chlorotetracycline by electron beam irradiation in aqueous solution [J]. China Environmental Science, 2019,39(2):625-633.
[8] 古振川,高乃云,安 娜,等. Cl-/PMS降解甲氧苄啶的效能与机理[J]. 中国环境科学, 2018,38(3):977-984. Gu Z C, Gao N Y, An N, et al. Efficiency and mechanism of trimethoprim degradation in Cl-/PMS system [J]. China Environmental Science, 2018,38(3):977-984.
[9] Merino N, Qu Y, Deeb R, et al. Degradation and removal methods for perfluoroalkyland polyfluoroalkyl substances in water [J]. Environmental Engineering Science, 2016,33(9):615-649.
[10] Harach H, Escalante D, Day E. Thyroid cancer and thyroiditis in Salta, Argentina: A 40-yr study in relation to iodine prophylaxis [J]. Endocrine Pathology, 2002,13(3):175-181.
[11] 周德庆,张双灵,辛胜昌.亚硫酸盐在食品加工中的作用及其应用[J]. 食品科学, 2004,25(12):198-201. Zhou D Q, Zhang S L, Xin S C. Review on function and application of sulfite in food processing [J]. Food Science, 2004,25(12):175-181.
[12] Liu X W, Zhang T Q, Wang L L, et al. Hydrated electron-based degradation of atenolol in aqueous solution [J]. Chemical Engineering Journal, 2015,260:740-748.
[13] Zhang Z J, Wang X N, Xue Y C, et al. Enhanced dechlorination of triclosan by hydrated electron reduction in aqueous solution [J]. Chemical Engineering Journal, 2015,263:186-193.
[14] Tian H T, Gu C. Effects of different factors on photodefluorination of perfluorinated compounds by hydrated electron in organo- montmorillonite [J]. Chemosphere, 2018,191:280-287.
[15] Sauer M C, Crowell R A, Shkrob I A. Electron photodetachment from aqueous anions. 1. Quantum yields for generation of hydrated electron by 193 and 248nm laser photoexcitation of miscellaneous inorganic anions [J]. Journal of Physical Chemistry A, 2004,108:5490-5502.
[16] Buxton G, Greenstock C, Helman P, et al. Critical review of rate constants for reactions of hydrated electrons,hydrogen atoms and hydroxyl radicals (∙OH/∙O- in aqueous solution [J]. Journal of Physical and Chemical Reference Data, 1988,17(2):513-886.
[17] Wang Y, Zhang P. Effects of pH on photochemical decomposition of perfluorooctanoic acid in different atmospheres by 185nm vacuum ultraviolet [J]. Journal of Environmental Sciences, 2014,26:2207-2214.
[18] Park H, Vecitis C, Cheng J, et al. Reductive defluorination of aqueous perfluorinated alkyl surfactants:effects of ionic headgroup and chain length [J]. The Journal of Physical Chemistry A, 2009,113(4):690-696.
[19] Qu Y, Zhang C, Li F, et al. Photo-reductive defluorination of perfluorooctanoic acid in water [J]. Water Research, 2010,44(9):2939-2947.
[20] Fischer A M, Kliger D S, Winterle J S, et al. Direct observation of phototransients in natural waters [J]. Chemosphere, 1985,14(9):1299-1306.
[21] Gu Y R, Dong W Y, Luo C, et al. Efficient reductive decomposition of perfluorooctanesulfonate in a high photon flux UV/sulfite system [J]. Environmental Science & Technology, 2016,50(19):10554-10561.
[22] Hatchard C, Parker C. A new sensitive chemical acinometer II potassium ferrioxalate as a standard chemical actinometer [J]. Proceedings of the Royal Society A, 1956,235:518-536.
[23] Yang S, Sun J, Hu Y, et al. Effect of vacuum ultraviolet on ultrasonic defluorination of aqueous perfluorooctanesulfonate [J]. Chemical Engineering Journal, 2013,234:106-114.
[24] Liu Y, Wang Q, Pan J. Novel process of simultaneous removal of nitric oxide and sulfur dioxide using a vacuum ultraviolet (VUV)-activated O2/H2O/H2O2system in a wet VUV-spraying reactor [J]. Environmental Science & Technology, 2016,50(23):12966-12975.
[25] Wang X, Ning P, Liu H, et al. Dechlorination of chloroacetic acids by Pd/Fe nanoparticles:effect of drying method on metallic activity and the parameter optimization [J]. Applied Catalysis B:Environmental, 2010,94(1/2):55-63.
[26] Li A, Zhao X, Hou Y, et al. The electrocatalytic dechlorination of chloroacetic acids at electrodeposited Pd/Fe-modified carbon paper electrode [J]. Applied Catalysis B: Environmental, 2012,111-112:628-635.
[27] Tang S, Wang X, Mao Y, et al. Effect of dissolved oxygen concentration on iron efficiency: Removal of three chloroacetic acids [J]. Water Research, 2015,73:342-352.
[28] Tartar H, Garretson H. The thermodynamic ionization constants of sulfurous acid at 25oC [J]. Journal of the American Chemical Society, 1941,63:808-816.
[29] Li X, Ma J, Liu G, et al. Efficient reductive dechlorination of monochloroacetic acid by sulfite/UV process [J]. Environmental Science & Technology, 2012,46(13):7342-7349.
[30] Song Z, Tang H, Wang N, et al. Reductive defluorination of perfluorooctanoic acid by hydrated electrons in a sulfite-mediated UV photochemical system [J]. Journal of Hazardous Materials, 2013,262:332-338.
[31] Ollis D, Pelizzetti E, Serpone N. Photocatalyzed destruction of water contaminants [J]. Environmental Science & Technology, 1991,25(9): 1522-1529.
[32] Jin L, Zhang P. Photochemical decomposition of perfluorooctane sulfonate (PFOS)in an anoxic alkaline solution by 185nm vacuum ultraviolet [J]. Chemical Engineering Journal, 2015,280:241-247.
[33] Wang Y, Zhang P. Photocatalytic decomposition of perfluorooctanoic acid (PFOA) by TiO2in the presence of oxalic acid [J]. Journal of Hazardous Materials, 2011,192(3):1869-1875.
[34] Jung B, Nicola R, Batchelor B, et al. Effect of low- and medium-pressure Hg UV irradiation on bromate removal in advanced reduction process [J]. Chemosphere, 2014,117:663-672.
[35] Yamamoto T, Noma Y, Sakai S, et al. Photodegradation of perfluorooctane sulfonate by UV irradiation in water and alkaline 2-propanol [J]. Environmental Science & Technology, 2007,41(16):5660-5665.
[36] Yoon S, Han D, Liu X, et al. Degradation of 1,2-dichloroethane using advanced reduction processes [J]. Journal of Environmental Chemical Engineering, 2014,2:731-737.
[37] Zhang Q, Li C, Li T. Rapid photocatalytic degradation of methylene blue under high photon flux UV irradiation: characteristics and comparison with routine low photon flux [J]. International Journal of Photoenergy, 2012,2012(3):251-268.
[38] Zhang Q, Li C, Li T. Rapid photocatalytic decolorization of methylene blue using high photon flux UV/TiO2/H2O2process [J]. Chemical Engineering Journal, 2013,217:407-413.
[39] Lyu X, Li W, Lam P, et al. Photodegradation of perfluorooctane sulfonate in environmental matrices [J]. Separation and Purification Technology, 2015,151(13):172-176.
[40] Thomas-Smith T, Blough N. Photoproduction of hydrated electron from constituents of natural waters [J]. Environmental Science & Technology, 2001,35(13):2721-2726.
[41] Zeep R. Photoproduction of hydrated electrons from natural organic solutes in aquatic environments [J]. Environmental Science & Technology, 1987,21(5):485-490.
[42] Huang L, Deng W, Hou H. Investigation of the reactivity of hydrated electron toward perfluorinated carboxylates by laser flash photolysis [J]. Chemical Physics Letters, 2007,436(1-3):124-128.
Efficient decomposition of monochloroaceticaid in the high intensity UV/sulfite system.
GU Yu-rong1, DONG Wen-yi2, DONG Zi-jun1*, TANG Jian-jun1
(1.School of Construction and Environmental Engineering, Shenzhen Polytechnic, Shenzhen 518055, China;2.School of Civil and Environmental Engineering, Harbin Institute of Technology (Shenzhen), Shenzhen 518055, China)., 2019,39(11):4722~4729
Monochloroacetic acid (MCAA), a typical aqueousHAAs, was selected as the target pollutant to solve the problem of HAAs pollution in drinking water. MCAA decomposition efficiency and its influencing factors in the high intensity UV/sulfite system were systematically investigated. The results showed efficient MCAA decomposition in the high intensity UV/sulfite system was obtained. MCAA was completely decomposed at its initial concentration of 50μmol/L in 50s. Compared with reportedly literatures related to reductive MCAA decomposition, MCAA decomposition rate in this study was increased above 1000 folds. Increase of sulfite dosage, initial solution pH and UV intensity was found beneficial for increasing MCAA decomposition efficiency in the studied system. Results on co-exsisting constitutents revealed that NH4+can promote MCAA decomposition, whereas NO3-, HCO3-and NOM all inhibited MCAA decomposition. Amongst them, HCO3-showed less inhibition effect.
HAAs;MCAA;sulfite
X703
A
1000-6923(2019)11-4722-08
顾玉蓉(1990-),女,江苏如东人,讲师,博士,主要从事持久性污染物降解研究.发表论文10余篇.
2019-04-29
国家水体污染控制与治理科技重大专项(2015ZX07206-006);深圳市基础研究项目(JCYJ20170306144117642);深圳职业技术学院校级项目(6019310013K)
* 责任作者, 副教授, 75976469@qq.com
