凡纳滨对虾低温差异表达miRNA的分析鉴定及靶基因的验证
2019-11-26卓晓菲何苹萍韦嫔媛陈晓汉彭金霞
卓晓菲 何苹萍 韦嫔媛 陈晓汉 彭金霞
(1. 广西大学动物科学技术学院, 南宁 530004; 2. 广西壮族自治区水产科学研究院, 广西水产遗传育种与健康养殖重点实验室, 南宁 530021)
凡纳滨对虾(Litopenaeus vannamei)是世界上养殖最广泛的对虾种类之一。在养殖对虾时, 不同的环境胁迫因子, 包括盐度、pH和温度的变化, 会导致其生长和存活率降低, 增加疾病的易感性, 甚至导致死亡[1,2]。凡纳滨对虾起源于热带, 后被推广至亚热带地区养殖, 低温对其生存及生长造成极大的影响[3]。目前关于南美白对虾应对低温反应分子机制的研究很少, 仅仅有运用SSH[3]和蛋白质组学[4]分析南美白对虾低温反应分子机制的研究。
小RNA是能够调节蛋白质表达的短的非编码RNA。这些核苷酸可以全部或部分互补结合到mRNA的3′非翻译区(UTR), 这将抑制靶基因的翻译。众所周知, miRNAs在调节许多真核细胞的过程中有重要的作用, 包括细胞分化、增殖、凋亡、能量代谢、癌症的发展以及免疫防御等方面有重要的作用[5]。自从2001年首次发现miRNA以来, 许多研究人员已经证明, 在许多物种中, miRNA在不同的环境胁迫下表现出差异表达。研究已证实,miR-1-3p、miR-14、mir-31a-3p和miR-284-3p在昆虫低温适应过程中参与调控[6]; tsc-miR-20a和tscmiR-21在龟的低温胁迫过程中参与调控[5]。已有的水生生物应对低温胁迫的miRNA表达研究包括斑马鱼脑组织在低温胁迫下的差异miRNA表达等[7]。然而, 针对凡纳滨对虾的低温适应miRNAs及靶基因的研究仍然十分匮乏。到目前为止, 对凡纳滨对虾miRNA的研究主要集中在免疫防御方面, 如感染白斑综合征病毒后miRNA的表达变化[8]。由于肝胰腺是参与凡纳滨对虾免疫、造血、代谢、解毒的重要器官, 故选择其进行分析[9]。并且已有研究证明, 在低温胁迫之后, 低温反应基因在凡纳滨对虾肝胰腺中有较高的表达水平[3]。因此我们利用Solexa对凡纳滨对虾在常温(28℃)及低温锻炼(16℃, 6d)下的肝胰腺小RNA进行测序, 并运用qRT-PCR验证差异显著的miRNAs以及靶基因的表达模式, 以期能初步解析miRNAs在凡纳滨对虾低温适应过程中的分子调控机制。
1 材料与方法
1.1 低温胁迫实验及样品采集
从防城港水产养殖基地获得凡纳滨对虾数10只(3个月大, 体重10—15 g), 在广西水产科学研究院水族馆饲养, 并在实验前一周让其适应28℃水温, 30%—35%盐度的条件。实验组以每2小时1℃的速度降温, 直至16℃。实验组在16℃水温维持6d,在低温到达0、24h、72h和144h的时候分别采集对虾肝胰腺样本。对照组水温维持在28℃, 并且和实验组(16℃)在同样的时间点进行采样。采集的样品立即保存在液氮或RNA保护液(上海捷瑞)中, 后转移至-80℃超低温冰箱。
1.2 小RNA测序文库的构建及测序
常温、低温处理每个取样点选择3尾虾, 分别用Trizol reagent (Invitrogen)提取肝胰腺的总RNA,等量混合后, 电泳分离16—30 nt的小分子 RNA, 进行Solexa高通量测序。小RNA 文库的Solexa测序由北京诺禾致源生物公司完成。
1.3 生物信息学分析
在测序完成后, 首先去除接头序列及低质量序列, 用bowtie将长度筛选后的sRNA 定位到凡纳滨对虾的转录组参考序列上, 然后将上述mapped到参考序列上的reads, 与Rfam database (11.0, http://Rfam.sanger.ac.uk/)数据库进行比对, 除去snRNA、snoRNA、rRNA、tRNA和重复序列, 剩下的序列在miRBase (version18.0, http://www.mirbase.org/)中进行比对, 完全匹配的为已知的成熟miRNA序列。进一步运用miREvo[10]和mirdeep2[11]软件来预测新的miRNA (novel miRNAs)。
1.4 显著差异miRNA的表达分析
在进行差异miRNA 表达分析时, 对各样本中已知和新的miRNA进行表达量的统计, 用TPM进行表达量归一化处理。使用DEGseq (http://www.bioconductor.org/packages/release/bioc/html/DEG-seq.html)对常温及低温组的miRNAs进行差异表达分析。为进一步验证获得的差异显著miRNAs的表达规律, 采用茎环RT-qPCR对凡纳滨对虾在常温及不同低温锻炼条件下的肝胰腺进行了相对表达量的检测分析, 常温下肝胰腺的表达量被设定为1。每个实验组有3只虾的肝胰腺作为生物学重复。茎环RT-qPCR所使用的引物如表 1所示。

表1 RT-qPCR验证差异表达miRNAs使用的引物序列Tab. 1 Primer sequences used for RT-qPCR
1.5 miRNA靶基因的表达分析
为了进一步阐明差异表达miRNAs的生物学过程和生理功能, 对差异表达的miRNAs进行靶基因预测, 再根据miRNA与其靶基因间的对应关系, 对每组差异表达miRNA的靶基因的集合分别进行Gene Ontology(GO)和KEGG富集分析。将预测出的低温差异表达miRNAs的靶基因与课题组前期低温转录组分析获得的低温显著差异表达基因进行比对, 从二者重合的基因集中挑选出4个基因, 即nuclear export mediator factor Nemf-lik、synapse-associated protein、seleno proteins 以及DEAD-box RNA helicase Variant 1, 运用qRT-PCR验证其在低温不同时间点的表达规律。
2 结果
2.1 肝胰腺中获得的miRNAs的基本特征
分别从常温组和低温组对虾的肝胰腺小RNA文库中获得14754823和14945246条原始序列。去除低质量序列、接头序列和短序列后, 分别筛选出18—32 nt的10690259和8587144条高质量序列进行进一步的分析。
2.2 已知miRNAs的鉴定
用bowtie将长度筛选后的sRNA 定位到凡纳滨对虾转录组参考序列上, 将定位成功的序列与Rfam database 数据库进行比对, 除去tRNAs、rRNAs、snRNA或noRNAs和重复序列, 从常温和低温组对虾肝胰腺小RNA文库中分别获得892001条与858237条miRNAs。再将获得的miRNAs序列在miRBase中进行比对, 常温和低温组分别鉴定出57及48条已知的成熟miRNAs。
2.3 未知miRNAs的预测
运用miREvo[10]和mirdeep2[11]软件来预测新的miRNAs, 从常温和低温组对虾肝胰腺小RNA文库中分别获得38及46条novel miRNAs。这些未知的miRNAs在表达水平上存在极大的差异, 从几十到几千不等(TPM)。
2.4 miRNAs的差异表达分析及验证
通过差异表达分析获得25个低温锻炼下显著差异表达的miRNAs, 其中有9个极显著上调, 2个极显著下调(表 2)。
为了进一步验证这些miRNAs的表达模式, 运用实时荧光定量PCR对肝胰腺进行相对表达量的检测。选取2条已知的miRNAs (mja-miR-6494、mja-miR-6491)及1条未知的miRNAs (novel_5)进行验证。结果表明, mja-mir-6491、mja-mir-6494和novel_5在低温相对于常温呈现上调的趋势。其中,mja-miR-6494及mja-miR-6491在低温0表达水平迅速增加, 并达到峰值, 之后逐渐减少。而novel_5则是在低温0表达水平开始增加, 在72h达到峰值(图 1)。

表2 miRNAs显著表达差异倍数分析结果Tab. 2 The fold-change of significantly differentially expressed miRNAs
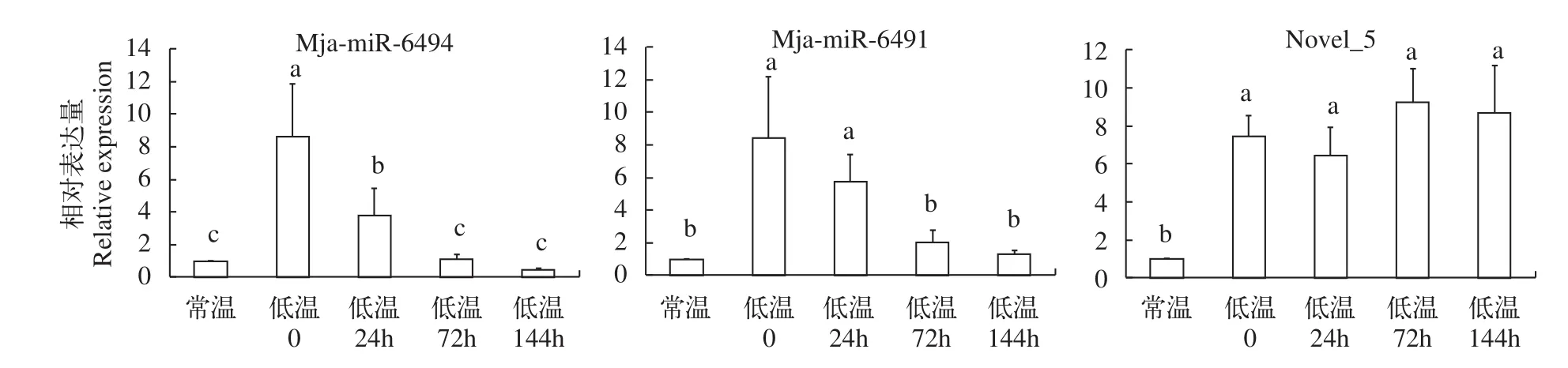
图1 通过实时荧光定量RT-PCR检测miRNAs在常温及不同低温锻炼条件下的表达模式Fig. 1 The relative expression of miRNAs under normal and cold-acclimated conditions assayed by qRT-PCR
2.5 差异表达miRNAs的靶基因预测
对差异表达的miRNAs进行靶基因预测, 再对每组差异表达miRNA的靶基因的集合分别进行GO和KEGG富集分析。GO总共分为3大功能类, 分别描述基因的分子功能(Molecular function)、所处的细胞位置(Cellular component)和参与的生物过程(Biological process)。GO分析的结果表明, 这些差异表达miRNAs的靶基因主要涉及生物过程(BP)中的生化过程(Biological process)、细胞过程(Cellular process)、代谢过程(Metabolic process); 细胞位置(CC)中的细胞组分(Cellular component); 生物过程(BP)中的分子功能(Molecular funcion)、结合(Binding)、蛋白结合(Protein binding)、催化活性(Catalytic activity)等等。KEGG数据库记录细胞中基因产物的功能以及基因产物的相互作用网络。最显著富集的KEGG通路为脂肪酸的降解 (Fatty acid degradation)及甘油酯代谢(Glycerolipid metabolism, 图 2)。
2.6 差异表达miRNAs的靶基因验证
被选取进行荧光定量PCR验证相对表达量的4个基因: synapse-associated protein、nuclear export mediator factor、seleno proteins和DEAD-box RNA helicase Variant 1均为差异表达倍数极高的miRNAs的靶基因, 同时为课题组前期低温转录组分析获得的低温显著差异表达基因。部分显著差异表达miRNAs的靶基因列表如表 3所示。荧光定量PCR的引物序列见表 4。如图 3所示, synapse-associated protein及nuclear export mediator factor为低温下调基因, 而seleno proteins及DEAD-box RNA helicase Variant 1为低温上调基因。synapse-associated protein的表达量在低温72h达到最低, nuclear export mediator factor在低温24h达到最低。而DEAD-box RNA helicase Variant 1及seleno proteins的表达量在低温72h达到最高。
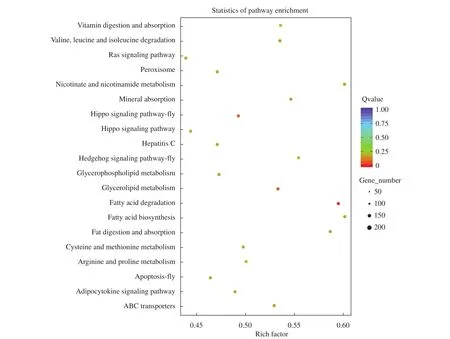
图2 差异表达miRNAs的靶基因KEGG通路预测Fig. 2 Prediction of target gene KEGG pathway for differentially expressed miRNAs
3 讨论
自2001年首次发现miRNAs以来, 许多研究人员已经证实了miRNAs在多种动物应对环境压力下的作用。在海龟中, 一些miRNAs, 包括tsc-miR-20a和tsc-miR-21, 可以调节缺氧和低温反应下细胞的关键变化[12]。在昆虫中, miR-1-3p和miR-284-3p被鉴定出在低温反应中起重要的作用[13]。然而,凡纳滨对虾低温反应miRNAs的数据仍然十分匮乏。迄今为止, 凡纳滨对虾miRNAs的研究主要集中在免疫防御上[7]。为了研究miRNAs在凡纳滨对虾低温适应中的作用, 我们设计了低温锻炼实验。通过高通量测序, 我们从常温和低温组对虾肝胰腺小RNA文库中鉴定出了miRNAs。表达分析表明,25个miRNAs在低温下存在显著的差异表达。在鉴定出的差异表达miRNAs中, mja-miR-6494和mjamiR-6491已被报道与日本对虾的病毒感染有关[14]。此外, bta-miR-2478已被报道与牛的病毒感染有关[15]。因此我们推测miRNA在多种胁迫响应中具有复杂的调节作用。

表3 部分显著差异表达miRNAs的靶基因Tab. 3 Partially significant differential expression of target genes for miRNAs
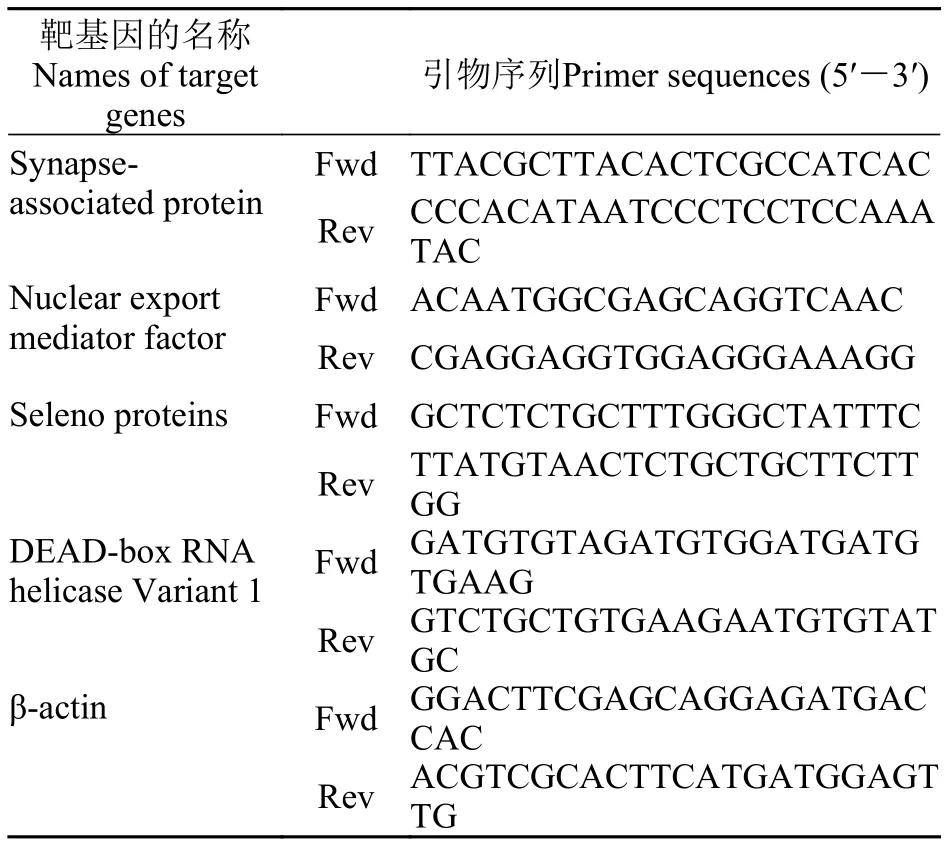
表4 差异表达miRNAs的靶基因的荧光定量PCR扩增引物Tab. 4 Primer sequences used for RT-qPCR of the targets of differentially expressed miRNA
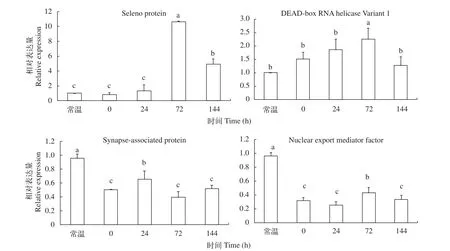
图3 通过实时荧光定量RT-PCR检测靶基因在常温及不同低温锻炼条件下的表达模式Fig. 3 The relative expression of target genes under normal and cold-acclimated conditions assayed by qRT-PCR
mja-miR-6491、mja-miR-6494和novel_5在低温组对虾肝胰腺的表达水平显著高于常温组。而在我们之前的研究中, 低温胁迫下的凡纳滨对虾,包括胃蛋白酶、胰蛋白酶和淀粉酶在内的消化酶的活性变化显示出与此相反的模式, 即低温胁迫24h后, 肝胰腺和胃肠道中这些消化酶的活性开始显著降低[16]。类似的研究表明低温应答型miRNA的靶基因在新陈代谢等生物学过程中富集[5]。因此推测, 凡纳滨对虾应对低温主要的适应包括快速降低新陈代谢率等。在本研究中, KEGG途径分析表明, 靶基因主要富集到与脂肪酸代谢有关的一些途径中。此结果与前人的研究结果相符合。在大黄鱼中, 脂肪酸的脱饱和是维持膜在低温胁迫下流动性的重要适应机制[17]。在泥鳅中, 超长链脂肪酸延伸酶6 (elovl6)已被证明在适应低温方面起主要作用[18]。
本课题组前期运用SSH及转录组测序筛选出低温差异表达基因DEAD-box RNA helicase Variant的变异体- LvDDX5A, 并验证出其表达规律为在18℃、15℃、13℃和11℃低温胁迫36h均被诱导表达, 并随着15℃和13℃低温胁迫时间的增加呈先上升后下降的表达模式, 在48h达到峰值[19]。在本研究验证的差异miRNA靶基因中, DEAD-box RNA helicase Variant 1为低温上调基因, 表达量在16℃低温锻炼72h达到最高, 此结果与课题组前期研究相符。另外3个差异miRNA的靶基因-synapse-associated protein、nuclear export mediator factor及seleno proteins也是项目组前期进行低温转录组测序中筛选出的显著差异基因。因此, 这4个低温差异miRNAs的靶基因很可能为凡纳滨对虾的耐寒相关基因。为了进一步验证miRNAs对靶基因的调控,课题组计划将运用RNA 免疫共沉淀 CLIP-Seq 技术对miRNAs及其靶基因进行验证。
