内源性甾体激素GC/MS分析中酮基衍生规律的研究
2019-11-22付玉娟焦丽丽刘淑莹宋凤瑞
李 慧,付玉娟,焦丽丽,刘淑莹,宋凤瑞,吴 巍
(1.长春中医药大学,吉林省人参科学研究院,吉林 长春 130117;2.中国科学院长春应用化学研究所,吉林 长春 130022)
甾体激素(steroid hormones)又称类固醇激素,是一类四环脂肪烃化合物,在中枢或周围神经系统中合成,被认为是潜在的生物标记物,在抗炎、免疫调节、调节性功能、促进机体发育等方面具有重要作用[1-2]。甾体激素的含量极低,检测响应值低,直接检测难度较大,对检测手段的灵敏度要求较高,是医疗、环境、畜牧业等领域研究的热点和难点[3]。
甾体激素的检测常采用气相色谱-质谱法(GC/MS),该方法的灵敏度高,可实现多种成分同时检测[4-7]。GC/MS应用于甾体激素检测时常需要对酮基和羟基进行衍生来提高样品的挥发性,而酮基不含氢原子,是衍生反应的难点。通常,酮基的衍生有烯醇化和肟化两种方法,其中烯醇化的产物稳定性较差,应用范围有限[8-10];肟化反应是将酮基在一定条件下与羟胺类物质进行亲核加成反应,生成肟类物质,产物稳定性较好,同时N-的加成能够提高样品的信号强度。虽然肟化反应应用较早[11-12],但是对甾体激素酮基肟化反应的研究报道较少。甾体激素结构复杂,同系物多,在衍生过程中易产生异构化,衍生条件对衍生效果有较大影响[13]。因此,研究甾体激素的衍生过程具有重要意义。
本工作以12种内源性甾体激素为研究对象,以甲氧胺(methoxyammonium chloride, MOX)和N-甲基-N-(三甲基硅烷)三氟乙酰胺(N-methyl-N-trimethylsilyl trifluoroacetamide, MSTFA)为衍生化试剂,研究其肟化规律。通过GC/MS鉴定衍生物结构,推测衍生反应过程,考察衍生反应条件,希望能够建立一种甾体激素的GC/MS分析方法,为内源性甾体激素的GC/MS分析提供理论基础。
1 实验部分
1.1 仪器与试剂
TRACE1310气相色谱仪,TSQ 8000三重四极杆质谱仪:美国Thermo公司产品;MTN-2800D氮吹浓缩装置:天津奥特赛斯仪器有限公司产品;SQP电子分析天平:北京赛多利斯科学仪器有限公司产品;H-2 BLENDER涡旋混合器:上海精胜仪器有限公司产品;HB120-S金属浴:上海赛伯乐仪器有限公司产品。
脱氢表雄酮(dehydroeppiandrosterone, DHEa)、双氢睾酮(dihydrotestosterone, DHT)、雄酮(Androsterone, ADL)对照品:均为上海源叶生物科技有限公司产品;表雄酮(epiandrosterone, Epian)、孕烯醇酮(pregnenolone, Preg)对照品:均为北京百灵威科技有限公司产品;睾酮(testosterone, T)、雌酮(estrone, E1)、雄烯二酮(androstenedione, ASD)对照品:均为德国Dr.Ehrenstorfer Gmbh公司产品;皮质甾酮(corticosterone, B)、可的松(cortisone, E)对照品:均为梯希爱化成工业发展有限公司产品;孕酮(progesterone, P)对照品:由中国食品药品检定研究院提供;别孕烯醇酮(Allopregnanolone, AP)对照品:加拿大TRC公司产品。
二氯甲烷(色谱纯):美国J.T. Baker公司产品;甲氧胺盐酸盐:梯希爱化成工业发展有限公司产品;N-甲基-N-三甲基硅基三氟乙酰胺:北京百灵威科技有限公司产品;甲醇(色谱纯):美国Tedia公司产品。
1.2 实验过程
1.2.1色谱条件 色谱柱:Supelco SPBTM-5(15 m×0.53 mm×0.5 μm);载气为99.999%高纯N2,流速1 mL/min;升温程序:初始柱温50 ℃,以10 ℃/min升至200 ℃,然后以5 ℃/min升至245 ℃,保持5 min,再以1.5 ℃/min升至248 ℃,保持1 min;进样方式及进样量:全扫描模式下分流比为20∶1,MRM检测模式下不分流进样,进样量1 μL。
1.2.2质谱条件 EI离子源;MS传输管温度280 ℃;离子源温度280 ℃。从5 min起检测,采用全扫描(Full Scan)模式鉴定衍生物结构,质量扫描范围m/z50~800,定量分析时采用单反应离子检测(selective reaction monitoring mode, SRM)模式。
1.2.3样品的衍生化方法 采用肟化结合硅烷化处理甾体激素。精密称定各1 mg 12种标准对照品,用甲醇溶解后,精密量取100 μL,加入MOX的甲醇溶液,置于金属浴中避光进行肟化反应,氮气吹干。在肟化反应瓶中加入120 μL MSTFA,涡旋混合,置于70 ℃金属浴中避光30 min进行硅烷化反应,再次氮气吹干,加入1 mL二氯甲烷涡旋复溶,过滤后待检测。
1.2.4衍生条件的优化 为获得最佳的衍生条件,本实验对肟化反应过程中的衍生温度、衍生化试剂用量和衍生时间等因素进行了考察。
衍生温度:取100 μL浓度均为1 g/L的标准溶液,加入50 μL 10 g/L的MOX甲醇溶液,分别在25、40、60、80、100 ℃下衍生30 min;氮气吹干后,加入200 μL MSTFA,于70 ℃反应30 min,再次氮气吹干,用1 mL二氯甲烷复溶,过滤,进样。
衍生化试剂用量:取100 μL浓度为1 g/L的标准溶液,分别加入30、50、60、70、80 μL浓度为10 g/L的MOX甲醇溶液,使MOX与酮基的比例分别为:10∶1,16∶1,20∶1,23∶1和27∶1,在80 ℃下反应30 min;氮气吹干后,加入200 μL MSTFA,于70 ℃下反应30 min,用二氯甲烷复溶,过滤,进样。
衍生时间:取100 μL 1 g/L的DHEA溶液,加入60 μL MOX溶液,于80 ℃下分别反应30、40、50、60 min后,氮气吹干,再加入200 μL MSTFA,于70 ℃反应30 min,再次氮气吹干,用二氯甲烷复溶,过滤,进样。
2 结果与讨论
2.1 甾体激素衍生物的质谱分析方法
肟化-硅烷化可以改变羟基和羰基的极性,提高样品的挥发性。本实验通过肟化-硅烷化两步反应对甾体激素进行衍生,肟化-硅烷化反应的结构通式示于图1。

图1 甾体激素衍生反应结构通式Fig.1 Reaction formula of Steroids with MOX and MSTFA

2.2 甾体激素衍生物的质谱分析
采用1.2.2节方法对12种甾体激素进行衍生反应,得到甾体激素衍生产物的色谱图和质谱图,示于图3。Preg(图3a)、DHEA(图3b)、AP(图3c)、ADL(图3d)、DHT(图3e)和Epian(图3f)的总离子流色谱图中均只出现一个色谱峰,基线平整、峰形较好、待测物响应信号强, 表明上述6种化合物经衍生后均得到一种衍生产物。6种甾体激素中均存在羟基和酮基结构,在质谱图中均检测到[M+29+72]+质谱峰,表明衍生产物为羟基和酮基分别发生肟化和硅烷化。同样,在质谱图中观测到[M-15]+、[M-31]+、[M-73]+、[M-90]+的质谱峰,分别为肟化后和硅烷化后的特征峰,进一步确定其为肟化和硅烷化的产物。因此,上述6种甾体激素的酮基和羟基均发生衍生反应,衍生效果较好。

图2 Epian衍生产物(MO-TMS-Epian)的碎片离子及质谱裂解途径Fig.2 Fragment ions and fragmentation pathways of derived Epian (MO-TMS-Epian)

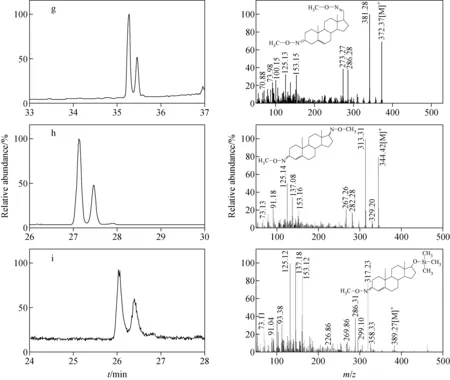
注:a.Preg;b.DHEA;c.AP;d.ADL;e.DHT;f.Epian;g.P;h.ASD;i.T图3 甾体激素衍生物的总离子流图和碎片离子峰Fig.3 Total ion chromatograms and fragment ions of steroid hormone derivatives
P(图3g)、ASD(图3h)、T(图3i)甾体激素的总离子流色谱图中出现2个色谱峰。在质谱图中同样观测到[M-15]+、[M-31]+、[M-73]+、[M-90]+的碎片离子峰,表明它们也发生了肟化和硅烷化反应,分别生成biMO-P、biMO-ASD、MO-TMS-T。三种化合物产生的衍生产物的碎片离子峰相同,它们各自的衍生产物为同分异构体。通过对比这3种甾体激素发现,其结构中均存在共轭双键,该类化合物在与氮亲核试剂发生加成反应时,酮基中的π电子被拉向氧原子,酮基中的碳是缺电子中心,亲核试剂从空间阻碍小的酮基平面上面或下面进攻碳原子,与酮基加成生成产物[5],脱水后形成含有碳氮双键的肟化产物。氮与酮基的碳生成碳氮双键会影响几何异构的现象,形成顺反异构体,所以在总离子流色谱图中出现双峰,同时总离子流色谱图中基线噪音较大,待测物信号较弱。
除上述9种甾体激素外,还有3种甾体E、B和E1相对复杂。E结构中含有3个酮基,2个羟基,结构最复杂,理论上可以分别发生肟化和硅烷化反应,同时酮基与苯环上的双键形成共轭结构。在E衍生产物的总离子流图中检测到6种衍生产物,示于图4。色谱峰a和b的质谱峰碎片相同,为同分异构体(图4a和图4b)。图4a中检测到了连续失去碎片 —OCH3的m/z560、529、498和m/z470、439、408、377碎片离子,表明衍生结构中存在3个肟化基团,即3个酮基均被衍生,即tR为40.92 min的这对同分异构体是E中3个酮基和2个羟基完全衍生后的产物triMO-biTMS-E。衍生后其分子质量为591 u,但在总离子流图中并未检测到m/z591质谱峰,表明衍生产物不稳定,发生了裂解。tR为42.06、42.14 min的2个衍生产物具有相同的碎片离子,在质谱图中均检测到m/z562质谱峰,表明二者是同分异构体,示于图4c,4d。m/z531是衍生产物失去一个—OCH3基团产生的碎片,同时质谱图中出现m/z441、351质谱峰,表明其中含有2个硅烷化基团。结合E的结构,推测tR为42.06、42.14 min的2个衍生产物为2个酮基和2个羟基发生衍生后的产物biMO-biTMS-E,而由于空间位阻的存在,推测其发生肟化反应部位为C3和C11位连接的酮基。tR为43.14、43.39 min的化合物是一对同分异构体(图4e和图4f),其母离子为m/z490.13,在质谱图中检测到m/z459、428、399质谱峰,证实了衍生产物biMO-TMS-E是2个酮基和1个羟基分别发生肟化和硅烷化反应得到的。同样,由于受空间位阻的影响,推测衍生产物的结构式示于图4e、4f。

注:a.triMO-biTMS-E;b.triMO-biTMS-E;c.biMO-biTMS-E;d.biMO-biTMS-E;e.biMO-TMS-E;f.biMO-TMS-E图4 甾体激素E衍生物的总离子流图和碎片离子峰Fig.4 Total ion chromatograms and fragment ions of steroid bormone E derivatives
B结构中含有2个酮基、2个羟基,酮基与苯环存在共轭结构,共检测到6种衍生产物,标记为a~f,示于图5。B结构中存在共轭结构,且质谱图5a、5b、5c、5d中母离子均为m/z548,比原分子质量增加了202 u,表明衍生产物均为biTMS-biMO-B,这4种化合物为同分异构体(tR分别为42.17、42.32、43.07、43.18 min)。图5e和图5f中分子离子峰为519 u,表明tR为43.37、43.62 min的化合物为MO-biTMS-B。
E1结构中含有1个酚羟基及1个酮基,可以分别发生肟化和硅烷化反应,在E1的衍生产物总离子流色谱图中出现2个色谱峰,示于图6,其中图6a中母离子m/z371比衍生前的分子质量增加101 u,同时质谱图中出现[M-31]+、[M-72]+峰,表明图6a为肟化-硅烷化E1,即MO-TMS-E1。图6b中母离子m/z299(tR为26.01 min)比衍生前的分子质量增加 29 u,同时质谱图中出现[M-31]+峰,表明图6b为肟化产物MO-E1,二者提取离子流峰面积比值为0.69∶1,表明E1结构中的酮基由于受到苯环的吸电子作用,不易发生硅烷化反应。

注:a.biMO-biTMS-B;b.biMO-biTMS-B;c.biMO-biTMS-B;d.biMO-biTMS-B;e.MO-biTMS-B;f.MO-biTMS-B图5 甾体激素B衍生物的总离子流图和碎片离子峰Fig.5 Total ion chromatograms and fragment ions of steroid hormone B derivatives

注:a.MO-TMS-E1;b.MO-E1图6 甾体激素E1衍生物的总离子流图和碎片离子峰Fig.6 Total ion chromatograms and fragment ions of E1 steroid hormone derivatives
甾体激素的结构复杂,衍生反应后产物较多,衍生产物的总离子流图中均未能检测到原型化合物。通过对衍生产物的研究发现,所有硅烷化产物均生成m/z73碎片离子,该离子是三甲基硅烷衍生化后丢失的典型碎片—Si(CH3)3,可以作为硅烷化衍生产物的鉴定依据,同时出现[M-91]+峰。衍生产物质谱图中产生[M-31]+碎片离子,是丢失1个甲氧基产生的。在肟化-硅烷化产物中产生的m/z73碎片离子及[M-31]+碎片离子可以作为甾体激素肟化-硅烷化后衍生产物的鉴定依据。
2.3 衍生条件的考察
为获得最佳的衍生条件,以DHEA为例,对衍生过程中关键的肟化反应衍生温度、反应时间、衍生化试剂用量进行了考察。以不同条件下的提取离子流峰面积为纵坐标,衍生条件为横坐标,得到的MO-TMS-DHEA关系曲线示于图7。
在一定范围内,MO-TMS-DHEA的峰面积随着MOX含量的增加而逐渐增加,持续增加MOX含量超过一定值后,会使峰面积下降,示于图7a。表明增加MOX含量能够提高衍生效率,但过量的MOX不利于反应进行,需根据底物和衍生化试剂的用量换算,即酮基与衍生化试剂甲氧胺的比例在1∶20时的衍生反应效率最高。随着衍生时间的增长,衍生产物含量会发生变化,反应时间在40 min时达到最大值,进一步延长反应时间会导致衍生物降解,示于图7b。在低温条件下,衍生效果不佳,MO-TMS-DHEA的峰面积随着温度升高而增加,当温度达到80 ℃时,峰面积达到最大值,继续升高温度,峰面积值下降,这可能是温度过高导致了衍生物降解,示于图7c。因此,对于甾体激素中酮基肟化衍生化反应,最佳条件为80 ℃反应40 min,且酮基与MOX的摩尔比为1∶20。
2.4 甾体激素的线性范围考察
在最佳衍生条件下,对12种标准对照品的线性关系进行初步考察。分别精密称定各1 mg对照品,稀释成浓度为10、20、50、100、200、500、1 000、2 000 μg/L的系列标准溶液。按1.2.3节进行衍生,采用SRM扫描方式,以峰面积为指标优化扫描模式,得到衍生物的扫描离子对,结果列于表1。

注:a.衍生试剂体积;b.衍生时间;c.衍生温度图7 衍生条件对衍生产物生成量的影响Fig.7 Effect of conditions on the amount of derivatives

序号No.化合物Compounds分子式Molecular formula分子量MW离子对Ion pair(m/z)碰撞能量Collision energy/eV1DHEAC19H28O2288.21358/26882PregC21H32O2316.24386/31283APC21H34O2318.26419/32964ADLC19H30O2290.22391/27065EpianC19H30O2290.22391/27086DHTC19H30O2290.22391/27087PC21H30O2314.22372/28668EC21H28O5360.19441/282109TC19H28O2288.21389/269810E1C18H22O2270.16299/268611ASDC19H26O2286.19344/329612BC21H30O2346.21548/3616
以浓度为横坐标,峰面积为纵坐标绘制标准曲线,得到含有异构体的6种衍生后化合物triMO-triTMS-E、MO-TMS-T、MO-TMS-E1、MO-TMS-ASD、MO-TMS-P、biMO-biTMS-B的线性范围为5~200 μg/L,而MO-TMS-DHEA、MO-TMS-Preg、MO-TMS-AP、MO-TMS-DHT、MO-TMS-ADL和MO-TMS-Epian的线性范围为1~200 μg/L。表明上述12种衍生后甾体化合物的线性关系良好,相关系数均大于0.99,在该反应条件下的最低检测限为1 μg/L。
3 结论
本实验采用肟化-硅烷化方法研究了12种内源性甾体激素酮基衍生反应,结合GC/MS法分析衍生产物,系统研究了甾体激素酮基衍生规律。结果表明,肟化-硅烷化后可以显著提高待测物的灵敏度,C3位含有羟基且C17(C20)位含有酮基的甾体激素(DHEA, Preg, AP, ADL, Epian, DHT)发生的肟化-硅烷化反应完全,生成物的质谱响应高,杂质生成量少,检测灵敏度可以达到1 μg/L,这类甾体化合物采用GC/MS结合柱前衍生分析的效果较好。当甾体激素中存在共轭结构时易产生顺反异构体,产物复杂。通过优化肟化反应条件,发现与甾体激素反应的最佳条件是80 ℃反应40 min,酮基与MOX的摩尔比为1∶20。该方法检测甾体激素的灵敏度可达ng级,SRM扫描模式下的线性范围可达1~200 μg/L,可为相关激素类成分的分析提供检测技术支持。
