流感病毒NS1蛋白与宿主蛋白DOK6的相互作用研究
2019-11-22黄山雨梁立滨李俊平赵青青周陈陈赵玉辉王广文李奇兵孔凡迪李呈军陈化兰
黄山雨,梁立滨,李俊平,王 倩,赵青青,周陈陈,赵玉辉,王广文,李奇兵,孔凡迪,李呈军,陈化兰,姜 丽
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室,黑龙江 哈尔滨 150069)
禽流感病毒(Avian influenza virus,AIV)属于正黏病毒科,流感病毒属。AIV 基因组由8 个分节段的单股负链 RNA 组成,分别是 PB1、PB2、PA、HA、NP、NA、M 和NS。其中NS1 由最小的片段NS 编码,是AIV 重要的非结构蛋白。NS1 的主要作用是抑制干扰素产生,抑制宿主基因的表达。目前已经报道的与NS1 相互作用的蛋白有 PKR[1]、RIG-I[2]、 CPSF30[3]、 TRIM25[4]和 IKK[5]等,且大多均是宿主体内与抗病毒功能相关的蛋白。同时NS1具有双链RNA 结合结构域,可以阻止双链RNA 对模式识别受体RIG-I 的激活[6]。宿主因子停泊蛋白6(Docking protein 6,DOK6)属于DOK 家族发现较晚的蛋白,目前对其分子功能知之甚少,尚无DOK6与流感病毒相互作用的报道。本实验通过免疫共沉淀结合质谱分析的方式筛选出能够与NS1 蛋白相互作用的DOK6 蛋白,旨在揭示NS1 蛋白与DOK6 蛋白的相互作用,为深入研究流感病毒在宿主体内的复制机制提供参考数据。
1 材料与方法
1.1 细胞系、质粒和病毒 HEK293T 细胞、A549细胞由本实验室保存、pCAGGS 真核表达载体由Yoshihiro Kawaoka 教授惠赠;pCAGGS-V5、pCAGGSFlag 真核表达载体由本实验室基于pCAGGS 改造构建,双分子荧光互补(BiFC)真核表达载体pCAGGSVN、pCAGGS-VC 由中国农业科学院哈尔滨兽医研究所华荣虹副研究员惠赠[7](由pCAGGS 载体改造,分别插有荧光分子Venus 的N 端和C 端,分割点为Venus分子第173位氨基酸),pCAGGS-Flag-NS1、pCAGGS-V5-NS1 和pHH21-WSN-NS1 由本实验室构建,流感病毒A/WSN/1933(H1N1)由本实验室保存。
1.2 抗体及主要试剂 鼠抗Flag 单克隆抗体(MAb)、兔抗Flag 多克隆抗体、兔抗V5 多克隆抗体、Anti-Flag M2 亲和琼脂糖珠购自Sigma 公司;兔抗 NS1 多克隆抗体购自 Genetex 公司,鼠抗β-actin MAb 购自 Santa Cruz 公司。Dylight 800 标记的山羊抗鼠IgG (H+L)、DyLight 800 标记的山羊抗兔IgG (H+L)购自KPL 公司;Alexa Fluor 488 结合的山羊抗兔 IgG、Alexa Fluor 633 结合的山羊抗兔IgG、Alexa Fluor 488 结合的山羊抗鼠 IgG、Alexa Fluor 633 结合的山羊抗鼠 IgG、Hoechst 33342 均购自Thermo Fisher Scientific 公司;RNA 提取试剂盒、质粒中提试剂盒、胶回收试剂盒均购自Qiagen 公司;质粒小提试剂盒、DNA 纯化试剂盒均购自Axygen 公司;DMEM 培养基、Opti-MEM 培养基、F-12K 培养基、转染试剂Lipofectamine LTX 均购自Invitrogen 公司;胎牛血清(FBS)购自Biological Industries公司;TransIT-X2 Transfection Reagent购自Mirus公司;Q5 高保真PCR 酶,各种限制性内切酶均购自NEB公司;DL5000 DNA Marker、同源重组酶均购自Vazyme公司;细胞裂解液NP40、蛋白酶抑制剂(PMSF)均购自碧云天生物公司。
1.3 重组质粒的构建与鉴定 根据DOK6 参考序列(gene ID:220164)、A/WSN/1933(H1N1)流感病毒NS1蛋白参考序列(LC333189.1)设计引物。提取A549 细胞RNA,反转录获得cDNA,以其为模板,采用引物DOK6-F-pCAGGS/DOK6-R-pCAGGS,扩增DOK6 基因片段。将 pCAGGS-Flag 与 pCAGGS-V5经KpnⅠ和XhoⅠ双酶切后,与上述扩增的DOK6基因片段同源重组构建pCAGGS-Flag-DOK6 与pCAGGS-V5-DOK6 真核表达质粒。利用构建的pCAGGS-Flag-DOK6 质粒为模板,采用引物DOK6-F-BiFC/DOK6-R-BiFC 扩增DOK6 基因全长片段,采用引物 DOK6-F-BiFC/DOK6-R339-BiFC PCR 扩增DOK6 的 Pleckstrin 同源结构域(Pleckstrin homology domain,PH) (aa1 ~aa113)基因片段,采用引物DOK6-F391-BiFC/DOK6-R714-BiFC PCR 扩增 DOK6的PTB 结构域(aa131~aa238)基因片段,采用引物DOK6-F-BiFC/DOK6-R714-BiFC PCR扩增DOK6结构域 PH+PTB (aa1~aa238)基因片段,采用引物DOK6-F391-BiFC/DOK6-R-BiFC PCR扩增DOK6结构域 PTB+C-Terminal (aa131 ~aa331)基因片段(图1)。将以上扩增片段,与经SacⅠ/XhoⅠ酶切的pCAGGS-VN 与pCAGGS-VC 载体同源重组,分别构建重组质粒:pCAGGS-DOK6-VN、pCAGGS-DOK6-VC、pCAGGS-PH-VC、pCAGGS-PTB-VC、pCAGGS-(PH+PTB)-VC、pCAGGS-(PTB+C-Ter)-VC。以 pHH21-WSN-NS1 质粒为模板,采用引物NS1-F-BiFC/NS1-R-BiFC PCR 扩增NS1 全长基因片段,按照上述方法构建重组质粒pCAGGS-NS1-VN、pCAGGSNS1-VC。所有重组质粒均利用pCAGGS 上下游通用引物PCR 鉴定,并通过测序进一步鉴定。上述引物具体信息见表1。

?

1.4 DOK6 与NS1 相互作用的免疫共沉淀(Co-IP)试验 采用 Lipofectamine LTX 将 pCAGGS-Flag-NS1+pCAGGS-V5-DOK6 共转染至6 孔板中密度为80 %的293T 细胞,同时分别转染pCAGGS-Flag-NS1+pCAGGS 和 pCAGGS-V5-DOK6+pCAGGS 作 为对照,每种质粒各1 g。转染48 h 后,按200 μL/孔加入NP40 (含PMSF),裂解细胞30 min,离心,收集上清全细胞裂解液(Whole cell lysates,WCL),取20 μL 作为对照 ,剩余的样品加入20 μL Anti-Flag M2 亲和琼脂糖珠过夜结合。结合后琼脂糖珠经预冷PBS 洗涤5 次,最后加30 μL 2×蛋白上样缓冲液重悬,煮沸变性5min,作为Co-IP 样品。WCL样品和Co-IP 样品经SDS-PAGE 电泳,转印至NC膜,分别用兔抗V5 多克隆抗体(1∶1 000)和兔抗Flag多克隆抗体(1∶1 000)作为一抗,用DyLight 800 标记的山羊抗兔 IgG (H+L) (1 ∶10 000)作为二抗, 经western blot 检测转染蛋白表达与免疫共沉淀结果。
1.5 DOK6 与NS1 相互作用的的激光共聚焦试验将A549 细胞传代至激光共聚焦培养皿中,并于次日利用Mirus TransIT-X2,共转染pCAGGS-V5-NS1+pCAGGS-Flag-DOK6 至A549 细胞,同时分别转染质粒 pCAGGS-V5-NS1+pCAGGS 和 pCAGGS-Flag-DOK6+pCAGGS 作为对照,每种质粒各1 g。36 h后,使用4 %多聚甲醛常温固定细胞30 min 或4 ℃过夜,PBS 洗涤,0.1%Triton X-100 常温通透15 min,PBS 洗涤,最后使用5 %脱脂乳封闭1 h。以鼠抗Flag MAb (1∶200)和兔抗 V5 多克隆抗体(1∶200)为一抗,Alexa Fluor 488 结合的山羊抗兔 IgG (1∶500)和Alexa Fluor 633 结合的山羊抗鼠 IgG (1∶500)为二抗,DAPI 染核后经激光共聚焦显微镜观察DOK6 蛋白与NS1 蛋白的亚细胞定位情况。
1.6 DOK6 与NS1 相互作用的双分子荧光互补试验(BiFC) 待96 孔板中的293T 细胞密度接近70 %时,分别共转染pCAGGS-DOK6-VN+pCAGGS-NS1-VC 与 pCAGGS-DOK6-VC+pCAGGS-NS1-VN,每种质粒各转染100 ng,同时共转染pCAGGS-NA-VC+pCAGGS-DOK6-VN 作为阴性对照, 共转染pCAGGS-SPCS1-VN+pCAGGS-JEV-NS2B-VC[7]作为阳性对照。36 h 后,弃培养液,加入4 %多聚甲醛4 ℃过夜固定。第2 d 弃固定液,加入 100 μL Hoechst 33342,常温核染4 h 后,将96 孔板移至高内涵细胞筛选系统进行荧光信号的检测。为了确认NS1 与DOK6 相互作用精确的结构域,用同样的方法将pCAGGS-PH-VC、pCAGGS-PTB-VC、pCAGGS-(PH+PTB)-VC、 pCAGGS- (PTB+C-Ter)-VC分别与pCAGGS-NS1-VN共转染293T细胞,共转染pCAGGS-SPCS1-VN+pCAGGS-JEV-NS2B-VC[7]作为阳性对照。使用高内涵细胞筛选系统进行荧光信号的检测。
2 结 果
2.1 重组质粒的鉴定结果 利用pCAGGS 载体上下游通用引物对所构建的载体pCAGGS-Flag-DOK6、pCAGGS-V5-DOK6、pCAGGS-DOK6-VN、pCAGGSDOK6-VC、 pCAGGS-NS1-VN、 pCAGGS-NS1-VC、pCAGGS-PH-VC、 pCAGGS-PTB-VC、 pCAGGS-(PH+PTB)-VC、pCAGGS-(PTB+C-Ter)-VC 分别经PCR鉴定,结果显示,插入基因序列大小均与预期一致,从左到右分别为1 053 bp、1 071 bp、1 545 bp、1 224 bp、1 239 bp、918 bp、567 bp、552 bp、942 bp、831 bp (图2),进一步通过测序鉴定各基因序列完全正确。表明正确构建以上各表达载体。
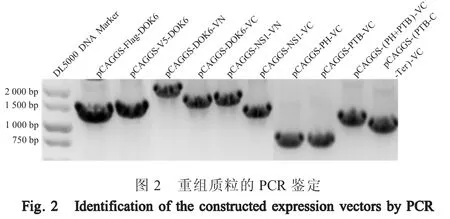
2.2 DOK6 与 NS1 相互作用的 Co-IP 验证结果将 pCAGGS-V5-DOK6+pCAGGS-Flag-NS1共转染HEK293T 细胞,同时以pCAGGS-V5-DOK6+pCAGGS和 pCAGGS-Flag-NS1+pCAGGS 为阴性对照,利用Co-IP 检测DOK6 蛋白与NS1 蛋白的互作。结果显示,WCL 中,在 26 ku (NS1 蛋白)和 38 ku (DOK6)处有特异性条带。利用抗Flag 琼脂糖珠沉淀NS1 蛋白后用兔抗Flag 多克隆抗体和兔抗V5 多克隆抗体检测NS1 蛋白与DOK6 蛋白结合情况,发现NS1 蛋白均能够被良好沉淀下来,26 ku (NS1)处有条带检出,而且在沉淀NS1 蛋白的同时,DOK6 蛋白同时也被沉淀下来,38 ku (DOK6)处有条带检出,而单独转染pCAGGS-V5-DOK6+pCAGGS,由于体系无NS1 蛋白表达,DOK6 并没有被沉淀下来,38 ku 处无特异性条带; 单独转染pCAGGS-Flag-NS1+pCAGGS 也无该 38 ku 特异性条带(图3)。表明DOK6 蛋白与NS1 蛋白存在特异的相互作用。
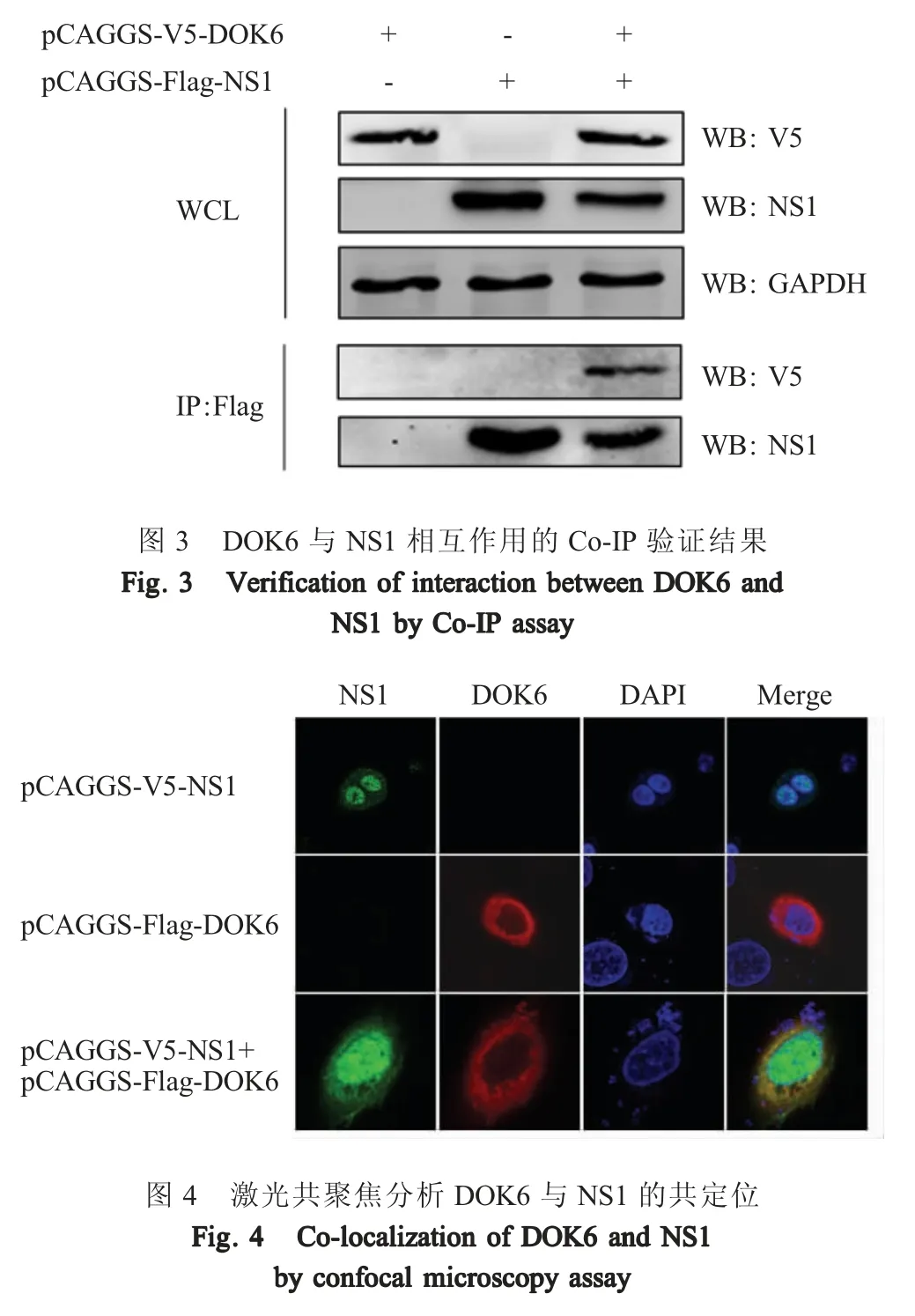
2.3 NS1 与DOK6 细胞内共定位的验证结果 将pCAGGS-V5-NS1+pCAGGS-Flag-DOK6 共转染 A549细胞,利用激光共聚焦显微镜观察该两个蛋白在细胞中的共定位。结果显示,表达的NS1 蛋白广泛分布于整个细胞中,表达的DOK6 蛋白主要定位于细胞质中,DOK6 蛋白与NS1 蛋白在细胞质中存在共定位(图4)。表明NS1 蛋白与DOK6 蛋白主要在细胞质中发生相互作用。
2.4 NS1 与DOK6 相互作用的BiFC 验证 分别将pCAGGS-DOK6-VN+pCAGGS-NS1-VC 与 pCAGGSDOK6-VC+pCAGGS-NS1-VN 共转染至293T 细胞后,采用高内涵细胞筛选系统分析荧光强度,蓝色荧光为细胞核所发出,金黄色荧光为存在相互作用的两个分子将Venus 分子的VN 和VC 片段拉近并重新组合后发出,结果显示DOK6 蛋白与NS1 蛋白共转染均能检测到较强金黄色荧光(图5),与阳性对照亮度接近,而阴性对照未发出金黄色荧光。表明NS1 蛋白与DOK6 蛋白发生了相互结合,即通过BiFC 试验证实了NS1 蛋白与DOK6 蛋白存在相互作用。
为了进一步确定DOK6 蛋白与NS1 蛋白互作的结构域,将 pCAGGS-DOK6-VC 及含DOK6 不同区段质粒pCAGGS-PH-VC、pCAGGS-PTB-VC、pCAGGS-(PH+PTB)-VC、 pCAGGS- (PTB+C-Ter)-VC 分 别 与pCAGGS-NS1-VN 共转染293T 细胞,观察荧光信号,结果可见NS1 蛋白与DOK6 蛋白的PTB 结构域(aa131~aa238)结合发出的荧光强度明显高于其与其它区段结合发出的荧光强度(图6)。表明NS1 蛋白与DOK6 蛋白的PTB 结构域存在明显的相互作用。另外,结果还显示,当PH 结构域与PTB 结构域相连时,NS1 蛋白与PTB 结构域的相互作用就会大为削弱,提示PH 结构域可能在PTB 结构域活性调节上起作用。

3 讨 论
本实验室前期工作通过以NS1 蛋白作为诱饵蛋白,利用免疫沉淀结合质谱分析技术筛选到与其互作的宿主因子DOK6。本实验将pCAGGS-V5-NS1 和pCAGGS-Flag-DOK6 转染293T 细胞,通过免疫共沉淀实验验证了NS1 蛋白与DOK6 蛋白存在相互作用,利用激光共聚焦实验分析转染后蛋白的表达及定位表明这两个蛋白在细胞质中存在明显共定位,通过BiFC 进一步证明了DOK6 蛋白的PTB 结构域与NS1 蛋白存在相互作用。实验结果为进一步研究DOK6 蛋白与NS1 蛋白相互作用机制奠定了基础,完善了病毒NS1 蛋白与宿主蛋白相互作用的网络。
DOK6 属于 DOK 家族成员,目前已经发现DOK1、DOK2、DOK3、DOK4、DOK5、DOK6 和DOK7 共7 个成员,它们均有N 端PH 结构域、中间PTB 结构域和一个多元化的C 端结构域。目前对DOK6 的研究很少,已知DOK6 能够参与RET 通路促进早期胚胎神经细胞的发育[8],还有学者证明了DOK6 蛋白能够与TrK 受体成员中TrkC 发生相互作用,相互作用区域为DOK6 蛋白的PTB 结构域,该相互作用依赖酪氨酸磷酸化[9]。最近有研究表明DOK6 的下调会导致多种信号因子(包括多种MAPK通路的分子)的表达量减少[10]。本实验通过免疫共沉淀、激光共聚焦、BiFC,发现了NS1 与DOK6 分子的PTB 结构域存在明显的互作,结果还显示DOK6蛋白的PH 结构域对DOK6 蛋白与NS1 的相互作用具有削弱作用,可能原因是DOK6 蛋白在未激活状态下,其PH 结构域对PTB 结构域有遮掩作用,需要其它因子的激活使PH 结构域发生构象变化,PTB 结构域才能得以暴露并与NS1 发生相互作用。DOK6 作为一个接头蛋白,其PTB 结构域发生酪氨酸磷酸化后能够结合一些信号分子,研究表明PTB结构域的酪氨酸磷酸化对信号的转导非常关键[9],那么NS1 结合在该部位是否会阻碍这些下游信号的传递,还有待探究。虽然报道表明DOK6 可能参与MAPK 通路的激活[10],但这个过程是否与PTB 结构域有关,目前尚无相关报道。有关DOK6 与NS1 相互作用的分子作用机制有待深入的研究。
猜你喜欢
——一道江苏高考题的奥秘解读和拓展
