基于生长素诱导降解系统条件性敲除弓形虫ATG6蛋白的研究
2019-11-22陈运通陈赫明付佳雯贾洪林
陈运通,陈赫明,付佳雯,庞 宇,郑 君,贾洪林
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室,黑龙江 哈尔滨 150069)
弓形虫为胞内寄生原虫,可感染包括人在内的几乎所有哺乳动物[1]。宿主感染弓形虫后,常呈隐性感染,临床症状不明显[2]。对于免疫力低下人群,艾滋病患者、器官移植者等,弓形虫感染会造成其明显临床症状,表现如高热、脑炎、心肌炎等症状。在妊娠中急性感染弓形虫后常导致流产、死胎或胎儿畸形等[3]。
条件性基因敲除技术对弓形虫关键基因功能的研究以及药物靶点的鉴定具有不可替代的作用。目前弓形虫使用的条件性基因敲除技术是利用四环素调控表达系统[4]。然而,四环素调控表达系统需要长时间作用才能达到调节蛋白表达的效果[5]。近年来,有研究报道生长素诱导降解系统可应用于弓形虫基因的研究, 该方法将生长素诱导降解因子(AID)标签插入到目的基因的3' 端,通过药物筛选重组虫株,该系统能够在弓形虫中快速的、可逆的调控蛋白的表达水平[6-7]。然而,某些基因的3' 端添加标签将导致该基因功能的紊乱。因此,在弓形虫中构建5'端基因融合表达AID标签进行条件性敲除的方法十分必要。
在弓形虫中进行基因敲除,通常通过抗药基因筛选重组虫株。但是这种方法需要添加目的基因的启动子序列以保证基因的正常表达水平,需要进行多个步骤的基因克隆。因此,本研究采用TgKu80基因缺失虫株,通过CRISPR/Cas9 方法和流式细胞术将AID标签定点插入到目的基因的5'端,将标签和目的基因融合表达,利用生长素调控目的基因的降解,从而实现条件性基因敲除。
ATG6 蛋白是PI3K 复合物的组成成分之一,在自噬起始过程中发挥关键作用[8]。有研究表明ATG6蛋白的C 端具有重要功能,不适合添加表达标签[9]。因此,本研究拟构建其 N 端融合表达 AID 的TgATG6 条件性基因敲除虫株,通过生长素调控TgATG6 的蛋白表达水平,为进一步研究TgATG6的功能奠定基础。
1 材料与方法
1.1 主要实验材料 弓形虫RH 虫株、非洲绿猴肾细胞(Vero)以及人包皮成纤维细胞(HFF)为本实验室保存;TgSAG2 兔源多克隆抗体及TgTubulin 兔源多克隆抗体由本实验室制备;HA 鼠源单克隆抗体(MAb)以及 Flag 鼠源 MAb 购自 Sigma 公司;Dy-LightTM800-标记抗鼠IgG 和DyLightTM680-标记抗兔IgG 购自KPL 公司;红色荧光Alexa Fluor 594 标记羊抗兔抗体及绿色荧光Alexa Fluor 488 羊抗鼠抗体均购自Thermo 公司;TIANamp Genomic DNA 提取试剂盒购自TIANGEN 公司;Human T Cell Nucleofector Kit 购自LONZA 公司;植物生长素(NAA)购自日本东京化工公司;pBluescript II KS 质粒、p12HAAID 质粒为本实验室保存;pTUB1-OsTIR1-3Flag 由David Sibley 教授惠赠(Addgene plasmid #87258)。
1.2 载体构建 使用E-CRISP 在线软件(http://www.e-crisp.org/E-CRISP/designcris/html)设计TgATG6基因敲除引导RNA (gRNA)序列(CAGCCGAACTTTGAG AATGA)及TgKu80gRNA 序列(GCGAGTGATTGTC CTGCTCT, CGAGACCCTTAGATCCGCAT),并将该两段序列分别插入到pCD 载体[10-11],构建敲除质粒 pCD-TgATG6及pCD-TgKu80。根据ToxoDB(http://toxodb.org/toxo/)中TgATG6基因序列(TGGT1_221360)及p12HA-AID 质粒中12HA-AID基因序列,设计引物(TgATG6-F:5'-CTGCCTTCAATCGCGCG ATTCTCACAGCCGAACTTTGAGAATGTACCCTTA CGATGTC-3'/TgATG6-R: 5'-GCAGTCGATGCATCG ATGCAAAGACCTGGGAACCATCATCTTCACGAAC GCCGCCGC-3'),以 p12HA-AID 质粒为模板,对12HA-AID全长基因序列进行PCR 扩增,使其带有TgATG6 起始密码子两端的同源臂序列(40 bp),并将扩增产物命名为TgATG6-AID。以常规方法提取的弓形虫RH 虫株的基因组为模板,根据ToxoDB(http://toxodb.org/toxo/)中TgKu80基因序列(TGGT1_312510)设计引物(TgKu80- F1:5'-GAGCACAGATG GACGAAA-3'/TgKu80-R1:5'-TTTGCGAGGAGAATA AGA-3')扩增TgKu80基因的 5' UTR;设计引物(TgKu80-F2:5'-AAAACGAACGATTGCTTC-3'/TgKu80-R2: 5'-CACTGACGTTTTGTCACA-3')扩增TgKu80基因的3' UTR;以扩增的TgKu80基因的5' UTR 及3' UTR 的混合物为模板,以TgKu80-F1/TgKu80-R2为引物进行融合PCR 扩增,将融合的基因片段命名为TgKu80-Arm。以上PCR 扩增产物均通过测序鉴定。
1.3 TIR-3Flag 虫株的构建及筛选 采用电穿孔技术将pTUB1-OsTIR1-3Flag 质粒转入RH 虫株内,正常培养8 h 后,加入氯霉素筛选,正常培养3 代后,使用连续稀释法筛选TIR-3Flag 单克隆虫株并扩大培养,分别以 Flag 鼠源MAb(1∶3 000)及 TgSAG2兔源多克隆抗体(1∶5 000)为一抗,DyLightTM800- 标记抗鼠 IgG(1∶5 000)和 DyLightTM800- 标记抗兔 IgG(1∶5 000)为二抗,利用western blot 鉴定筛选的单克隆虫株;同时,将接种TIR-3Flag 单克隆虫株24 h后的HFF 使用4%的多聚甲醛固定,4 ℃固定30 min后,使用PBS 清洗两次,加入0.3 %的Triton-X 100透膜剂,室温15 min 后使用PBS 清洗两次,加入5 %的BSA/PBS。室温封闭30 min,分别以Flag 鼠源 MAb (1 ∶1 000)及 TgSAG2兔源多克隆抗体(1∶1 000)为一抗,以Alexa Fluor 594 标记的羊抗兔抗体(1∶1 000)及 Alexa Fluor 488 标记的羊抗鼠抗体(1∶1 000 倍稀释)为二抗,使用 DAPI (1∶5 000)染细胞核15 min,利用激光共聚焦(CLSM)鉴定筛选的单克隆虫株,鉴定的阳性虫株命名为TIR-3Flag。
1.4 TIR-3Flag-ΔTgKu80虫株的构建及筛选 使用电穿孔技术将pCD-TgKu80 质粒及 TgKu80-Arm共转染TIR-3Flag虫株,培养16 h后,使用流式细胞分选仪筛选带有绿色荧光的虫株,按照4 只/孔的比例将其接入96孔板的HFF细胞中,7 d后于光学显微镜下观察筛选TIR-3Flag-ΔTgKu80 单克隆虫株并扩大培养,使用试剂盒提取TIR-3Flag-ΔTgKu80虫株的基因组,以P1(5'-TAAGGCTACCCAACTCA C-3')/P4(5'-AGGAAACCGAACCAGAC-3')为引物,利用PCR方法扩增TgKu80基因全长,选取一株阳性虫株的基因组,以P1(5'-TAAGGCTACCCAACTCA C-3')/P2(5'-CTGGCTCTTTCCTAGTCC-3')为引物,利用PCR方法扩增TgKu80的5'UTR基因全长及部分TgKu80的5'基因;以P3(5'-CGCGATAGTATTCAG AGG-3')/P4(5'-AGGAAACCGAACCAGAC-3')为引物,利用PCR方法扩增TgKu80的3'UTR基因全长及部分TgKu80的3'基因,阳性产物经测序鉴定筛选的单克隆虫株。
1.5 TgATG6_iKD 虫株的构建及筛选 使用电穿孔技术将pCD-TgATG6 质粒及TgATG6-AID PCR 产物转入 TIR-3Flag-ΔTgKu80 虫株内,培养16 h 后利用流式细胞分选仪筛选带有绿色荧光的虫株,按照4只/孔的比例将其接入96 孔板的HFF 细胞中,7 d 后于光学显微镜下观察筛选TgATG6 蛋白融合12HA-AID 表达的单克隆虫株TgATG6_iKD 虫株并扩大培养,使用试剂盒提取TgATG6_iKD 虫株的基因组,以P5 (5'-GATGGGAGCACAATTGCCCG-3')/P6 (5'-GTGTGCAGAGCAGTCCTCCG-3')为引物,利用PCR 方法扩增12HA-AID 基因全长,选取一株阳性虫株的基因组,以P5 及P7 (5'-ATCTCACCGGTG GCCATCCC-3')为引物扩增12HA-AID 基因的5' 端,阳性产物经测序鉴定筛选的单克隆虫株。
1.6 生长素诱导降解目的蛋白的检测 将虫株接种6 孔板培养的HFF 细胞接种TgATG6_iKD 虫株,在收集虫体前4 h 加入NAA,同时设置未加入NAA对照组,每组设置3 个平行孔,4 h 后以HA 鼠源MAb (1∶3 000)及 TgTubulin 兔源多克隆抗体(1∶5 000)为 一 抗 , DyLightTM800-标记抗鼠IgG (1 ∶5 000)和DyLightTM800- 标记抗兔 IgG (1∶5 000)为二抗,利用western blot 法检测12HA-AID-TgATG6 的表达水平。
同时,将接种TgATG6_iKD 虫株单克隆虫株24 h后的HFF 使用4%的多聚甲醛固定,4 ℃固定30 min后,使用PBS 清洗两次,加入0.3 %的Triton-X 100透膜剂,室温15 min 后,使用PBS 清洗两次,加入5 %的BSA/PBS。室温封闭30 min,分别以HA 鼠源 MAb (1∶1 000)及 TgTubulin 兔源多克隆抗体(1∶1 000)为一抗,以 Alexa Fluor 594 羊抗兔抗体(1 ∶1 000 倍稀释)及 Alexa Fluor 488 羊抗鼠抗体(1∶1 000倍稀释)为二抗,使用DAPI(1∶5 000)染细胞核15 min,利用激光共聚焦(CLSM)检测12HA- AID-TgATG6 在虫体内的含量。
2 结 果
2.1 载体构建以及PCR 片段扩增 以p12HA-AID质粒为模板,扩增TgATG6-AID,通过测序验证结果显示扩增产物序列与预期相符,表明获得TgATG6-AID 基因片段;以弓形虫基因组为模板,扩增TgKu80基因的5'UTR 及3'UTR,然后将5'UTR及3'UTR 通过融合PCR 扩增,通过测序验证结果显示扩增产物序列与预期相符,表明正确融合扩增TgKu80-Arm。
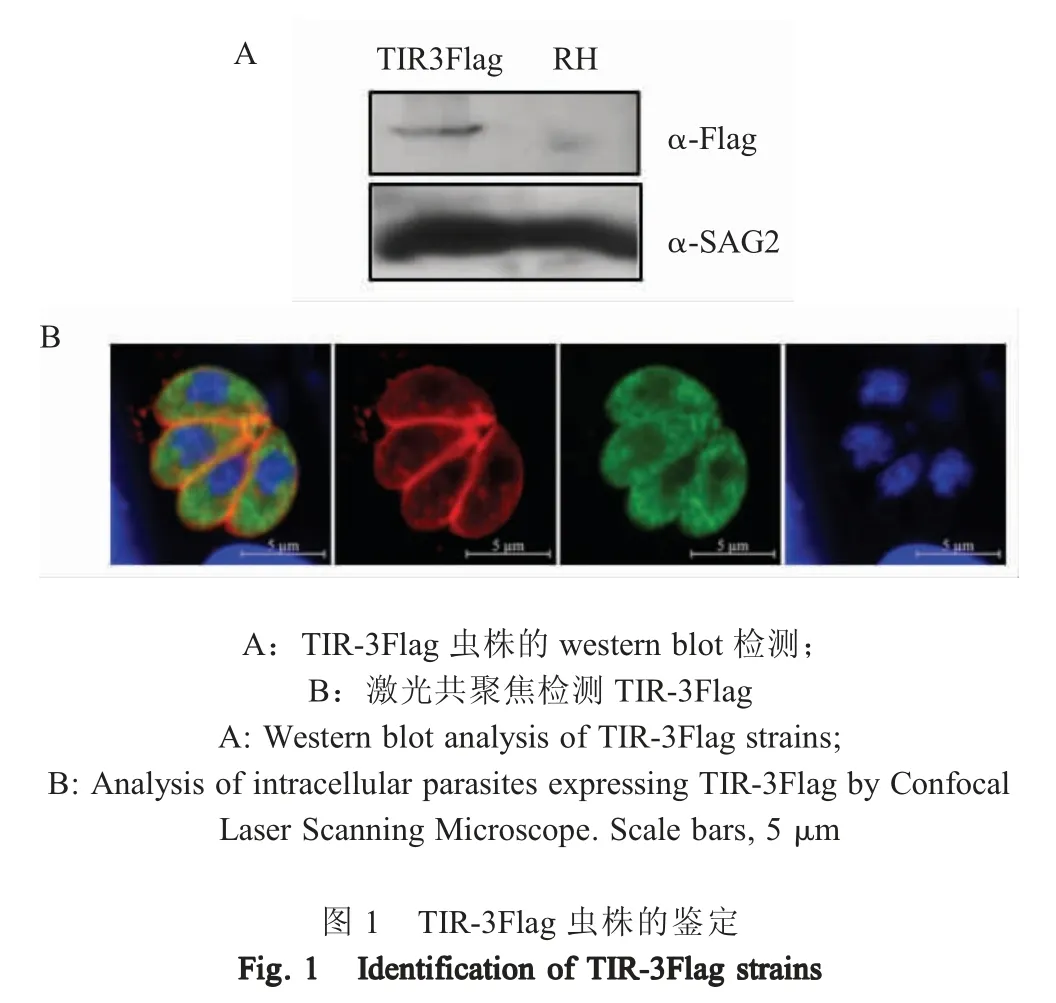
2.2 TIR-3Flag 虫株的鉴定 采用western blot 方法鉴定TIR-3Flag 单克隆虫株, 结果显示,与RH 虫株相比,TIR-3Flag 单克隆虫株检测到55 ku~72 ku的特异性条带(箭头所指条带),其大小与预测相符(图1A)。将TIR-3Flag 单克隆虫株接入HFF 细胞中,培养24 h 后利用IFA 检测TIR-3Flag 的表达,结果显示,可检测到TIR-3Flag (绿色荧光)均匀的分布于虫体胞浆内(图1B)。表明TIR-3Flag 已转入弓形虫体内构建了TIR-3Flag 虫株。
2.3 TIR-3Flag-ΔTgKu80虫株的鉴定利用CRISPR/Cas9 方法将 TIR-3Flag 虫株中的 TgKu80 基因敲除,构建 TIR-3Flag-ΔTgKu80 虫株(图2A)。以TIR-3Flag-ΔTgKu80 虫株的基因组为模板,以P1/P4为引物,PCR 鉴定结果显示,PCR 产物大小为4 140 bp,明显小于 TIR-3Flag 虫株(9 230 bp),同时,TIR-3Flag-ΔTgKu80 虫株无法使用在TgKu80 基因内部设计的引物(P1/P2 或P3/P4)扩增出目的条带(图2B)。序列分析显示,TgKu80 基因被完全敲除。表明获得TgKu80基因敲除的TIR-3Flag-ΔTgKu80单克隆虫株。

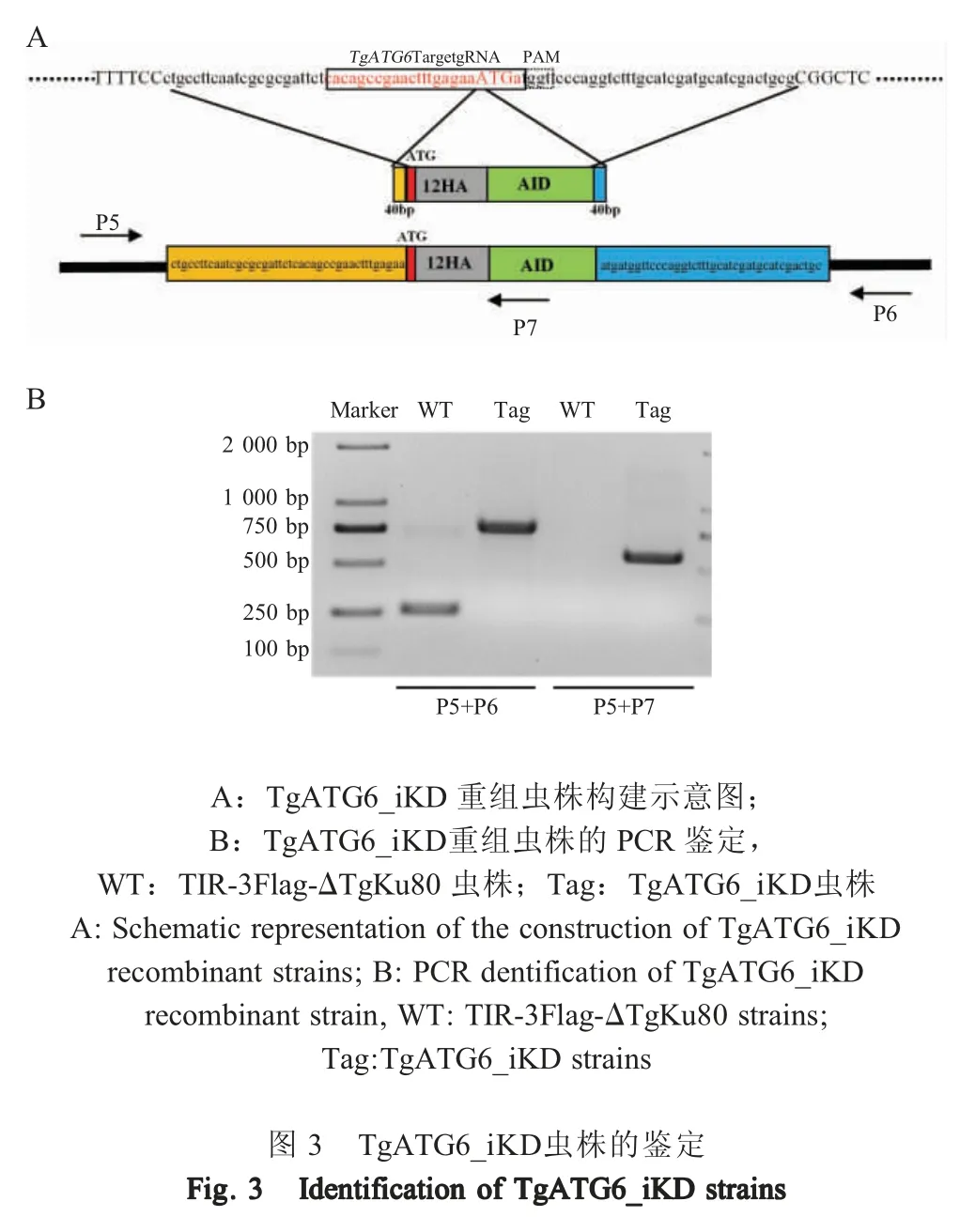
2.4 TgATG6_iKD 虫株的构建及筛选 采用CRISPR/Cas9 方法将12HA-AID 标签插入到TgATG6 基因起始密码子后,使其与TgATG6 融合表达(图3A),获得TgATG6_iKD 虫株。提取TgATG6_iKD 虫株的基因组,对TgATG6_iKD 虫株进行PCR 鉴定,结果显示,在48 个单克隆虫株中,有7 株获得了序列插入,其插入效率约为14.6 %。在12HA-AID 基因内部设计一条下游引物,选取其中一株单克隆虫株进一步进行PCR 验证,结果显示,与野生型虫株相比,TgATG6_iKD 虫株可扩增约590 bp 片段。对扩增产物进一步测序分析结果显示,12HA-AID 标签正确插入TgATG6 基因起始密码子后。以上结果表明获得TgATG6_iKD 单克隆虫株(图3B)。
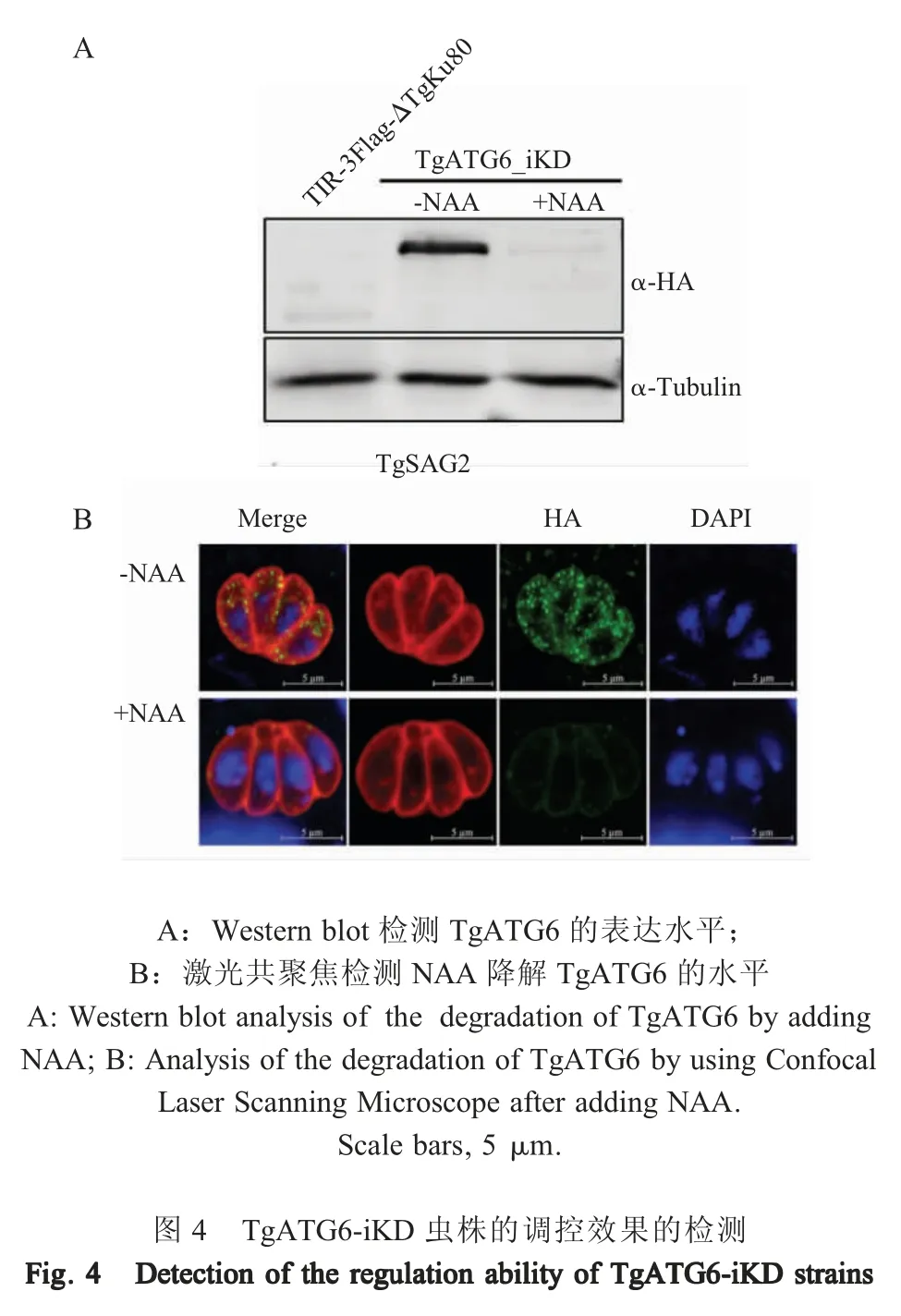
2.5 生长素诱导降解目的蛋白的检测结果 将TgATG6-iKD 虫株接种HFF 细胞,加入NAA 4 h 后检测TgATG6 蛋白表达水平,结果显示,与未加入NAA 的虫株相比,加入NAA 4 h 后,TgATG6 蛋白含量明显下降(图4A)。同时,IFA 结果显示,加入NAA 4 h 后,TgATG6 的蛋白(绿色荧光)表达水平明显下调(图4B)。表明 NAA 可以有效降低 TgATG6在虫体内的含量。
3 讨 论
使用CRISPR/Cas9 技术可敲除目的基因,然而对于某些生长必须的关键基因来说,无法单纯的使用CRISPR/Cas9 技术对其进行完全敲除。因此,条件性基因敲除技术对关键基因功能的研究具有不可替代的作用。
植物生长激素作为植物激素的一种,其参与调控基因的表达水平,AID 蛋白是生长素调控信号通路中的关键因子。当NAA 浓度升高时,NAA 发挥类似分子螯合剂的功能,将AID 和TIR 蛋白参与形成的复合物紧密地结合在一起,TIR 蛋白属于F-box Transport Inhibitor Response 家族成员之一,参与形成E3 泛素连接酶SCF 复合物(Skp1、Cullin1、F-box protein),TIR 通过与SCF 复合物中的其它成分配合,将泛素添加至AID 蛋白,泛素化的AID 蛋白最终通过蛋白酶体途径被降解[12]。近年来,生长素诱导的蛋白表达系统已经应用于酵母细胞[13]、哺乳动物细胞[12]、疟原虫[14]以及弓形虫[6-7]等。生长素诱导的蛋白表达系统与之前广泛应用的四环素诱导的蛋白表达系统相比较具有调控速度快、调控效果明显等优点。
目前在弓形虫中应用的生长素诱导降解系统是将AID 标签连同HXGPRT 抗性基因插入到目的基因的3'端,通过加入霉酚酸(MPA)及黄嘌呤(Xan)两种药物筛选获得单克隆虫株[6-7]。对于3' 端不能融合标签的基因,该方法存在一定的局限性。因此,本研究针对这一问题对目前采用的AID 标签连同HXGPRT 抗性基因插入到目的基因的3' 端这一方法进行改良,从而实现将AID 标签插入弓形虫基因组的任意位置。有研究表明,敲除弓形虫Ku80 基因能抑制虫体内的非同源末端重组修复,提高同源重组修复的效率[15]。本研究基于TIR-3Flag 虫株使用CRISPR/Cas9 技术构建 TIR-3Flag-ΔTgKu80 虫株,同时本研究首次基于TgKu80基因缺失虫株,通过流式术成功高效的获得了插入12HA-AID 标签的虫株。该方法可在不改变基因启动子的条件下将外源性标签插入弓形虫基因组的任意位置,为将弓形虫基因组定点插入提供新的途径。本研究进一步研究表明,生长素可以快速的诱导降解N 端融合表达12HA-AID标签的目的蛋白。本研究为弓形虫关键基因功能研究补充了有效手段。
自噬是真核生物维持细胞稳态的重要机制[16]。当弓形虫处于卵囊期时,无法从外界环境获取充足的养分,自噬途径对于弓形虫的生存来说可能更重要[17]。因此,弓形虫的自噬相关基因是极具应用前景的药物靶点。ATG6 蛋白作为PI3K 的重要组成成分之一,在自噬的起始过程发挥重要的作用[18]。本研究为进一步解析TgATG6 基因的功能打下坚实基础。
