脑梗死后囊腔微环境分析
2019-11-22李秀明刘罡
李秀明,刘罡
1.上海交通大学医学院附属瑞金医院北院,上海市 201801;2.复旦大学附属华山医院,上海市200031
脑梗死是发病率最高的脑血管疾病,也是世界范围内引起死亡和严重残疾的主要原因之一[1-2]。在众多治疗策略中,细胞替代治疗让新生的神经细胞替代脑梗死后死亡的神经细胞,十分具有临床应用前景。自神经干细胞分离成功以来[3],经过数十年发展,其体外培育、扩增和定向分化技术已经非常成熟,能为移植治疗提供充足的供体细胞。
囊腔是脑组织缺血坏死后的终产物。脑梗死急性期大量炎性细胞和炎性因子浸润[4-5],这些炎性细胞和因子在慢性期会发生何种变化尚不清楚,是否适宜移植神经干细胞的存活和分化尚不能确定。此外,脑梗死除造成神经组织坏死外,也会损伤缺血区的血管结构[6-7],导致囊腔内缺乏微血管,移植细胞可能无法获得足够养分。本研究观察囊腔内液化学成分和囊腔壁血供情况,以初步探索囊腔微环境,分析其是否适宜干细胞移植,为神经干细胞移植部位选择提供参考。
1 材料与方法
1.1 实验动物
雄性Sprague-Dawley 大鼠20 只,2~3 月龄,体质量220~260 g,SPF 级,购买于复旦大学实验动物部,并饲养于该中心SPF 环境中。许可证号SYXK(沪)2014-0029。室温(22±1)℃,日光灯6:00~18:00照明模拟明暗周期。每笼饲养大鼠4~5 只,给予充足饲料及饮用水,定期专人更换垫料。
实验中所涉及的动物操作均按照国际实验动物伦理及福利标准施行,并严格遵守复旦大学实验动物伦理规定。
1.2 动物模型的制备
采用线栓法制作大鼠永久大脑中动脉缺血(middle cerebral artery occlusion,MCAO)模型。
大鼠吸入1.5%异氟烷麻醉,仰卧位固定于操作台上,颈部剃毛备皮,安尔碘局部消毒。颈部正中纵行切口,钝性分离左颈总动脉、颈外动脉和颈内动脉,结扎左颈外动脉远心端,同时在其近心端打一个小活结,其间斜剪一小切口,将线栓(深圳瑞沃德科技公司)沿切口插入近心端,打紧活结。斜切口剪断颈外动脉,将线栓近心端下拉,直至与颈内动脉呈一直线,将线栓沿颈外动脉插入颈内动脉,术者感到有阻力感,约距左颈总动脉分叉处18 mm 处,停止插入。此时线栓硅胶头位于大脑中动脉处。将颈总动脉连同线栓尾部的尼龙线一起结扎,剪断多余部分,缝合皮肤。
1.3 神经行为学评分
大鼠麻醉苏醒后,立即按Longa 法对大鼠进行行为学评分,以评价造模是否成功。0 分,无神经功能缺损;1 分,提鼠尾使其倒立,右侧上肢不能完全向地面伸展;2分,自发行走时向右侧转圈;3分,自发行走时身体向右侧倾倒;4 分,意识丧失不能自发行走;5分,死亡。
1~3分的动物用于后续实验。
1.4 MRI
术后3 d、10 d 和21 d,大鼠前法麻醉,采用MAGNETOM Trio Tim 3.0 T 核磁共振成像仪(德国SIEMENS 公司)采集图像,信号接收使用4 通道动物线圈。MRI检测序列及参数如下。T1WI:TR 550 ms,TE 12 ms,层厚2.0 mm,15 层,FOV 60×60 mm,矩阵320×256,分 辨 率0.2×0.2×2.0 mm。T2WI:TR 3330 ms,TE 68 ms,层厚1.0 mm,18 层,FOV 50×50 mm,矩 阵256×256,分 辨 率0.2×0.2×1.0 mm;FLAIR:TR 2000 ms,TE 12 ms,层厚2.0 mm,15层,FOV 60×60 mm,矩阵256×256,分辨率0.2×0.2×2.0 mm。观察梗死后空腔形成情况,获取空腔及侧脑室坐标。
1.5 囊腔内液及脑脊液抽取
术后23 d,选MRI 扫描确认囊腔形成的大鼠,前法麻醉,头部固定于脑立体定位仪(美国DAVID KOPF 公司)上,使大鼠上切牙根部低于外耳道连线(耳间线)3 mm,保持大鼠颅顶处于水平面上。剔除颅顶毛发,消毒皮肤。切开皮肤、皮下组织和颅顶骨膜,少量3%H2O2涂布术区,充分止血并显露前后囟。以前囟为基准点,根据MRI获取的侧脑室和囊腔中心点坐标调整立体定位仪,牙科钻颅骨钻孔,直径0.5 mm,暴露硬脑膜。钻孔时滴加生理盐水,保持暴露部位湿润。立体定位仪移动臂将25 μl 微量进样器缓慢插入囊腔中心,留置2 min 后缓慢抽取囊腔内液,留针5 min,退针。同法侧脑室抽取脑脊液。囊腔内液和脑脊液分组别混匀,-70 ℃低温冰箱(美国HARRISZHIZ公司)冰冻保存。
1.6 囊腔
1.6.1 大体观察与取材
实验动物深度麻醉处死,经心脏灌注生理盐水200 ml,后灌注4%多聚甲醛300 ml,取脑,观察囊腔大体解剖情况。为更好显示脑膜血管,1 只实验动物未经心脏灌注。大脑置4%多聚甲醛固定过夜;10%、20%、30%、30%梯度蔗糖脱水沉底;OCT 包埋剂(日本SAKURA 公司)包埋,冷冻后RM213 冰冻切片机(德国LEICA公司)切片,厚20 μm。
1.6.1 HE染色
冰冻切片流水冲洗后苏木素(碧云天公司)染10 min,酒精性伊红复染30 s,95%、95%、100%、100%梯度乙醇脱水,二甲苯透明,中性树胶封片。光学显微镜观察。
1.6.2 Lectin染色
冰冻切片加10%正常山羊血清(碧云天公司)室温孵育2 h;异硫氰酸荧光素-葡聚糖(美国SIGMA 公司)标记的兔抗Lectin 一抗(美国SIGMA 公司,1∶1000)4 ℃孵育48 h;TBS 缓冲溶液漂洗3 次,每次10 min,封片。随机选取脑梗死周边区及梗死对侧大脑相对区域各3 个高倍镜视野,采集图像并观察囊腔形态及周边组织构造。
1.7 质谱检测
对混匀的脑脊液和复融后的囊腔液分别进行质谱检测及数据分析。Bradford 法测定蛋白浓度,12%SDS-PAGE 电泳银染。各样品中加入适量4% SDS、50 mmol/L Tris.HCl(pH=7.5)充分混匀,加入DTT 使终浓度为100 mmol/L,95 ℃加热5 min。冷却后加UA 缓冲液200 μl,转入30 K filter 中,12 000 r/min 离心15 min;再加UA 缓冲液200 μl,12 000 r/min 离心15 min。加50 mmol/L IAA溶液100 μl,室温避光放置20 min,12 000 r/min 离 心15 min。加50 mmol/L NH4HCO3100 μl,12 000 r/min 离心15 min,重复2次。加Trypsin 50 μl 37 ℃酶解过夜。加50 mmol/L NH4HCO3溶液50 μl,12 000 r/min 离心15 min。收集管中酶解产物,冷冻干燥,0.1%甲酸水复溶。取样品2 μg行液质联用Obitrap检测。
取酶解产物20 μl,加0.1%甲酸水400 μl 和SCX 6.0 μl,充分混匀,12 000 r/min 离心15 min,取上清于干净EP 管中,标记为ft;加入pH4 缓冲400 μl 充分混匀,12 000 r/min 离心15 min,取上清置干净EP 管中,标记为pH4;加pH6 缓冲400 μl 充分混匀,12 000 r/min 离心15 min,取上清置干净EP 管中,标记为pH6;最后加入25%氨水、50%乙腈溶液400 μl充分混匀,12 000 r/min 离心15 min,取上清置EP 管中,标记为pH10。不同组分收集液冷冻干燥后,0.1%甲酸水充分溶解。
将各分级组分转入进样瓶中,取适量液质联用检测。各分级洗脱梯度2 h,色谱柱为C18 3 μm,120 A,75 μm ID,长150 mm。QExactive 质谱 检测,MaxQant进行数据分析。
将囊腔液与脑脊液质谱分析结果进行对比,筛选差异分子。筛选标准为分子浓度比>2.0 或<0.5,倍数变化最高前10种分子为显著差异分子。筛选出的差异分子GeneCard检索,分析其主要功能。
2 结果
2.1 脑梗死后囊腔形成
术后3 d,MRI 示坏死区组织肿胀,信号不均匀;10 d 坏死区囊腔形成,囊腔内有T1低信号、T2高信号液体信号;21 d坏死区囊腔形态基本稳定。见图1。
2.2 囊腔大体解剖
囊腔由坏死区周边正常脑组织与软脑膜共同构成,软脑膜完整,表面存在血管。见图2。
2.3 HE染色
囊腔中心无细胞结构;部分囊腔壁由软脑膜构成,脑膜结构完整,其上可见脑膜血管;囊腔中心与脑膜交界处可见大量细胞聚集。见图3。
2.4 Lactin染色
囊腔周围可见血管分布,与对侧相应脑区相比,未见明显差异。见图4。
2.5 差异分子
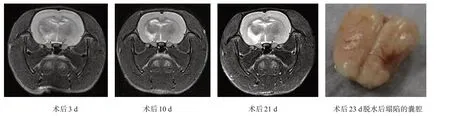
图1 脑梗死后囊腔形成
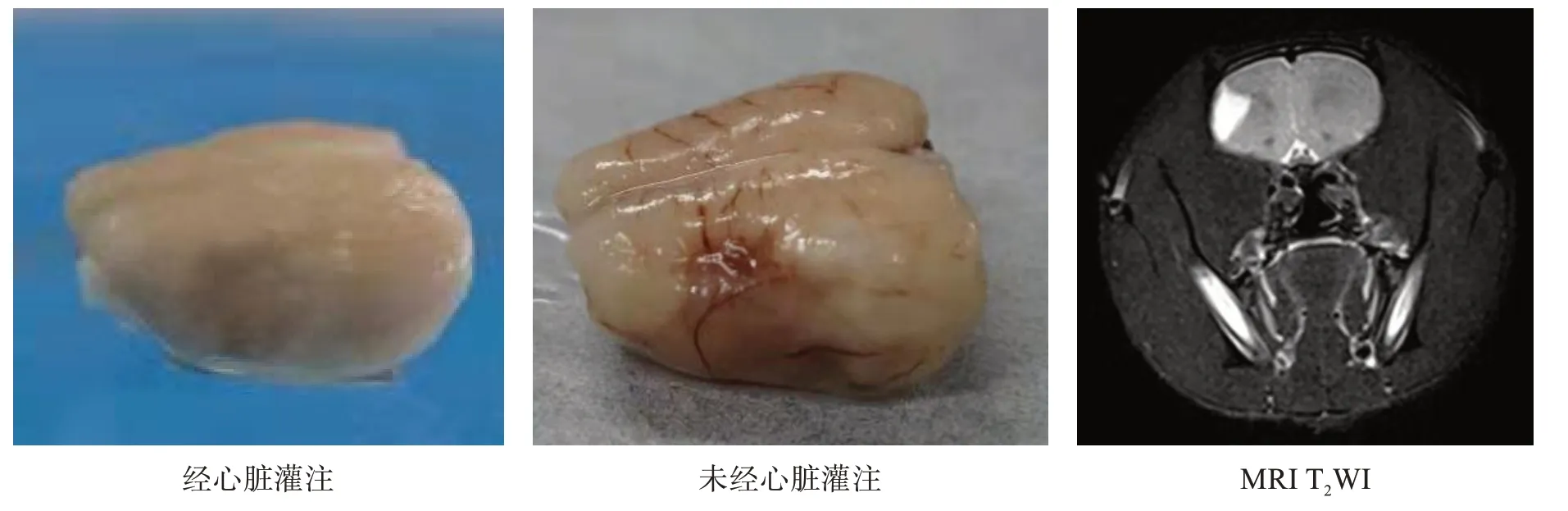
图2 囊腔大体解剖
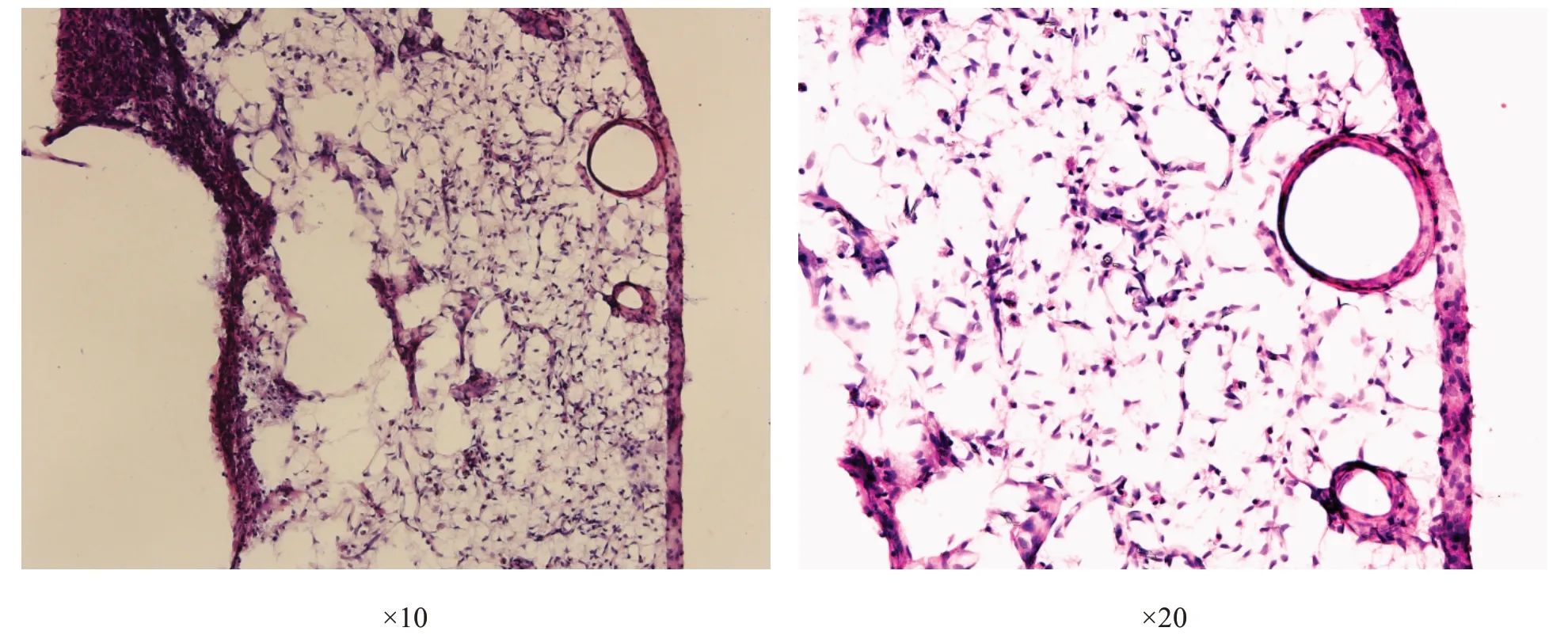
图3 囊腔周边HE染色
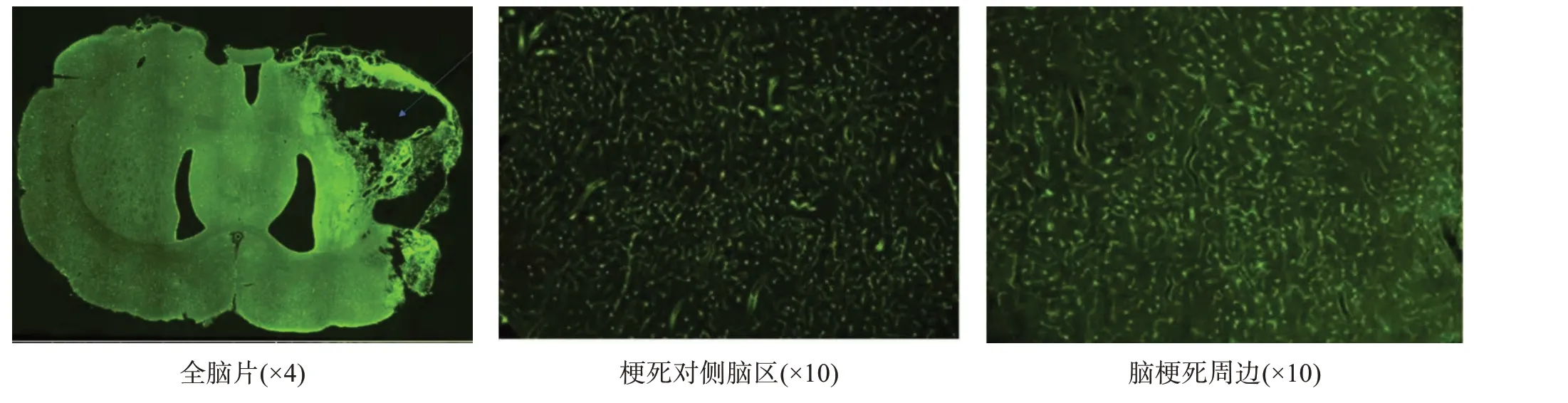
图4 囊腔周边Lactin染色
共筛选出36种差异分子,其中31种上升,5种下降。相对浓度变化最大的10 种分子见图5。经检索,其中6 种显著差异分子对干细胞移植具有正面促进作用,如抗炎、抗肿瘤、促进神经细胞存活等。NCAN(神经黏蛋白)是由神经元分泌的特异性蛋白质,广泛分布于神经系统,可与神经元细胞膜上特异性受体神经黏附分子和胶质细胞黏附分子结合,调节细胞连接,影响轴突生长;在中枢神经系统损伤后其表达增加,并抑制轴突生长。BCAN(短蛋白聚糖)为神经细胞外基质分子,在胶质增生过程中表达增高。PLA2G7(血小板活化因子乙酰水解酶)可明显减轻血小板活化因子和氧化磷脂的炎症介质效应,抑制氧化应激连锁反应,对血管内皮有保护作用。SPARCL1(富含半胱氨酸的酸性分泌蛋白样蛋白1)可能抑制肿瘤生成。NELL2(神经上皮生长因子样蛋白2)可促进神经细胞存活及生长。LGALS3BP(半乳糖凝集素-3结合蛋白)可促进整合素介导的细胞黏附,可能刺激抗病毒及肿瘤防御。
未发现能促进神经干细胞向神经元分化的相关分子,而促进向胶质增生分化的相关分子较多,另外一些分子,如神经黏蛋白,可能阻碍神经轴突生长。囊腔微环境可能主要诱导神经干细胞向胶质方向分化。

图5 囊腔液/脑脊液质谱分析结果(相对分子倍数变化)
2.7 质谱分析
急性期反应信号通路分析显示参与急性期反应的分子表达减少,急性期反应通路抑制;经典通路分析示抗炎及抗凋亡相关蛋白表达增加。囊腔内液分子重要网络分析示,囊腔内液分子主要涉及神经系统疾病、细胞聚集与组织形成、组织发育、肿瘤和结缔组织紊乱。见图6~图9。
3 讨论
脑梗死后缺血区神经元大量死亡,组织结构破坏,可引起相应的功能障碍[8-10];基于神经可塑性的功能代偿往往并不充分,由缺血性损伤诱发的内源性神经再生也极为有限,远不能替代缺血所致的神经元丧失[11]。因此,脑梗死后功能障碍常持续存在[1]。
神经干细胞移植可通过调控炎症反应、神经保护及营养、增加突触可塑性、促进内源性神经细胞再生等非细胞替代机制,减少缺血性损伤程度,促进部分神经功能恢复[12-13]。但受脑内微环境影响,由移植细胞分化而来的成熟神经元数量低[14],无法重建坏死区组织结构。寻找脑梗死后适宜移植神经干细胞生长的微环境,对提高移植治疗效果极为重要。
不同移植部位微环境特点各有不同[12]。在缺血坏死区周围或对侧脑实质内移植,移植细胞向坏死区迁移受限,且由于脑实质结构致密,存在形成假瘤的风险[15];通过动静脉系统移植[16-17],细胞不易穿过血脑屏障到达梗死部位;通过脑室系统移植,移植细胞可随脑脊液播散,或因脑脊液屏障存在,不易在坏死区大量聚集[18]。
在缺血坏死区,因急性期组织坏死产生大量炎性细胞和坏死因子,不利于细胞存活,曾被认为是移植效率较低的部位。但脑梗死发生后,受累组织依次经历缺血水肿、炎性渗出、坏死液化等病理变化,最终会在缺血坏死区形成囊腔样结构。囊腔形成的病理过程始于脑血流中断后导致的能量代谢障碍,继而引发一系列瀑式反应,最终导致细胞死亡和组织崩解[4,19-21]。同时,小胶质细胞被缺血性损伤激活,大量增殖,在损伤部位和缺血半暗带区聚集。外周免疫细胞也可通过损伤的血脑屏障渗入梗死区,与小胶质细胞共同介导梗死后免疫反应,吞噬清除坏死组织,最终在缺血坏死区形成囊腔样结构。这一过程可能需要数周时间。本研究显示,脑梗死后3 周,梗死区即可形成形态稳定的囊腔,其内充满脑脊液样信号,提示囊腔内主要是液体成分。充裕的液体空间可为移植的神经干细胞提供类似于体外培养的液体环境,有利于细胞集落形成。
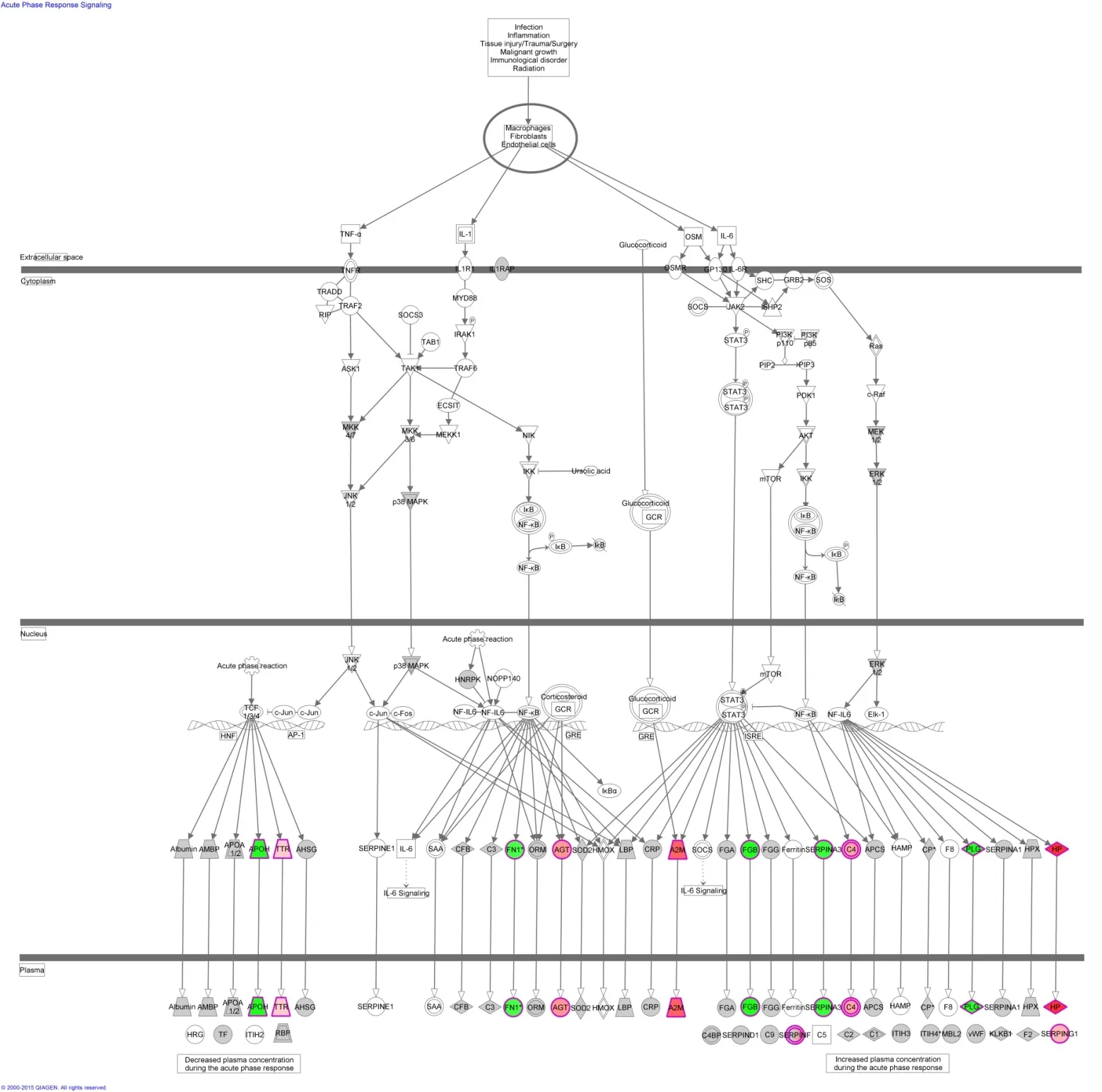
图6 囊腔液质谱分析(急性期反应信号通路)
脑梗死急性期,小胶质细胞过度激活(M1 表型),可通过产生活性氧、一氧化氮,分泌大量炎性因子,导致神经细胞损伤,抑制神经干细胞分化。而在囊腔形成的慢性期,小胶质细胞适度激活(M2表型),产生抗炎细胞因子,分泌神经营养因子,如脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)和胶质源性神经营养因子(glial cell-derived neurotrophic factor,GDNF)等,发挥神经保护和神经营养作用,促进神经前体细胞增殖和神经母细胞迁移[5,22]。脑梗死后激活后的免疫细胞可能发挥双向调节作用[5]。本研究显示,脑梗死3 周后,与脑脊液相比,囊腔内液参与急性炎症反应的蛋白表达减少,抗炎和抗凋亡相关蛋白表达增加,促进神经生长、黏附聚集和基质生成的相关蛋白表达增加,有利于移植神经干细胞存活。但应当注意,尽管囊腔内液对干细胞移植有促进作用,但可能主要诱导神经干细胞向胶质细胞分化,这可能是目前外源性成熟神经元数低下的主要原因。
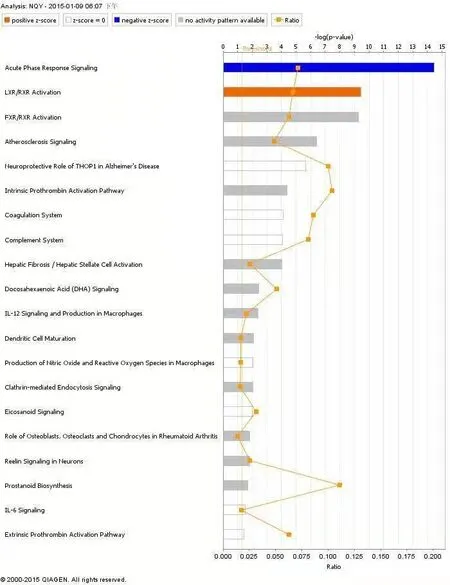
图7 囊腔液质谱分析结果(经典通路分析)
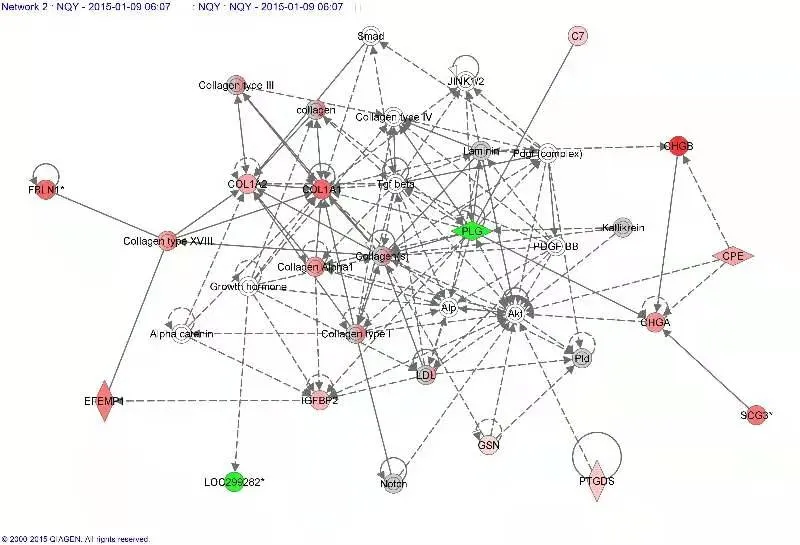
图9 重要相关网络2(肿瘤、神经系统疾病、结缔组织紊乱)
充足的血供是移植细胞存活、增殖、分化并产生神经功能的前提。本研究显示,囊腔周边脑组织和软脑膜内均存在大量血管。原因可能在于脑实质与脑膜分属两套供血系统,颈内动脉系统缺血导致脑实质梗死,而脑膜因其血供来源于颈外动脉系统而常常保持完整,且脑膜血管可能因脑组织缺血而发生代偿性扩张[6,23-24]。此外,在脑梗死周边区域,缺血本身可诱导新生血管生成[25-26]。脑梗死数小时后,梗死周边胶质细胞、血管内皮细胞等即可上调血管内皮生长因子(vascular endothelial growth factor,VAGF)、一氧化氮合酶等促血管因子和其受体表达,促进血管内皮细胞增殖、迁移和血管新生,在梗死后数天即可在梗死灶周边检测到新生血管,此促血管新生作用可持续数周[27]。血管新生被认为是对脑梗死的代偿性反应,有助于减少脑梗死体积,并促进脑梗死后内源性神经发生和突触重塑,从而促进神经功能恢复。脑梗死后囊腔壁存在基本血液供应,可为贴壁的移植细胞提供养分支持。囊腔的相对封闭性可能允许对其进行外源性调控,如利用囊腔置管和液体置换调控囊腔微环境。可以进一步研究。
本研究从囊腔内液分子成分和血供两方面评价了囊腔微环境对神经干细胞移植的可能影响,但还存在一些局限性。首先因实验动物体型限制,抽取囊腔液体含量较少(每只大鼠25~50 μl),没有进行体外干细胞培养实验,不能直接判定囊腔内环境的影响。针对囊腔内缺乏细胞支架的缺点,可考虑利用聚乳酸-羟基乙酸共聚作为支架,促进移植的干细胞修复缺损组织结构[28-29]。
综上所述,脑梗死慢性期形成的囊腔作为一个相对封闭的液体空间,具备神经干细胞移植的基本条件,适宜移植细胞存活。但微环境中有关分子成分多促进神经干细胞向胶质细胞分化,还需要外源性手段干预,使其有利于移植细胞向神经元分化。
