蛛网膜下腔出血后M4型瞬时受体电位通道对大鼠脑动脉肌源性紧张度的作用研究
2019-11-21龚益杜明月李洋洋周磊杨力杨智勇王飞
龚益 杜明月 李洋洋 周磊 杨力 杨智勇 王飞
蛛网膜下腔出血(SAH)后脑血管异常收缩导致的脑血管痉挛,是SAH预后不良的病理基础,其分子机制仍不清楚。M4型瞬时受体电位通道(transient receptor potential melastatin 4,TRPM4)在脑动脉肌源性紧张度的生理调节机制中起着不可取代的核心作用[1],对于维持脑动脉肌源性紧张度以及在脑血流的调节中起着至关重要的作用[2]。本课题组前期研究证实,SAH对TRPM4通道活性具有诱导作用[3],SAH后TRPM4在大鼠脑动脉平滑肌细胞中的表达明显增加,TRPM4可能作为SAH后脑血管痉挛的关键因子发挥作用。本研究探讨SAH后TRPM4对大鼠脑动脉肌源性紧张度的影响,有利于进一步研究TRPM4在SAH后脑血管痉挛中的致病作用。
1 材料与方法
1.1 实验动物及分组
清洁级健康SD大鼠60只,性别不限,体质量300~350 g,由昆明医科大学动物实验中心提供,动物合格证号:SCXK(滇)2011-0004。单笼饲养,自由饮水,饲以普通动物饲料,饲养室温19~26 ℃,湿度40%~70%,12 h光照/黑暗交替,并根据昆明医科大学医学研究委员会制定的实验动物保健原则和昆明医科大学实验动物资源研究所发布的实验动物使用指南,对大鼠进行人文关怀。将其按随机数字法分为SAH组(30只)及假手术组(30只)。
1.2 SAH模型建立
利用立体定向仪辅助,向大鼠鞍上池内注射鼠尾自体动脉血建立SAH模型[4]。术前禁食、禁饮1 d,予以10%水合氯醛(济南嘉格生物科技有限公司) 0.4 ml/g体质量腹腔注射麻醉,穿刺鼠尾动脉抽取动脉血(不加抗凝剂)。将大鼠头部固定于立体定向仪上(江湾2型,安徽正华生物仪器设备有限公司),门齿杆高度低于水平面约3.3 mm,使前囟与人字点位于同一水平面,沿中线切开头皮,向两侧剥离骨膜及颞肌后,在前囟前方7.0 mm中线上钻一直径约1.5 mm的骨孔,以7号金属针沿正中矢状面经该骨孔向颅腔穿刺,针尾向前方倾斜30°,穿刺深度8~9 mm,见清亮脑脊液抽出,证实针尖已达到鞍上池。向SAH组注入0.2 ml自体鼠尾动脉血,向假手术组注入0.2 ml等渗盐水,注射时程均为12 s。
1.3 分离大鼠脑动脉
SAH后第5天,大鼠予以上述麻醉方法麻醉后断颈处死。迅速分离出全脑组织并置于低温(4 ℃)人工脑脊液(artificial cerebrospinal fluid,aCSF),aCSF成分如下:125 mmol/L氯化钠,3 mmol/L氯化钾,18 mmol/L碳酸氢钠,1.25 mmol/L磷酸二氢钠,1 mmol/L氯化镁,2 mmol/L 氯化钙,5 mmol/L葡萄糖,氢氧化钠调节pH至 7.30。操作显微镜下锐性分离大鼠脑动脉Willis环,并置于低温aCSF中备用。
1.4 大鼠脑动脉肌源性紧张度检测
将大鼠脑动脉Willis环制成长1.8~2.0 mm的血管段,两端与玻璃微导管连接并固定于肌动扫描仪浴槽内,再将玻璃微导管与灌流压力自动调节装置连接,使脑动脉管腔内持续有aCSF单向流动,并维持管腔内压力恒定于40 mmHg。aCSF持续通入5%CO2、20%O2和75%N2的混合气体,加热至 37 ℃并保持温度恒定。使用WinDAQ数据采集软件(DATAQ Instruments,美国)通过与显微镜连接的视频监视系统(Living Systems Instrumentation,美国)测量动脉直径的变化并描计动脉管径变化曲线。进行加压肌动扫描实验前,使用含60 mmol/L氯化钾的等渗盐水对动脉段进行短时间的灌注以测定动脉活性,动脉收缩后直径减小<50%的动脉段被视为活性较差,不纳入实验检测对象。进行加压肌动扫描实验时,对每个实验组动脉均采用时间贯序法依次更换浴槽内液体,从而检测动脉处于不同液体环境下的管径大小。首先检测各实验组脑动脉位于aCSF中的管径(DaCSF),并以此为基线制作大鼠脑动脉加压肌动扫描曲线,再检测向浴槽中加入0.03 mmol/L TRPM4特异性阻滞剂,即9-菲酚(9-phenanthrol,9-Phe,Sigma公司,美国)[5]后的脑动脉管径(DaCSF+9-Phe),最后将浴槽内液体更换为含0.1 mmol/L地尔硫卓的无钙人工脑脊液(Ca2+-free aCSF)检测脑动脉管径(DCa2+-free aCSF)。通过以下公式计算肌源性紧张度(%)=(DCa2+-free aCSF-DaCSF或DaCSF+9-Phe)/ DCa2+-free aCSF[6],其中TRPM4所介导的肌源性紧张度为各实验组脑动脉位于aCSF中的肌源性紧张度减去加入9-Phe后的肌源性紧张度,即加入9-Phe后肌源性紧张度的下降程度。
1.5 统计学分析

2 结果
2.1 大鼠脑动脉管径
SAH后,加压肌动扫描实验显示,脑动脉分别位于aCSF、aCSF+9-Phe及Ca2+-free aCSF时,脑动脉管径呈增大趋势(图1)。脑动脉位于aCSF中时,SAH组大鼠脑动脉管径较假手术组明显减小(P<0.05)。加入9-Phe后,SAH组和假手术组脑动脉管径较加入9-Phe前均有增加,脑动脉管径舒张明显,差异均有统计学意义(均P<0.05)。脑动脉位于含0.1 mmol/L地尔硫卓的无钙aCSF中时,两组脑动脉管径差异无统计学意义(P>0.05)。见表1。
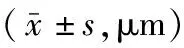
表1 SAH组与假手术组大鼠脑动脉位于不同aCSF中的管径(D)大小比较
注:SAH为蛛网膜下腔出血,aCSF为人工脑脊液,9-Phe为9-菲酚,Ca2+-free aCSF为含0.1 mmol/L地尔硫卓的无钙人工脑脊液;DaCSF为位于aCSF中脑动脉管径,DaCSF+9-Phe为位于9-Phe aCSF中脑动脉管径,DCa2+-free aCSF为位于Ca2+-free aCSF中脑动脉管径;与组内DaCSF比较,aP<0.05
2.2 肌源性紧张度
SAH后,SAH组脑动脉肌源性紧张度明显高于假手术组(P<0.05)。加入9-Phe后,SAH组与假手术组脑动脉肌源性紧张度明显下降(P<0.05)。SAH组中肌源性紧张度的下降程度(TRPM4所介导的肌源性紧张度)明显大于假手术组(P<0.01),见表2。

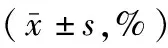
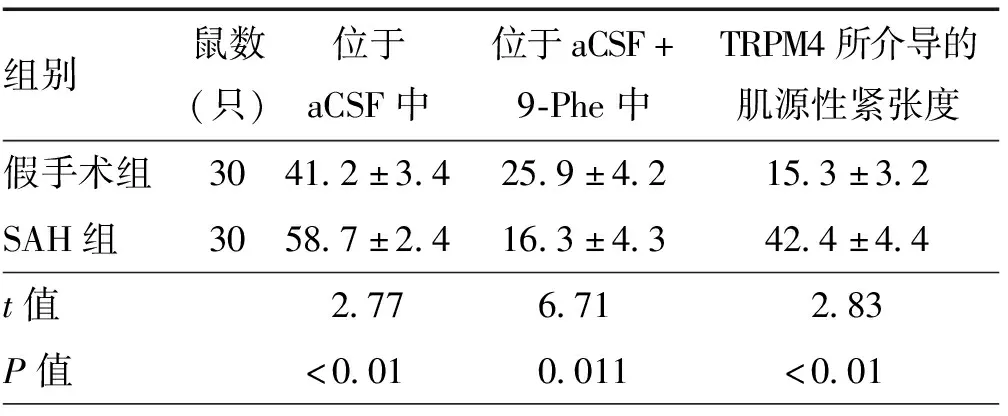
组别鼠数(只)位于aCSF中位于aCSF+9-Phe中TRPM4所介导的肌源性紧张度假手术组3041.2±3.425.9±4.215.3±3.2SAH组3058.7±2.416.3±4.342.4±4.4t值2.776.7102.83P值<0.01000.011<0.0100
注:SAH为蛛网膜下腔出血,aCSF为人工脑脊液,9-Phe为9-菲酚,TRPM4为M4型瞬时受体电位通道
3 讨论
研究证实,TRPM4能够调节淋巴细胞中的细胞因子分泌和胰腺β细胞中的胰岛素分泌,还参与控制前Bötzinger复合体神经元的呼吸节律发生及多发性硬化疾病中神经轴突和神经元的变性[7-9]。在心血管系统中,TRPM4参与心肌细胞缺氧后的早期去极化[10],其基因的突变与心肌传导阻滞相关,表明该通道参与心脏浦肯野纤维的功能[11]。
TRPM4 mRNA被证实存在于脑动脉平滑肌细胞中,其对压力诱导的脑动脉平滑肌细胞去极化、脑动脉肌源性紧张度和脑血流的调节至关重要[1]。TRPM4最为重要和显著的特性为机械敏感性,其可以感知血压和其他类型的机械刺激,将细胞外物理信号转换成细胞内信号,导致脑动脉平滑肌细胞收缩和脑动脉肌源性紧张度的形成。脑血流调节包括肌源性因素、代谢性因素、神经性因素,其中肌源性因素最为重要[12-14]。研究报道,对具有一定肌源性紧张度的大鼠离体脑动脉使用TRPM4抑制剂,可导致脑动脉平滑肌细胞超极化和脑动脉近乎完全扩张,表明TRPM4在脑动脉平滑肌细胞压力依赖性去极化和脑动脉肌源性紧张度调节中起关键作用[5]。Reading和Brayden[2]研究显示,向大鼠第三脑室注入TRPM4反义核苷酸,可引起脑动脉平滑肌细胞TRPM4表达下调,使脑动脉血流增加。因此TRPM4对于脑动脉功能调节是必需的。
本研究表明,SAH后,大鼠脑动脉管径缩小,肌源性紧张度增加,对TRPM4活性进行抑制后,大鼠脑动脉管径舒张,肌源性紧张度明显下降,且SAH组大鼠脑动脉肌源性紧张度较假手术组下降明显,表明SAH后,TRPM4介导大鼠脑动脉肌源性紧张度增加。TRPM4活性为脑动脉肌源性紧张度发展和维持所必需,是调节脑动脉功能的关键因子。脑动脉对于腔内压力改变而表现出的肌源性反应是脑血流调节机制的关键因素,该肌源性反应在TRPM4被抑制后明显减弱,也可认为TRPM4与SAH后脑血流自身调节障碍密切相关,并高度提示TRPM4可能是SAH后介导脑血流自身调节的关键分子之一。
本研究的意义在于阐明TRPM4在SAH后脑血管痉挛中的作用,为研究SAH后脑血管痉挛提供了一种新的研究思路以及新的潜在治疗靶点。
