葡萄EST-SSR标记的开发及其在遗传多样性分析中的应用
2019-11-21毛娟梁国平卢世雄马宗桓王萍陈佰鸿
毛娟,梁国平,卢世雄,马宗桓,王萍,陈佰鸿*
(甘肃农业大学园艺学院,甘肃兰州 730070)
葡萄(Vitis vinifera)为葡萄科(Vitaceae)葡萄属(VitisL)植物,浆果,多年生落叶木质藤本[1]。目前,全世界保存的葡萄资源有5000~15 000个品种。分子标记技术目前广泛应用于植物遗传图谱构建、分子标记辅助选育、遗传多样性分析、基因定位、杂种纯度及真伪鉴定等方面,分子标记的类型也在不断丰富,SSR标记应用尤其普遍,主要是由于其具有样品信息量、多态性、重复性高的特点,另外操作较为简单,具有共显性和等位检测成本低的优势。葡萄树童期长、树体大,是高度杂合体,因而遗传学研究被限制,在遗传育种中需要耗费大量的人力、物力及时间。分子标记很大程度能够提高育种选择效率。表达序列标签微卫星(EST-SSR)是建立在SSR标记技术上的一种新型的分子标记技术,利用EST-SSR构建图谱,可直接将与目标性状相关的EST标记定位在不同的遗传图谱上,为进一步进行遗传多样性分析、亲缘关系和种质资源鉴定、基因定位等方面的研究提供帮助[19]。
近年来,在葡萄中EST-SSR基因标记研究已开始应用,公共数据库中葡萄EST的数量在不断增加,这些EST资源丰富了葡萄的基因组序列信息,为大量SSR的开发提供便捷。SSR指以少数几个核苷酸为单位多次串联重复的DNA序列[2],SSR相比于其他分子标记技术具有明显的特点,主要为多态性和重复性高、共显性、易被PCR检测、数量丰富和对基因组有很好的覆盖性等[3]。基于EST开发的SSR标记在萝卜[4]、草莓[5]、梨[6]、刺梨[7]、胡桃[8]、芒果[9]、印度南瓜[10]、菜薹[11]、菊花[12]、中国樱桃[13]、大豆[14]、小麦[15]、荞麦[16]等许多植物种类中得到应用。植物中开发的EST序列中SSR分布的频率差异很大,但都包含2%~5%的SSR序列,生物技术的发展和试验成本的降低,急剧增加了公共数据库中EST数量,这为植物EST-SSR的开发提供了价值丰富的可利用资源。尽管葡萄的EST-SSR应用已经较为广泛,但也存在一些不全面之处。郭磊等[17]对8925条葡萄EST进行了SSR分析,验证了所开发EST-SSR的真实性,但没有对单核苷酸进行分析。吴曼颖[18]对19份腺枝葡萄进行EST-SSR标记,探讨了腺枝葡萄与其他葡萄品种之间的亲缘关系,但是没有对砧木进行研究。王娟等[1]主要对野生种、半野生种到栽培品种演变过程进行了遗传标记分析,通过聚类分析研究了62个葡萄品种之间的亲缘关系,且验证EST-SSR在葡萄种质分类鉴定中的可行性,但选用的酿酒品种不是很多。
EST-SSR源自基因编码序列,直接与功能基因相关。SSR位点多位于转录区,保守程度更高,转移频率较大,不同物种间有较好的通用性[20]。开发EST-SSR标记可以通过几个步骤:NCBI上EST序列的获得,软件搜寻SSR位点,引物的设计,SSR位点多态性与遗传多样性的验证。本研究利用EST-SSR标记对葡萄品种进行遗传多样性分析,为葡萄种质资源合理利用及亲本标记提供参考依据。
1 材料和方法
1.1 植物材料
本试验所用的52个葡萄样品采自甘肃省兰州、民勤、嘉峪关基地(表1)。于2017年4月—5月采集幼叶,藏于-80 ℃的冰箱冷藏备用。
1.2 葡萄EST序列的获得及EST-SSR的发掘
从GenBank中以FASTA格式下载葡萄EST序列,用CD-HIT(http://www.bioinformatics.org/cd-hit/)在线软件去冗余,SSR Server(http://www.rosaceae.org/cgi-bin/gdr/gdr_ssr)在线搜索SSR。搜索条件为:单、二、三核苷酸重复类型的最小重复数分别为20、6和5,四、五、六核苷酸重复类型的最小重复数均为4。
1.3 DNA的提取、PCR扩增与电泳检测
1.3.1 DNA的提取
采用改进的CTAB 法提取葡萄叶片DNA。
1.3.2 PCR扩增
PCR反应体系10 µL,2×Taq PCR-supermix 5 µL,上、下游引物各1.0 µL,模板DNA 1 µL,ddH2O 2 µL。反应程序为:94 ℃预变性4 min,94 ℃变性1 min,55 ℃退火40 s,72 ℃延伸1 min,30个循环; 72 ℃延伸7 min,最后4 ℃保存。PCR扩增产物采用8%非变性聚丙烯酰胺凝胶电泳检测,200 V电泳2.5 h。电泳结束后银染显色,银染后在观片箱上观测电泳结果,并照相记录。
1.4 EST-SSR数据统计与分析
根据聚丙烯凝胶电泳图谱中每个样品的扩增结果按有或无条带作记录,扩增条带存在赋值为1,否则赋值为0,获得矩阵,利用NTSYS 2.10e数据软件Qualitativedate程序计算相似系数,并获得相似系数矩阵;利用Excel软件进行制图;利用SHAN程序和UPGMA方法进行聚类分析,通过Tree-plot模块生成聚类图。

表1 供试葡萄(Vitis vinifera Linn)材料Table 1 Grape (Vitis vinifera Linn) accessions used for this study
2 结果与分析
2.1 葡萄基因组DNA的提取结果
采用改良的CTAB法提取了葡萄52个品种的基因组DNA,利用8%的琼脂糖进行电泳检测,52个品种的DNA条带清楚、完整性好,可以进行下一步的PCR扩增。
2.2 引物的筛选与扩增结果
2.2.1 葡萄EST-SSR出现的频率及比例
从GenBank中以FASTA格式下载的葡萄EST序列220 547条,利用SSR Server在线搜索软件共搜索到34 305条SSR序列,分别位于20 687条EST序列中,占EST总数的9.3%,表明葡萄EST中SSR含量比较丰富。
葡萄EST-SSR中出现最多的重复类型为单核苷酸、二核苷酸和三核苷酸,三者共占EST-SSR总数的95.7%。其中单核苷酸占74.23%,二核苷酸占11.49%,三核苷酸占10.00%。而其余三种重复类型所占的比例很小,仅为4.26%。其中以四核苷酸所占的比例最多,占2.29%;其次是六核苷酸和五核苷酸,分别为1.10%和0.84%。
2.2.2 葡萄EST-SSR中的基元种类及比例
在葡萄EST-SSR中,共观察到337种基元种类,单核苷酸至六核苷酸重复类型的基元种类分别为2、8、30、80、61和156,总体上随核苷酸数的增大而增多,但五核苷酸例外(图1)。

图1 葡萄EST-SSR各重复类型包含的基元种类Figure 1 Kinds of motif in every repeat type of EST-SSRs in grape
从出现比例来看,出现最多的基元是A/T(17 164个,占72.35%),其次分别为TC/GA(975个,占4.11%)和CT/AG(931个,占3.92%)。
单核苷酸中,A/T占绝对优势(72.35%),而G/C很少(487个,占1.84%)。二核苷酸中,TC/GA所占比例最高(4.11%),其次为CT/AG(931个,占3.92%)、AT(363个,1.53%)。三核苷酸中,基元的比例呈逐渐降低的趋势,TCT/AGA、TTC/GAA所占比例最高(0.96%、0.93%),其次为AAG/CTT(200个,占0.84%)和AGC/GCT(143个,占0.60%),GAT/ATC(132个,占0.56%)、TGG/CCA(130个,占0.55%)、TGC/GCA(126个,占0.53%)和TGA/TCA(125个,占0.52%)。四核苷酸中,比例最多的为AAAT/ATTT(74个,占0.31%),其次为TAAA/TTTA(52个,占0.22%)、TTTC/GAAA(41个,占0.17%)和TTAT/ATAA(33个,占0.14%)(图2)。
五核苷酸中比例最多的是ATTTT/AAAAT(23个,占0.09%)。六核苷酸中比例最多的是CCCTGA/TCAGGG(10个,占0.04%),其它各类基元均在0.2%以下。

图2 葡萄EST-SSR中主要基元及比例Figure 2 The major motif and their percentages of EST-SSRs in grape
2.2.3 葡萄EST-SSR中各类型不同重复次数的出现频率
由表2可以看出,葡萄EST-SSR中各类型的不同重复次数的出现频率相差很大,但总体上随着重复次数的增多,其出现频率逐渐降低。在单核苷酸中,出现频率最高的重复次数为29,其次为20、21和22;二核苷酸中,出现频率最高的重复次数为6,其次为7、8和9;三核苷酸中,出现频率最高的重复次数为5,其次为6、7和8;四、五核苷酸中,不同重复次数出现频率的趋势基本相同,出现频率最高的重复次数为4,其次为5、6和7;六核苷酸中,出现频率最高的重复次数为4,其次为5、6和8。共设计出25对引物。
2.3 葡萄EST-SSR标记的多态性及对品种的遗传多样性分析
25对葡萄EST-SSR在52份葡萄材料上的扩增结果表明,21对引物能扩增出明显的条带,引物的有效扩增率达84.0%,其中有14对引物扩增出明显的多态性条带,占有效扩增引物的66.7%。图3和图4分别为引物Z5M5和Z2M18在52份葡萄材料中部分扩增的电泳图。
25对引物中,有9对引物扩增出预期大小片段,另有7对引物扩增出大于预期长度的DNA片段,5对引物只扩增出小于预期长度的DNA片段,有4对引物几乎没有扩增出明显的DNA片段。
2.4 聚类分析
利用软件NTsystem统计EST-SSR数据,采用UPGMA法计算各品种间的遗传距离,进而得到树型图(图5)。从图5中可以看出,供试的52个葡萄品种在遗传距离为0.67时,将‘294’和‘贝达’聚为Ⅰ类,其余聚为Ⅱ类。Ⅰ类约在0.91处将‘294’和‘贝达’区分开来,Ⅱ类约在0.71处将‘5A2’‘420A’‘101-14’‘黑292’和‘奥古斯特’聚为Ⅲ组,其余为Ⅳ组。其中Ⅲ组的‘5A2’和‘420A’又在0.77处区分开,‘奥古斯特’在0.87处区分出来。Ⅳ组在0.74处将5BB区分开来,在0.78处‘红双味’‘夏黑’等聚为一组,将‘龙紫旺’‘雷司令’和‘早熟无核’等聚为另一组,在0.84处将‘早熟无核’和‘里扎马特’聚在一起,并区分开来。‘超级无核’和‘3-1-1’在此聚类分析中并未区分开,它们可能是同物异名的品种。分析结果基本与形态学和生物学分类一致,表明本研究所开发的EST-SSR标记可用于葡萄种质资源的遗传多样性分析。
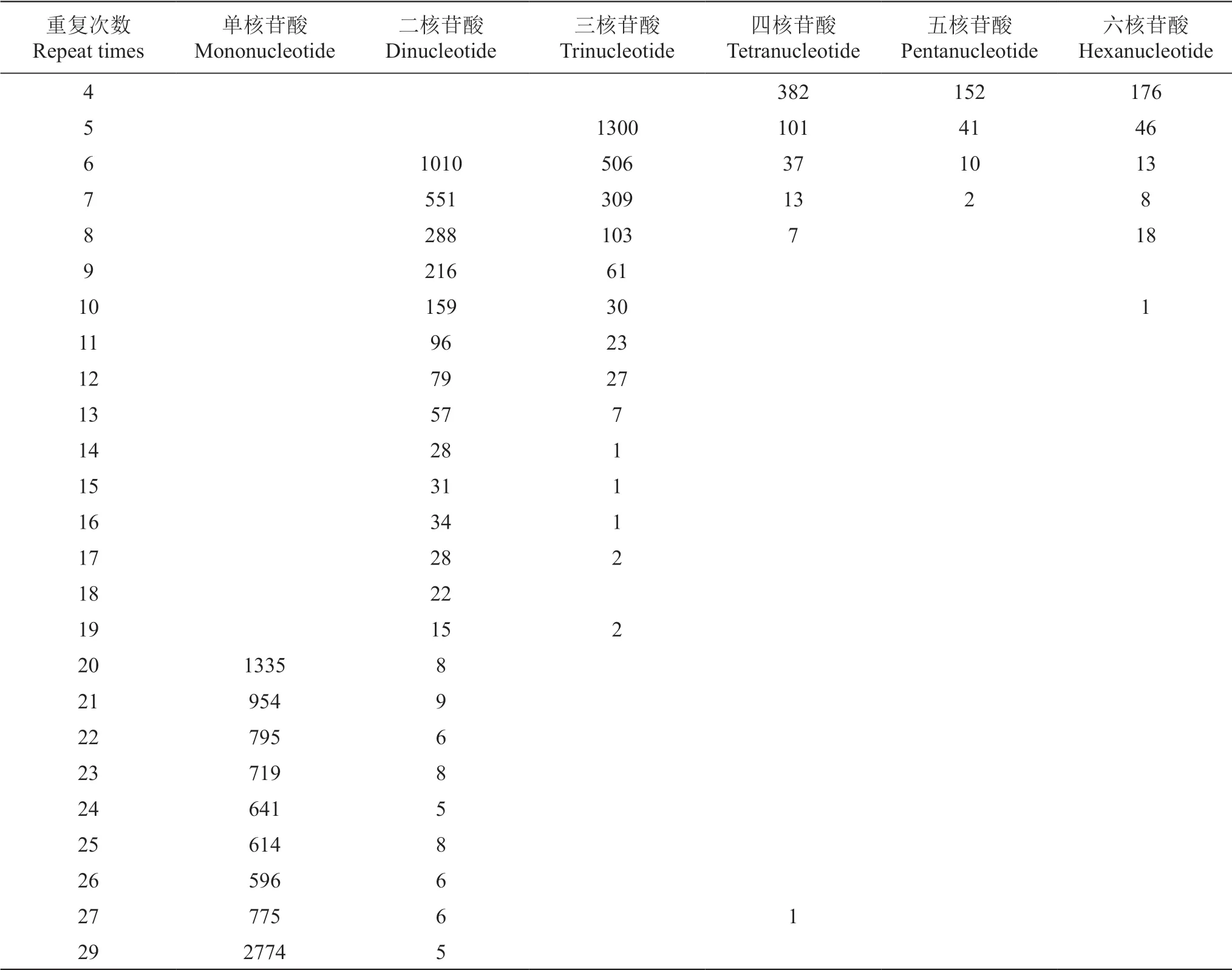
表2 葡萄EST-SSR中各重复类型中不同重复次数的出现次数Table 2 The frequency of different repeat times in every repeat types of EST-SSRs in grape

表3 葡萄EST-SSR引物信息表Table 3 Information of EST-SSRs primers in grape
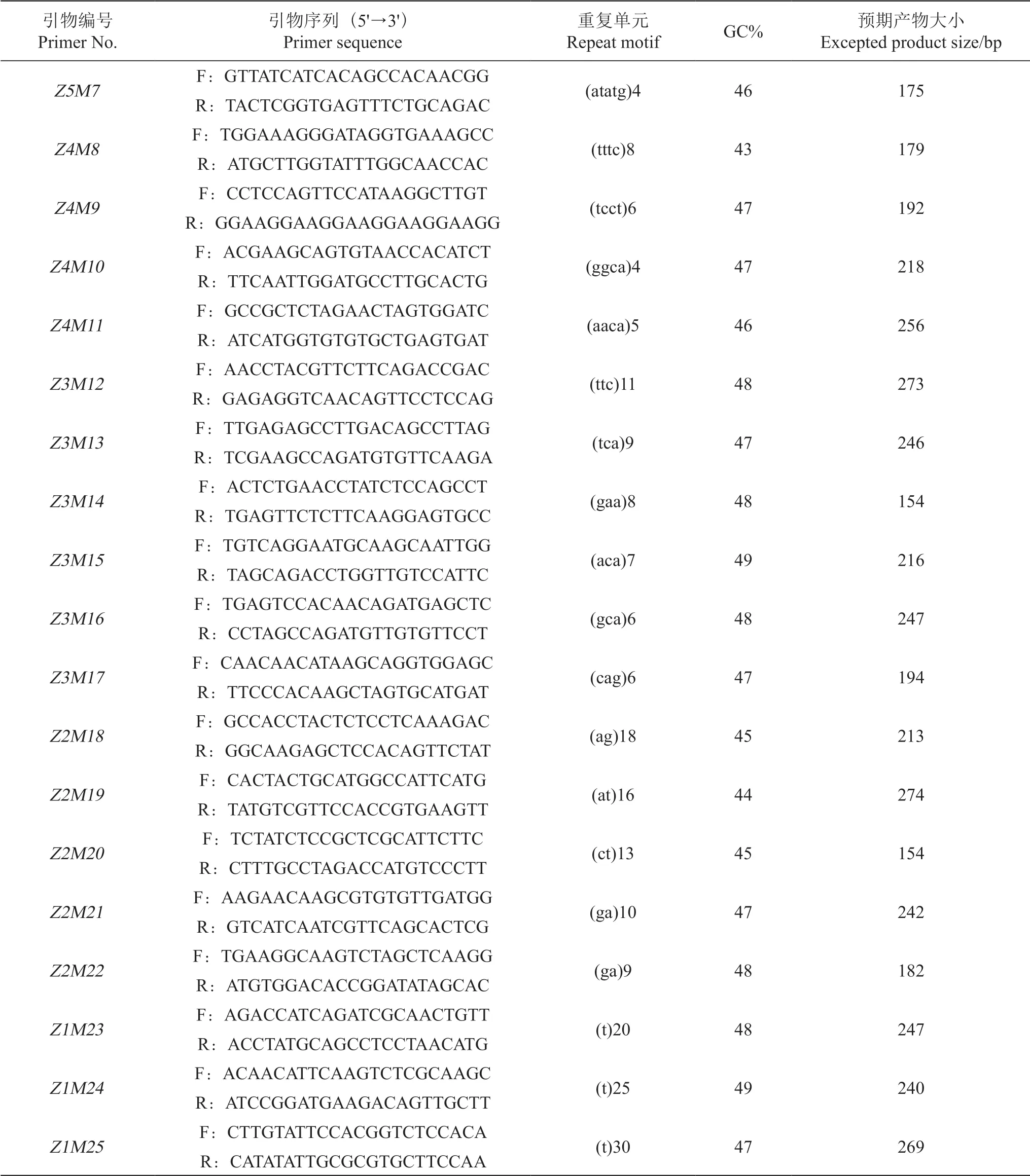
续表3 Continued table 3

图3 引物Z5M5在28份葡萄材料上的PCR扩增图Figure 3 PCR amplification profile of 28 varieties by primerZ5M5 in grape
3 讨论与结论
本研究从220 547条葡萄EST序列中共搜索到20 687条至少含有一个SSR的EST序列,占EST总数的9.3%,高于郭磊等[17]对葡萄EST-SSR的搜索结果(6.5),这可能是由于搜索标准和数据库大小的不同而造成的。研究表明,不同植物间EST的SSR分布频率大不相同,如葡萄(9.3%)、萝卜(6.4%)、草莓(2.67%)、梨(7.12%)[4-6]、小麦(2.52%)、辣椒(7.83%)、荔枝(8.99%)[15,21-22]的频率较低,频率较高的包括刺梨(20.37%)、中国樱桃(15.62%)[7,13]、桃(20.76%)、黄皮(17.14%)、万寿菊(28.29%)[23-25]。本研究25对引物中有9对引物扩增出预期大小片段,有12对引物扩增出大于或小于预期长度的DNA片段,有4对引物几乎没有扩增出明显的DNA条带,这可能是由于引物特异性不强,扩增出其它与引物同源的序列;扩增出大于预期长度的DNA片段是由于扩增出了包含外显子和内含子的DNA序列[26]。

表4 葡萄25对EST-SSR引物扩增出多态性条带数Table 4 Grapes 25 to EST-SSRs primers amplification polymorphism bands

图4 引物Z2M18在29份葡萄材料上的PCR扩增图Figure 4 PCR amplification profile of 29 varieties by primer Z2M18 in grape

图 5 25对EST-SSR 引物对52份葡萄材料的聚类图Figure 5 Dend program of 25 varieties based on 52 EST-SSRs markers in grape
SSR侧翼序列的保守程度和SSR本身进化的稳定性决定了一个物种的SSR引物在不同物种间的通用性[17]。SSR引物在不同物种间的通用可以显著提高标记的利用价值,从而有效地弥补物种分子标记的不足,丰富标记数量。来源于传统基因组的SSR在物种之间的通用性很差,作为基因的一部分,EST-SSR的侧翼序列在物种之间高度保守,因此EST-SSR引物在物种间具有较高的通用性[27]。
在大多数物种中二核苷酸和三核苷酸是最常见的EST或者转录组SSR重复基序的类型[28-30],但葡萄中丰富的SSR重复基序是六核苷酸重复,其次是四核苷酸重复,分别占SSR总数的46.29%和23.73%,合计占总SSR的70.02%,其次为18.10%的五核苷酸重复,最少的是单核苷酸和二核苷酸基序重复。葡萄中以六核苷酸和四核苷酸为主要SSR重复基序的情况与辣椒类似[26]。葡萄中以六核苷酸和四核苷酸SSR基序为主体,而单核苷酸、二核苷酸和三核苷酸SSR基序的分布占少数,可能是自然选择的结果。本研究结果表明,利用葡萄转录组数据开发SSR标记具有可行性,同时这些标记的开发为葡萄种质资源遗传多样性分析、分子标记辅助育种、遗传图谱构建和功能基因的挖掘等奠定了基础。
