超声辅助分步结晶法制备高纯度豆甾醇的工艺研究
2019-11-20冯文欢吴正章金青哲王兴国
冯文欢,吴正章,张 鹏,常 明,金青哲,王兴国
(1.江南大学 食品学院,国家功能食品工程技术研究中心,江苏 无锡 214122; 2.江苏科鼐生物制品有限公司,江苏 泰兴 225400)
植物甾醇是一类以环戊烷全氢菲为基本骨架的天然活性化合物[1],广泛存在于各类植物种子、坚果和植物油中,主要包括菜籽甾醇、菜油甾醇、豆甾醇和β-谷甾醇等。植物甾醇具有降低机体总血清胆固醇和低密度脂蛋白胆固醇水平[1-2]、降低心脏疾病风险[3]、抗氧化[4]、消炎[5]和抗癌[6]等生理功能。近年来,植物甾醇在食品、医药和化工等领域受到广泛关注,截至2015年全球植物甾醇的需求量高达1.8万t左右[7],且以豆甾醇为原料合成的甾体药物需求量大幅提升[8]。如何有效分离高纯度豆甾醇并规模化生产,以满足市场需求具有重要的社会意义和经济价值。
目前,由于高纯度豆甾醇的价格高昂,降低豆甾醇制备成本是工业化生产亟待解决的问题。常见的植物甾醇分离纯化方法主要有化学衍生法、色谱法和溶剂结晶法等。化学衍生法将植物甾醇衍生化,增大各甾醇单体间的物性差异后再进行分离,但此工艺步骤烦琐,成本高且产率低,难以规模化生产[9];色谱法主要利用制备级液相色谱通过优化流动相配比达到分离各甾醇单体的目的,此法色谱纯级溶剂消耗量大且制备量小,工业化生产成本高[10-11];溶剂结晶法利用植物甾醇单体之间显著的溶解度差异,通过升温降温促使饱和溶液体系中豆甾醇率先结晶析出,此法虽结晶次数较多,但制备工艺易于工业化生产且产品纯度较高。目前的溶剂结晶法主要采用单一溶剂如环己酮[12]、正戊醇[13]、正丁醇[14]等非极性溶剂进行多次结晶,其纯度往往无法再通过增加结晶次数得到更高纯度的豆甾醇产品,且豆甾醇得率较低。研究表明:液体介质经超声处理后,由涡流或超声波产生的“空化”作用能够促进晶体成核,提高晶体生长速率并防止晶体聚集,缩短结晶时间并提高结晶产率;而且超声处理能够改变晶体粒度,缩短结晶过滤周期,加快晶体干燥速度,大大缩短豆甾醇的生产工艺周期[15-16]。
本文采用超声辅助分步结晶法,富集阶段筛选出环己酮为结晶溶剂,经5次结晶富集得到纯度95%左右的豆甾醇粗品;精制阶段筛选出丙酮为结晶溶剂,引入超声辅助处理以提高精制过程中豆甾醇的得率,最终获得纯度99%以上豆甾醇产品。本文通过单因素实验探究了豆甾醇纯化过程中料液比、养晶时间、养晶温度、超声时间和超声功率等条件,为工业化生产高纯度豆甾醇提供了解决方案。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
98%植物甾醇(豆甾醇约占30.9%),由江苏科鼐生物制品有限公司提供;正己烷为色谱纯,购自百灵威科技有限公司;环己酮、丙酮等试剂及药品均为分析纯,购自国药集团化学试剂有限公司;BSTFA+TMCS(99∶1)硅烷化试剂,购自百灵威科技有限公司。
1.1.2 仪器与设备
EL204型电子天平,梅特勒-托利多仪器(上海)有限公司;KQ-300DE数控超声波清洗器,昆山市超声仪器有限公司;QGC-12T氮气吹干仪,上海泉岛公司;循环水式多用真空泵,上海泸西分析仪器有限公司;DHX-3015低温恒温槽,南京舜玛仪器设备有限公司;ZK-82BB型电热真空干燥箱,上海实验仪器厂有限公司;GC-MS(ISQ)气相色谱-质谱联用仪,Thermo Fisher公司;Nexus傅里叶变换红外光谱仪,美国尼高力仪器公司;AdvanceⅢ 400MW全数字化核磁共振波谱仪,德国布鲁克AXS有限公司。
1.2 实验方法
1.2.1 豆甾醇的富集
取50 g植物甾醇与非极性溶剂按一定配比加至250 mL夹层酶反应器中,连接低温恒温槽,开启循环水浴加热至65℃,充分搅拌直至样品完全溶解后,恒温平衡30 min后降温至一定温度,养晶,抽滤,滤饼真空干燥至恒重,称重。所得晶体用上述方法反复结晶,实现豆甾醇的富集。
1.2.2 豆甾醇的精制
取10 g豆甾醇富集产物与极性溶剂按一定配比加至100 mL圆底烧瓶中加热至60℃,充分搅拌直至样品完全溶解后,静置平衡30 min,置于超声波清洗器中,保持超声温度60℃,用不同的超声功率处理一段时间后,将圆底烧瓶在一定温度下静置养晶,抽滤,滤饼真空干燥至恒重,称重。将所得晶体用上述方法反复结晶,实现豆甾醇的精制。
1.2.3 豆甾醇纯度的测定
样品预处理:称取5 mg豆甾醇样品于10 mL容量瓶,用正己烷稀释至刻度。取0.1 mL溶液于2 mL离心管内,氮气吹干溶剂,加入200 μL硅烷化试剂,置于75℃水浴内30 min,过0.22 μm有机滤膜,进样检测,依据峰面积归一化法测定样品纯度。
气相色谱条件:DB-5色谱柱(30 m×0.25 mm×0.25 μm);升温程序为200℃保持0.5 min,10℃/min升温至300℃,保持18 min;检测器温度和进样口温度均为280℃;进样量1.0 μL;分流比100∶1;载气为99.99%氦气,载气流速1.2 mL/min;程序运行时间为28.5 min。
1.2.4 豆甾醇得率计算
豆甾醇得率=结晶样品质量×结晶样品中豆甾醇的纯度/(结晶原料质量×结晶原料中豆甾醇的纯度)×100%。
1.2.5 结构鉴定
红外光谱(FT-IR):将分离提纯制得的豆甾醇充分干燥后,使用KBr压片法,扫描范围为400~4 000 cm-1,扫描次数为32,分辨率为4 cm-1。
核磁(1H NMR):通过核磁共振谱仪分别对豆甾醇进行氢谱的分析,以氘代氯仿为溶剂,在400 MW条件下进行测定。
1.2.6 数据分析
每组实验平行测定3次,求平均值,实验数据以“平均值±标准偏差”表示。使用SPSS 20.0软件进行单因素方差分析(ANOVA)计算不同参数下的显著性差异,P<0.05表示组间数据在0.05水平上存在显著性差异,以a、b、c表示。
2 结果与讨论
2.1 豆甾醇富集工艺的单因素实验
2.1.1 溶剂的选择
控制料液比1∶4、养晶温度25℃、养晶时间24 h,选取正丙醇、正戊醇、异戊醇、环己酮、正丁醇和异丁醇作为结晶溶剂,考察溶剂对豆甾醇富集效果的影响,结果见图1。

图1 溶剂种类对豆甾醇纯度的影响
由图1可知,6种溶剂均具备富集豆甾醇的能力,其中环己酮的富集效果最佳,因此选择环己酮作为豆甾醇富集过程的溶剂。
2.1.2 料液比的选择
控制养晶温度25℃、养晶时间24 h,考察不同料液比对豆甾醇纯度和得率的影响,结果如图2所示。

图2 料液比对豆甾醇纯度和得率的影响
由图2可知,随料液比增大,豆甾醇的纯度整体呈增大趋势,当料液比大于1∶3.5时,豆甾醇纯度增大不显著。这是因为溶剂用量越大,结晶体系过饱和度越低,较好的晶体完整性有利于甾醇纯度的提升;在料液比小于1∶3.5时,由于体系过饱和度较大,导致晶体产生快速不均匀性生长现象,大量纯度较低的晶体析出导致整个体系黏稠,增加结晶抽滤和去除溶剂的难度;而当料液比介于1∶3.5~1∶4时,豆甾醇纯度相对于较低料液比时显著提高且得率仍为57%左右。综合考虑,选择1∶3.5为豆甾醇富集的最佳料液比。
2.1.3 养晶温度的选择
选取料液比1∶3.5、养晶时间24 h,考察不同养晶温度对豆甾醇纯度和得率的影响,结果如图3所示。

图3 养晶温度对豆甾醇纯度和得率的影响
由图3可知,豆甾醇纯度随养晶温度的升高先缓慢提升后降低,得率随养晶温度升高而降低,尤其30℃时得率相比于20~25℃时显著下降约25个百分点。养晶温度直接涉及是否需要加热设备,综合考量纯度、得率及温度对规模化生产设备的需求,选取养晶温度25℃较合适。
2.1.4 养晶时间的选择
选取料液比1∶3.5、养晶温度25℃,考察不同养晶时间对豆甾醇纯度和得率的影响,结果如图4所示。

图4 养晶时间对豆甾醇纯度和得率的影响
由图4可知,随养晶时间的延长,豆甾醇纯度呈缓慢上升趋势,而得率先升高再降低。当养晶至16~20 h时,豆甾醇纯度和得率均无显著变化。综合考虑,养晶时间控制在16 h较为合适。
根据上述单因素实验结果,得到富集过程最优工艺条件为:以环己酮为溶剂,料液比1∶3.5,养晶温度25℃,养晶时间16 h。在最佳条件下,经过重复5次富集,制备得到了纯度达到94.69%的豆甾醇粗品,并以此粗品为原料进行豆甾醇的精制结晶制备工艺探究。
2.2 豆甾醇精制工艺的单因素实验
实验结果表明环己酮作为溶剂无法进一步提高产物纯度。据专利[17]报道非极性溶剂体系难以分离纯化高纯度的豆甾醇,因此通过改变溶剂体系,实现豆甾醇的精制。
2.2.1 溶剂的选择
控制料液比1∶65、养晶温度25℃、养晶时间4 h,考察甲醇、乙腈、丙酮、乙醇、异丙醇5种极性溶剂对豆甾醇精制效果的影响,结果如图5所示。

图5 溶剂种类对豆甾醇纯度的影响
由图5可知,使用甲醇、乙腈和乙醇结晶后的豆甾醇纯度降低,无精制效果,异丙醇仅提升豆甾醇纯度不足1个百分点,而丙酮能够显著提高豆甾醇纯度2.5个百分点,起到精制豆甾醇的目的。因此,后续实验采用丙酮作为溶剂进行豆甾醇的精制。
2.2.2 超声时间的选择
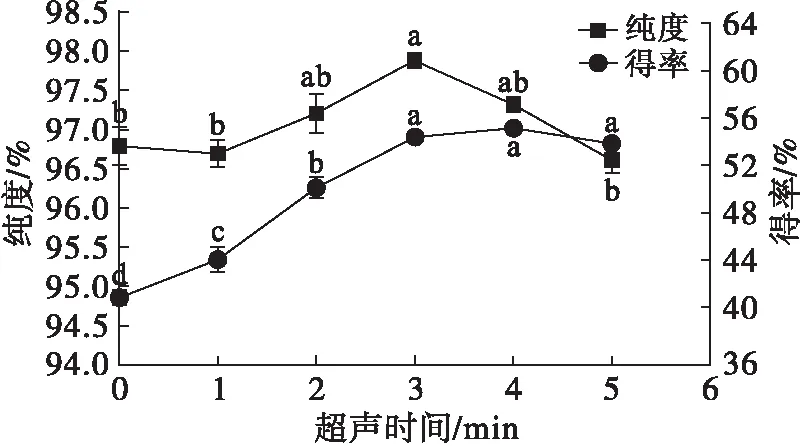
图6 超声时间对豆甾醇纯度和得率的影响
由图6可知,与未进行超声处理的实验组进行比较,豆甾醇得率显著提高。这是由于超声波产生的“空化”作用,缩短了从过饱和态到晶核形成并析出晶体之间的诱导期,加快了晶体的生长速率,促使得率显著提高;同时,“空化”作用产生的空化气泡能侵蚀剥落晶体外表面的杂质层,降低由于杂质包裹引起晶体的各向生长异性,从而伴随豆甾醇晶体析出的杂质分子较少,因此纯度提高[15]。当超声时间为3 min时,甾醇纯度提升至最高的97.86%,而得率提升至54.30%,继续延长超声时间,豆甾醇得率趋于稳定,而豆甾醇纯度降低,因此选择超声时间为3 min进行后续实验。
2.2.3 超声功率的选择
控制料液比1∶65、超声时间3 min、养晶温度25℃、养晶时间4 h,考察不同超声功率对豆甾醇精制效果的影响,结果如图7所示。

图7 超声功率对豆甾醇纯度和得率的影响
由图7可知,随着超声功率的提高,豆甾醇得率、纯度先升高后降低。当超声功率分别为80、90 W时,豆甾醇纯度和得率分别达到最大。这是因为提高超声功率晶体的粒度减小,晶体粒度减小虽可防止晶体聚结并缩短结晶时间,但过小的晶体粒度也会增加单位晶体的生长时间,从而在相同养晶时间内晶体析出量减少,得率降低[18],且过小的粒度易重新聚集并包裹杂质,从而导致纯度下降。综合考虑,超声功率为90 W较合适。
2.2.4 料液比的选择
控制超声时间3 min、超声功率90 W、养晶温度25℃、养晶时间4 h,考察不同料液比对豆甾醇精制效果的影响,结果如图8所示。

图8 料液比对豆甾醇纯度和得率的影响
在结晶体系中,料液比越大,过饱和度越小,溶剂体系更有利于晶核的有序生长,且晶体依附于晶核缓慢生长形成完整性较好的晶体往往纯度也较高,但是晶体析出缓慢也是得率偏低的原因之一。反之,高过饱和度增大了体系的传质阻力,晶体趋于不均匀性生长,虽然晶体的快速析出促使了得率的显著提高,但杂乱无序的晶体快速生长所包藏的母液、非目标晶体和杂质等也直接导致了纯度的较低。由图8可知,随着料液比的增大,豆甾醇得率显著下降,而纯度逐步提升后趋于平缓,当料液比为1∶70时,纯度达到97.4%左右,且得率并未显著下降。综合考虑,选择1∶70为豆甾醇精制的最佳料液比。
机车无动力回送中,由于其空气压缩机无电停止使用,此时必须开放机车无动力装置。无动力装置由:DE无动力塞门、DER压力调整阀、C2充风节流孔、CV单向止回阀等部分组成。
2.2.5 养晶温度的选择
控制料液比1∶70、超声时间3 min、超声功率90 W、养晶时间4 h,考察不同养晶温度对豆甾醇精制效果的影响,结果如图9所示。

图9 养晶温度对豆甾醇纯度和得率的影响
由图9可知,随养晶温度升高,豆甾醇纯度增大,得率降低。当养晶温度为15℃时,豆甾醇得率高达68%左右,但其纯度仅为96.5%左右,说明温度过低促使体系温差扩大,晶体快速形成的同时,其余杂质被晶体包裹而析出;反之养晶温度的升高缩小了体系温差,减缓结晶速率,纯度随之显著提高。可以发现,豆甾醇纯度在30℃时达到顶峰,但得率较之于25℃显著下降,且25~35℃区间内纯度并无显著差异。因此,接近常温的25℃为较合适的养晶温度。
2.2.6 养晶时间的选择
选取料液比1∶70、超声时间3 min、超声功率90 W、养晶温度25℃,考察不同养晶时间对豆甾醇精制效果的影响,结果如图10所示。

图10 养晶时间对豆甾醇纯度和得率的影响
由图10可知,3 h前随养晶时间延长,豆甾醇得率不断提高,纯度先增大后降低,但无显著性变化,然而3 h后豆甾醇纯度和得率均呈下降趋势。这可能是由于豆甾醇晶体已完全析出,而非目标溶质附着于豆甾醇晶体表面形成的共结晶现象所致。因此,选择3 h为豆甾醇精制的养晶时间较为合适。
根据上述单因素实验结果,选择丙酮为溶剂,料液比1∶70,养晶温度25℃,养晶时间3 h,超声时间3 min,超声功率90 W对豆甾醇进行2次精制,豆甾醇纯度达到了99.36%,其GC-MS谱图见图11。
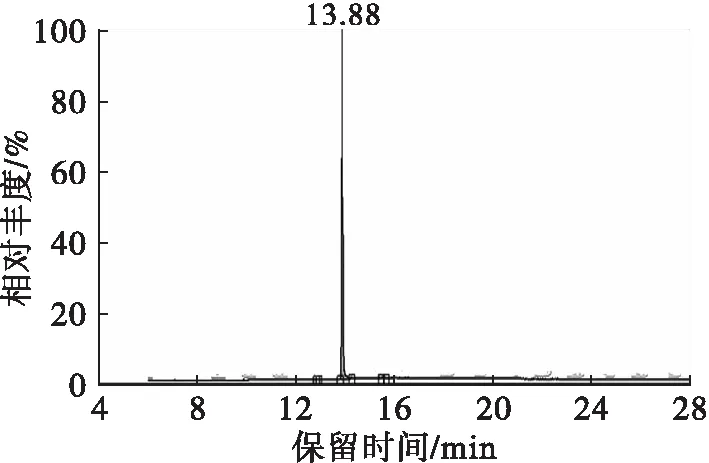
图11 豆甾醇的GC-MS谱图
2.3 结构鉴定
2.3.1 MS(见图12)
一般含有羟基(—OH)和氨基(—NH2)的化合物都能被三甲基硅烷化,常用符号“TMS(Trimethylsiyl)”表示。如图12所示,豆甾醇(ST)经衍生化后,会形成其硅烷化衍生物ST-TMS。ST-TMS在质谱条件下,羟基中的氧会获得一个质子,从而形成[ST-TMS+H]+母离子(m/z484.46)。母离子丢失一个TMS-OH后,会形成相应的[ST-TMS+H—TMS-OH]+(m/z394.41);丢失侧链和TMS-OH后,会形成相应的[ST-TMS+H—TMS-OH—side chain]+(m/z255.20)。图11中,保留时间为13.88 min的物质相应的质谱图可以找到离子m/z484.46、m/z394.41和m/z255.20,可以鉴定其对应的产物为豆甾醇。
2.3.2 FT-IR(见图13)

经与文献[20]对照发现,该样品存在豆甾醇的特征吸收峰,如970 cm-1和960 cm-1,说明上述工艺所得高纯度样品为豆甾醇。

图12 豆甾醇的MS谱图
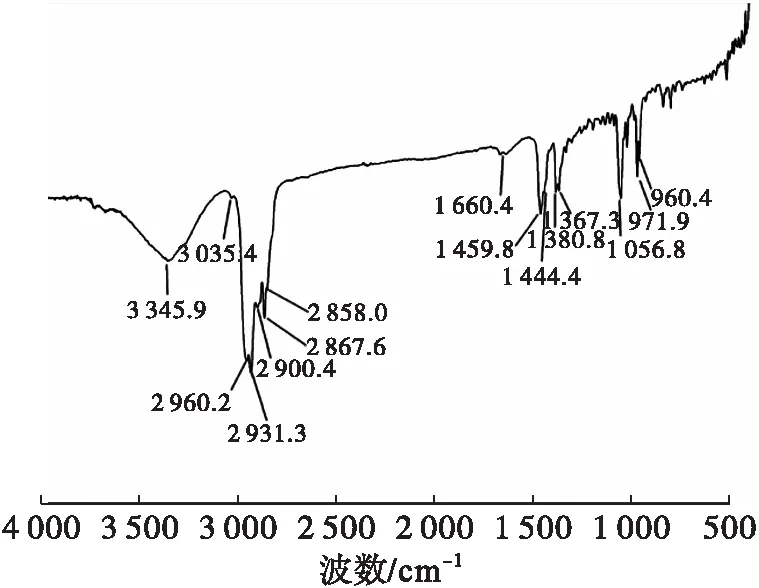
图13 豆甾醇的FT-IR谱图
2.3.3 NMR
为了进一步验证结晶产品为豆甾醇,通过核磁共振对样品进行了结构表征。图14为豆甾醇的1H NMR谱图及分子结构示意图。
豆甾醇1H NMR(400 MW,CDCl3)图解:1H NMR(400 MW,Chloroform-d)δ5.35(d,J=5.3 W,1H),δ5.15(dd,J=15.1、8.6 W,1H),δ5.02(dd,J=15.2、8.6 W,1H),δ3.52(s,1H),δ2.35~2.18(m,2H),δ2.11~1.92(m,3H),δ1.91~1.77(m,2H),δ1.70(ddd,J=14.6、9.3、5.5 W,1H),δ1.59~1.40(m,12H),δ1.28~0.90(m,13H),δ0.88~0.77(m,8H),δ0.70(s,3H)。
豆甾醇的C6、C22、C23、C3上的氢对应的化学位移分别为5.35、5.15、5.02和3.52,质量比为1.21∶1.16∶1.08∶1.23,约为1∶1∶1∶1,且由豆甾醇1H NMR(400 MW,CDCl3)图解可知,积分图14所得氢原子与豆甾醇分子结构式理论氢原子数相同,并与文献[3,21]核磁分析数据相符,符合豆甾醇结构式。
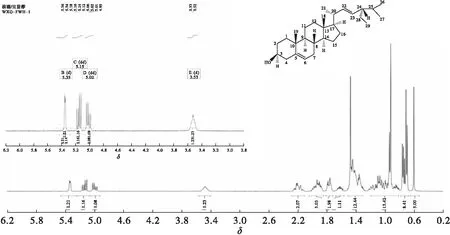
图14 豆甾醇的1H NMR谱图及分子结构示意图
3 结 论
通过多级分步结晶法将豆甾醇纯化分为富集和精制两步工艺,富集工艺探究非极性溶剂的筛选、料液比、养晶温度和养晶时间对目标物纯度和得率的影响。单因素实验确定最佳的豆甾醇富集条件为:以环己酮为结晶溶剂,料液比1∶3.5,养晶温度25℃,养晶时间16 h。在最佳富集条件下重复结晶5次,豆甾醇的纯度达到94.69%。辅以超声辅助进一步精制豆甾醇,单因素实验结果表明在以丙酮为精制溶剂、超声时间3 min、超声功率90 W、料液比1∶70、养晶温度25℃、养晶时间3 h为结晶条件,经过2次结晶豆甾醇的纯度达到99.36%,实现了高纯度豆甾醇的制备,经质谱、红外光谱和核磁等结构鉴定确认富集精制工艺制得的样品为豆甾醇。
