踝蛋白的功能及其研究进展
2019-11-19阿依木古丽·艾尼叶建蔚李静
阿依木古丽·艾尼 叶建蔚 李静
[摘要] 踝蛋白(Talin)作为整合素激活及信号传导过程中的重要蛋白,介导细胞运动,是细胞运动相关疾病发生发展的重要调控蛋白。它控制整合素(integrin)由内向外(inside-out)激活及肌动蛋白(action)丝锚定,对肌动蛋白-细胞外基质间机械耦合的建立起重要作用。Talin对内皮祖细胞(EPCs)的黏附、分化具有调节作用,因此与多种心血管等疾病的起病及病程的进展息息相关,此外在肿瘤的发生、转移及治疗中也发挥重要作用。本文就Talin的结构、其在细胞黏附动力学中的生物学特征,及对相关心血管等疾病的调控作用等方面做一全面阐述。
[关键词] 踝蛋白;生物学特征;功能;整合素信号通路
[中图分类号] R730.2 [文献标识码] A [文章编号] 1673-7210(2019)09(c)-0037-04
Function and research progress of ankle protein
Ayimuguli Aini1,2 YE Jianwei3 LI Jing1
1.School of Basic Medicine, Xinjiang Medical University, Xinjiang Uygur Autonomous Region, Urumchi 830011, China; 2.the First Clinical Medical College, Xinjiang Medical University, Xinjiang Uygur Autonomous Region, Urumchi 830054, China; 3.Cancer Center, the First Affiliated Hospital of Xinjiang Medical University, Xinjiang Uygur Autonomous Region, Urumchi 830054, China
[Abstract] Talin (ankle protein) as an important protein in integrin activation and signal transduction, Talin mediates cell movement and is an important regulatory protein in the occurrence and development of motion-related diseases. It controls integrin activation from inside-out and action wire anchoring, and plays an important role in the establishment of mechanical coupling between actin and extracellular matrix. Talin regulates the adhesion and differentiation of endothelial progenitor cells (EPCs), so it is closely related to the onset and progression of various cardiovascular diseases. In addition, Talin also plays an important role in the occurrence, metastasis and treatment of tumors. In this paper, the structure of Talin, its biological characteristics in cell adhesion dynamics, and its regulatory role in related cardiovascular diseases were comprehensively described.
[Key words] Talin; Biological characteristics; Function; Integrin signaling pathway
踝蛋白(Talin)是一種细胞骨架蛋白,对细胞的黏附动力有重要调控作用,参与血管内皮祖细胞的分化以及血管平滑肌细胞的增殖,与心血管疾病、肾脏疾病和有些慢性肌病的发生发展有关,尤其是在动脉粥样硬化(atherosclerosis,AS)、主动脉夹层等心血管疾病中有至关重要的作用。另外,Talin与多种癌症的发展进程及转移密切相关,其相关研究多集中在食管鳞癌、肝癌、结肠癌、前列腺癌、乳腺癌等方面。本文将对目前Talin的生物学特征以及相关疾病发生发展中的作用研究作一综述。
1 Talin的结构
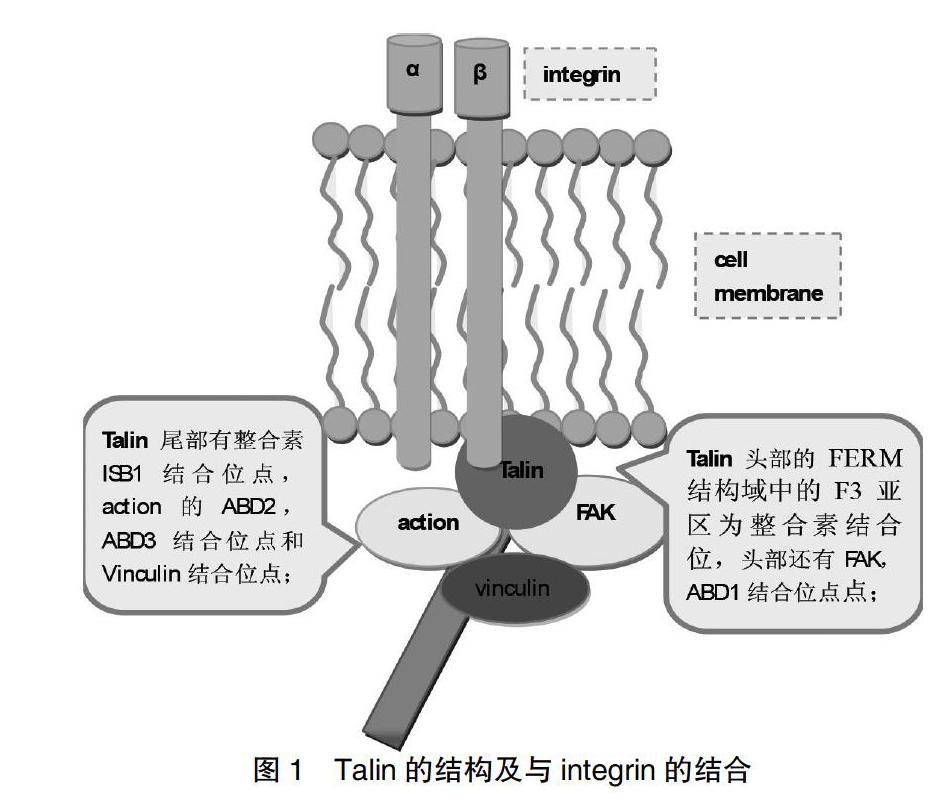
Talin作为一个大分子量蛋白,由2541个氨基酸组成,长度约为60 nm,大小270 kDa[1-2]。N端含有1个由four-point-one-protein、ezrin、radixin、moesin构成的结构域,为FERM结构域,Talin与其他含有FERM结构域的蛋白质不同的是具有F0、F1、F2、F3等4个亚区域[2],而不是典型的F1、F2、F3结构域;C端尾部包含R1~R13的13个结构域,R1~R13由62个两亲性α-螺旋组成,排列成四螺旋(R2,R3,R4和R8)和五螺旋(R1、R5、R6、R7、R9、R10、R11、R12和R13)束结构域[3]。
Talin具有两个整合素结合位点,其中头部末端的FERM结构域中的F3亚区即为整合素的一个结合位点,通过先与整合素β尾区的天冬酰胺-脯-Xaa-酪氨酸模体结合,再与近模螺旋体结合,从而激活整合素[2];另一个结合位点在C端尾部的末端,是与整合素αⅡb结合位点1(integrin binding site 1,IBS1)[4]。肌动蛋白结合结构域中,ABD1结构域在N端,ABD2和ABD3结构域在C端[5]。随着对Talin的深入研究,Talin杆部的功能也越来越突出,尤其是IBS2结构域在整合素信号转导中所起的作用如今日益受关注[4]。在敲除Talin的细胞中发现,当仅转入Talin头部时可使整合素活化,但不能发挥完整的功能,只有转入全长的Talin时才能产生细胞骨架蛋白和细胞外基质间的连接[6]。
2 Talin与整合素
整合素是一种重要的信号分子及细胞表面黏附分子,由α和β亚基构成,两种亚基通过非共价键链接形成异源二聚体结构[7]。Talin作为整合素活化的关键蛋白,在整合素激活的inside-out的信号传递过程中,促进细胞外功能区的亲和力增强,使其头部与整合素β尾区结合,从而改变整合素跨膜区的稳定性,引发整合素胞外区域重排列及抑制αⅡb与β3尾部间的相互作用使整合素的构象改变而活化[8]。见图1。Talin通过激活、调控整合素而介导细胞的生物学行为,调控免疫性、AS等心血管性疾病的发生发展和肿瘤细胞的迁移[9]。
Talin为整合素和肌动蛋白细胞骨架之间建立直接的联系[10],参与细胞骨架中outside-in的信号传导及整合素激活过程中的inside-out的信号传导,发挥细胞内外的桥梁作用[9]。可见,Talin作为整合素活化的重要调控蛋白,在细胞运动迁移、细胞骨架形态改变及各种疾病的发生发展中有着极其重要的作用[11]。
3 Talin的生物学功能
3.1 Talin在细胞黏附动力学中的作用
细胞黏附的形成依赖细胞表面的黏附分子之间的相互作用,这种相互作用由细胞表面受体和底物的相应配体的结合所介导[12]。细胞黏附在细胞的信息传递中具有重要的作用,研究[13]发现,细胞黏附的改变在骨关节疾病、肿瘤及AS等很多疾病的发生发展中起决定性作用,细胞黏附的细胞机械力正在成为控制黏附生长、成熟和细胞迁移的关键因素[14]。研究[15]表明,细胞黏附的形成过程中需要结构蛋白和调节蛋白等多种蛋白质参与,但是既能与整合素又能与肌钙蛋白直接连接的蛋白质仅有Talin、细丝蛋白(filamin)、α-肌动蛋白等,由此可见,Talin在细胞黏附的形成及发挥功能中有非常重要的作用,也日益受到关注。
3.2 Talin与细胞骨架(CSK)的关系
细胞的生物学行为、细胞形态结构的改变及细胞的功能出现异常均与细胞骨架发生重塑有关,维持细胞正常的结构和功能依赖于细胞骨架的微丝、中间丝和微管等成分的高度整合;癌症等转移性疾病中,癌细胞发生转移的基础是细胞骨架发生重塑[16]。
Talin作为被招募至黏着斑复合体的细胞骨架蛋白及肌动蛋白结合蛋白,对细胞骨架的组织,骨架与细胞外基质(extracellular matrix,ECM)的联系都至关重要[17]。Talin的关键作用在于整合素的结构转化为其ECM配体的高亲和力构象[18]。整合素的胞外区受到刺激后将刺激传递给胞内时,整合素的β亞单位与细胞骨架之间发生偶联,并且将刺激转化为细胞内信号,进而引起细胞骨架、细胞核及细胞质发生一系列反应[19]。整合素α链与β链尾部的螺旋结构中,有疏水区及静电压力结合区,当这区域间的作用被Talin构象改变而受到影响时,整合素的结构也发生改变,即细胞骨架对整合素产生outside-in的调节,从而影响力信号的转化和信号在整合素上的传导[20],Talin在这信号传导过程中发挥枢纽作用。由此可见,Talin激活整合素的作用与细胞骨架形态改变以及信号传导,提供机械力等方面有密切关系,具体作用仍然需要进一步的研究。
3.3 Talin在切应力促血管内皮祖细胞(EPCs)分化过程中的作用
内皮细胞损伤与心血管疾病的发生发展息息相关,如AS是影响人类健康的危险因素之一,最近发生率的升高使其成为研究热点。有研究[21]表明,AS发生过程中内皮细胞的损伤是很重要的因素,而内皮的修复对AS的治疗有重要意义。内皮祖细胞作为血管内皮细胞的前提细胞,其结构和功能的研究一直受人们关注。
目前研究[22]发现,血液流动产生的切应力可以促进内皮祖细胞增殖分化。Talin在细胞黏附,分化等生物学行为中的作用已得到验证,而在细胞外基质-整合素-细胞骨架系统中,Talin也是个重要的信号分子[23],多项研究已证明Talin在整合素的激活,以及对于黏附的调控,在细胞迁移中有至关重要的作用[24],所以考虑Talin对血管内皮祖细胞的分化的也有调节作用。在Talin、FAK、paxillin对切应力促进内皮祖细胞分化的调节实验中发现[25],Talin主要位于胞浆表达,而且聚集在细胞核的周围,表达量丰富;而切应力作用以后,Talin表达量减少,表明切应力作用后Talin的表达量发生变化。由此推测,Talin作为机械耦合建立中的重要蛋白,可能对切应力促内皮祖细胞的分化过程起了调节作用,参与了切应力调控内皮祖细胞分化的跨膜信号传导。因此认为Talin的表达水平发生变化与AS的发病并病情的进展以及AS的诊断治疗有密切的关系,Talin有望成为AS的发病机制及治疗研究中的新靶点。
3.4 Talin在疾病中的作用
Talin在细胞黏附动力学、细胞骨架及其发生重塑、内皮细胞的分化中具有重要作用,其异常表达与肿瘤、主动脉夹层、肾脏疾病、多发性硬化、渐进性肌病等多种疾病的发生发展密切相关。研究[26]发现,Talin的表达水平在正常组织及肿瘤组织中存在明显差异,口腔鳞状细胞癌、食管癌、肝癌、结肠癌、前列腺癌、乳腺癌、卵巢癌等多种癌症中的相关研究证明,Talin在肿瘤细胞迁移、侵袭和预测患者预后等方面有非常重要的作用,可作为治疗肿瘤的新型分子靶点及诊断指标。
肌纤维与ECM的黏附是骨骼肌发育和发挥功能的关键,β1整合素是骨骼肌中的ECM受体,控制成肌细胞融合、肌纤维细胞骨架的组装和肌腱连接的维持(maintenance of myotendinous junctions,MTJs);通过对骨骼肌中缺乏Talin1的小鼠出现MTJs逐渐失效,小鼠患有渐进性肌病[27]。由此推测,Talin与渐进性肌病的发生有关。
主动脉夹层发生的病理过程中血管发生病理性的重塑起着重要作用[28]。主动脉壁正常的结构和功能特性的维持关键在于血管平滑肌细胞[29],其异常增殖和迁移、功能的改变通过影响血管介质结构和功能的稳定性引起病理性血管重塑和血管疾病的发生[30]。通过从器官捐献者和主动脉夹层患者中获取标本,对Talin与主动脉夹层血管平滑肌细胞增殖和迁移的关系进行研究发现[31],Talin主要在人主动脉样本中表达,在发生主动脉夹层的组织中,Talin的表达水平下降;而且其表达下调增强了血管平滑肌细胞的增殖和迁移能力,因此认为Talin参加了主动脉夹层的发生,也有望成为主动脉夹层治疗的新靶点。
肾脏疾病的研究中发现,Talin的結合位点中,存在于足细胞中表达的KANK蛋白的易位位点,如果突变,则导致肾病综合征[32];通过对足细胞中几种蛋白质的表达进行研究发现,足细胞发育过程中缺乏Talin-1的小鼠出生后患有肾功能衰竭[33]。多发性硬化是一种自身免疫性脱髓鞘疾病,而此类患者有一种自身抗体,即抗Talin1抗体,由此推测多发性硬化患者血清中的可溶性Talin1的水平与此病发生发展具有一定的关系,通过酶联免疫吸附测定的方法对多发性硬化患者的血清可溶性Talin1的水平进行检测发现,多发性硬化患者血清可溶性Talin1的水平升高,因此认为血清可溶性Talin1可能在多发性硬化发病中起作用,机制仍需深入研究[34]。
4结语和展望
综上所述,Talin作为重要的细胞骨架蛋白和调控蛋白,通过激活整合素,从而介导细胞运动,又作为一个多功能的蛋白,不仅在整合素和细胞骨架之间发挥调控作用,可以通过不同的作用机制在不同的细胞环境中发挥特定的功能。而且也有研究[18]认为,整合素发挥作用需要Talin的激活调控,而Talin发挥作用可能不需要整合素起作用。如今,随着对Talin蛋白结构、功能,以及与其他蛋白间相互作用的广泛研究[26-34]表明,Talin在多种疾病的发生发展过程中的作用成为研究热点。心血管疾病对人类危害的加重以及随着对Talin的研究的深入,Talin在心血管疾病中的作用越来越突出,尤其是在AS的发病和治疗方面的作用日益受关注。这些也将会是以后的研究中的热点及努力的重点方向。
[参考文献]
[1] Geiger B,Spatz JP,Bershadsky AD. Environmental sensing through focal [J]. Nat Rev Mol Cell,2009,10(1):21-33.
[2] Goult BT,Kopp PM,Elliott PR,et al. The structure of the talin head reveals a novel extended conformation of the FERM domain [J]. Structure,2010,18(10/13):1289-1299.
[3] Gingras AR,Bate N,Goult BT,et al. The structure of the C-terminal actin-binding domain of talin [J]. Embo,2008,27(2):458-469.
[4] Gingras AR,Ziegler WH,Bobkova A,et al. Structuraldetemina ofintegrin bindingto the Lalin rod [J]. Biol Chem,2009,284(13):8866-8876.
[5] Das M,Subbayya Ithychanda S,Qin J,et al. Mechanisms of talin dependent integrin signaling and crosstalk [J]. Biolchim Biophys Acta,2014,1838(2):579-588.
[6] Zhang X,Jiang G,Cai Y,et al. Talin depletionreveals ind ependence of initial cell spreading from integnin activation and traction [J]. NatCell Biol,2008,10(9):1062-1068.
[7] Humphries JD,Byron A,Humphries MJ. Interin ligands at a glance [J]. Cell Sci,2006,119(19):3901-3903.
[8] Shattil SJ,Kim C,Ginsberg MH. The final steps of integrin activation:the end game [J]. Nat Rev Mol Cell Biol,2010,11(4):288-300.
[9] Luo BH,Springer TA. Integrin structures and conformational signaling [J]. Curr Opin Cell Biol,2006,18(5):579-586.
[10] Critchley,DR. Biochemical and structural properties of the integrin associated cytoskeletal protein talin [J]. Annu Rev Biophys,2009,38,235-254.
[11] Zhu J,Luo BH,Xiao T,et al. Structureofa complete integrin ectodomain in a physiologic resting state and activation and deactivation byapplied forces [J]. Molecular cell,2008,32(6):849-861.
[12] Samadi-Dooki A,Shodia Hmmalekmotiei L. The effect of the physical properties of the substrate on the kinetics of cell adhesion andcrawling studied by an axisymmetric diffusion-energy balance coupled model [J]. Soft Matter,2015,14,11(18):3693-3705.
[13] Khalili AA,Ahmad MR. A Review of Cell Adhesion Studies for Biomedical and Biological Applications,Int [J]. Mol Sci,2015,16(8):18149-18184.
[14] Paszek MJ,Dufort CC,Rossier O,et al. The cancer glycocalyx mechanically primes integrinmediated growth and survival [J]. Nature,2014,511(7509):319-325.
[15] Zaidel -Bar R,Geiger B. The switchable integrin adhesome [J]. Cell Sci,2010,123(9):1385-1388.
[16] Fife CM,Mccarroll JA,Kavallarisbr M. Movers and shakers:cell cytoskeleton in cancer metastasis [J]. Br Pharmacol,2014,171(24):5507-5523.
[17] Shattil SJ, Kim C,Ginsberg MH. The final steps of integrin activation:the end game [J]. Nat Rev Mol Cell Biol,2010,11(4):288-300.
[18] Klapholz B,Brown NH. Talin- the master of integrin adhesions [J]. Cell Sci,2017,130(15):2435-2446.
[19] Lower RF. Integrins and chondrocyte-matrix interactions in articular cartilage [J]. Matrix Biol,2014,39:11-16.
[20] Liu W,Guan NZ,Deng X,et al. Effect of integrin beta1 on adhesion and migration of humantrophoblast cells [J]. Biol Chem,2010,27(1):67.
[21] Mannarino E,Pirro M. Endothelial injury and repair a novel theory for atherosclerosis [J]. Angiology,2008,59(2):69-72.
[22] Yamamoto K,Takahashy T,Asahara T,et al. Proliferation,differentiation,and tube formation by endothelial progenitor cells in response to shear stress [J]. Appl Physiol,2008,95(5):2081-2088.
[23] Parsons J. Focal adhesion kinase:the first ten years [J]. Cell Sci,2008,11(6):1409-1416.
[24] Akagi T,Murata K,Shishido T,et al. V-Crk activates the phosphoinositide 3-Kinase/AKT pattway by utilizing focal adhesion kinase and H-Ras [J]. Mol Cell Biol,2009, 20(2):7015-7023.
[25] Peti v,Thiery JP. Focal adhesions:structure and dynamics [J]. Biol Cell,2000,92(7):477-494.
[26] Shen J,He XZ,Jiang JT. Advances in the expression and role of talin protein in cancer cells [J]. Chin J Clin Lab Sci,2017,35(7):525-526.
[27] Conti FJ,Felder A,Monkley S,et al. Progressive myopathy and defects in the maintenance of myotendinous junctions in mice that lack talin1 in skeletal muscle [J]. Development,2008,135(11):2043-2053.
[28] Yang CP,Hsu CP,Chen WY,et al. Aortic remodeling after endovascular repair with stainless steel-based stent graft in acute and chronic type b aortic dissection [J]. Vasc Surg,2012,55(6):1600-1610.
[29] Golledge J,Eagle Ka. Acute aortic dissection [J]. Lancet,2008,372(9632):55-66.
[30] Satoh K,Matoba T,Suzuki J,et al. Cyclophilin A mediates vascular remodeling by promoting inflammation and vascular smooth muscle cell proliferation [J]. Circulation,2008,117(24):3088-3098.
[31] Wei X,Sun Y,Wu Y,et al. Downregulation of Talin-1 expression associates with increased proliferation and migration of vascular smooth muscle cells in aortic dissection [J]. BMC Cardiovascular Disorders,2017,17(1):162.
[32] Gee HY,Zhang F,Ashraf S,et al. KANK deficiency leads to podocy tedys functionandne-phrotic syndrome [J]. Clin Invest,2015,125(6):2375-2384.
[33] Tina X,Kim JJ,Monkley SM,et al. Podocyte-associated talin1 is critical forglomeru-larfiltration barrier maintenance [J]. Clin Invest,2014,124(3):1098-1113.
[34] Muto M,Mori M,Liu J,et al. Serum soluble Talin-1 levels are elevated in patients with multiple sclerosis,reflecting its disease activity [J]. Neuroimmunol,2017, 305:131-134.
(收稿日期:2019-03-05 本文編辑:封 华)
